Какова плотность соли поваренной: Какова плотность раствора поваренной соли, если тело объемом 200 кубических см выталкивает из раствора силой 2,26Н
Содержание
Плотность солей. Температура плавления соли
В таблице представлена плотность расплава солей (жидкой соли) и элементов, образующих эти соли, а также их температура плавления. Плотность соли дана при температуре расплава, в размерности г/см3.
Рассмотрены следующие соли: бромид, хлорид, йодид, нитрат, сульфат, фторид, карбонат; соли следующих металлов: серебра, алюминия, мышьяка, золота, бора, бария, бериллия, висмута, кальция, кадмия, церия, кобальта, хрома, цезия, меди, диспрозия, эрбия, европия, железа, галлия, гадолиния, германия, гафния, ртути, гольмия, индия, иридия, калия, лантана, лития, лютеция, магния, марганца, молибдена, натрия, неодима, никеля, осмия, свинца, палладия, празеодима, платины, плутония, рубидия, рения, родия, рутения, сурьмы, скандия, селена, самария, олова, стронция, тантала, тербия, теллура, тория, титана, таллия, тулия, урана, ванадия, вольфрама, иттрия, иттербия, цинка, циркония.
Следует отметить, что наибольшей плотностью обладают жидкие соли таких тяжелых металлов, как свинец и уран. Например, плотность расплавов солей йодида свинца PbI2, по данным таблицы, равна 5,691 г/см3, а плотность тетрафторида урана UF4 составляет величину 6,485 г/см3. К легким солям, с малой плотностью относятся соли алюминия, бериллия, лития, калия и циркония.
Например, плотность расплавов солей йодида свинца PbI2, по данным таблицы, равна 5,691 г/см3, а плотность тетрафторида урана UF4 составляет величину 6,485 г/см3. К легким солям, с малой плотностью относятся соли алюминия, бериллия, лития, калия и циркония.
Плотность большинства солей в жидком состоянии меньше, чем в твердом. Это объясняется увеличением объема соли при нагревании — жидкая соль всегда находится при высоких температурах. Например, плотность поваренной соли NaCl в кристаллическом состоянии при комнатной температуре равна 2,17 г/см3, а плотность жидкого хлорида натрия (при температуре 801°С) уменьшается и становится равной 1,556 г/см3.
Наименьшая температура плавления соли в таблице соответствует хлориду олова SnCl4 — он плавится при температуре минус 33°С, то есть при комнатной температуре находится в жидком состоянии и на воздухе дымит из-за реакции с парами воды.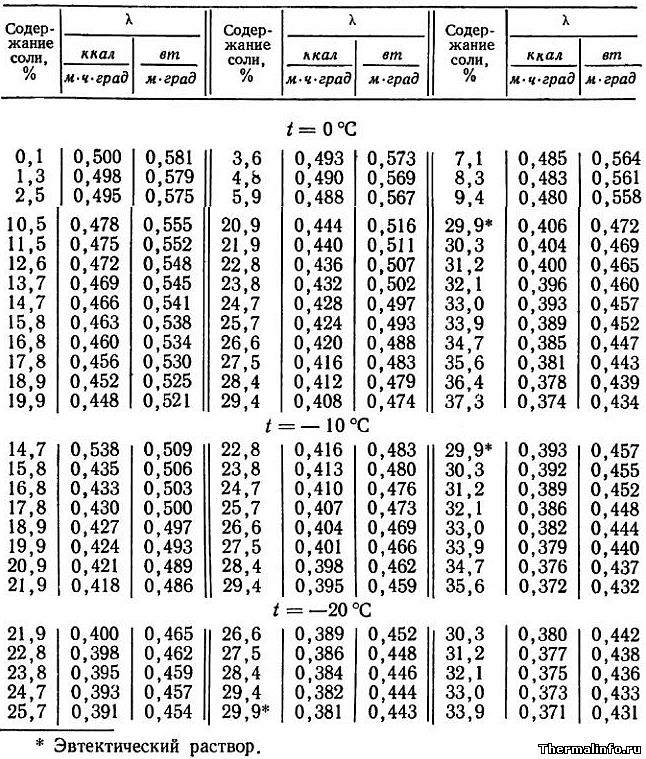
Самой тугоплавкой солью с максимальной температурой плавления, по данным таблицы, является фторид лантана LaF3 — фтористый лантан плавится при температуре 1493°С.
Источник:
Волков. А.И., Жарский. И.М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
Насыпная плотность некоторых сыпучих материалов в г/л или кг/м3 Насыпная плотность – это отношение массы к занимаемому объему.
(по материалам сайта www.
| г. Москва, г. Москва, |
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Справочник инженера / / Инженеры и еда. Рецепты, полезности. Трюки для ресторанов. / / Плотность и масса в популярных объемах пищевых продуктов. Сколько крупы, соли, сахара в стакане, ложке и т.д. Вооружаемся для прочтения дебильных рецептов на упаковках.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Концентрация растворов
Концентрации растворов обычно выражают в массовых (весовых) и объемных (для жидкостей) процентах, в молях или грамм-эквивалентах, содержащихся в единице объема раствора, а также титром и моляльностью.
Концентрации приблизительных растворов большей частью выражают в массовых процентах; точных — в молях, в грамм-эквивалентах, содержащихся в 1 л раствора, или титром.
При выражении концентрации в массовых процентах указывают содержание растворенного вещества (в граммах) в 100 г раствора (но не в 100 мл раствора!).
Так, если говорят, например, что взят 10%-ный раствор поваренной соли NaCl, это значит, что в 100 г раствора (а не в 100 мл его) содержится 10 г поваренной соли и 90 г воды.
Когда дана концентрация раствора, выраженная в массовых процентах (например, 25%-ный раствор NaCl), и хотят взять столько раствора, чтобы в нем содержалось определенное количество растворенного вещества (например, 5 г NaCl), то нужно брать раствор по массе (т. е. 20 г).
Покажем, что будет, если взять не 20 г раствора, а 20 мл. Плотность 25%-ного раствора NaCl равна 1,203 г/мл. Поэтому взяв 20 мл такого раствора, мы возьмем 20*1,203 = 24,06 г его. В этом количестве раствора будет содержаться уже не 5 г NaCl, а
Если известна плотность раствора, то, как указывалось выше, удобнее брать его по объему, а не по массе. Для нашего случая получаем объем, равный:
Сказанное относится преимущественно к концентрированным растворам; в случае же разбавленных (меньше 1%) получающаяся ошибка незначительна и ею можно пренебречь.
Концентрация раствора, выраженная в молях, содержащихся в 1 л раствора (но не в 1 л растворителя!) называется молярностью. Раствор, содержащий в 1 л 1 моль растворенного вещества, называется одномолярным или просто молярным. Молем (грамм-молекулой) какого-либо вещества называют молекулярный вес его, выраженный в граммах; 0,001 моль называют миллимолем, этой величиной пользуются для выражения концентрации при некоторых исследованиях.
Пример. Моль серной кислоты равен 98,08 г, поэтому молярный раствор ее должен содержать это количество в 1 л раствора (но не в 1 л воды).
Если концентрация выражена числом грамм-эквивалентов, содержащихся в 1 л раствора, то такое выражение концентрации называется нормальностью. Раствор, содержащий в 1 л один грамм-эквивалент вещества, называется однонормальным или часто просто нормальным.
Грамм-эквивалентом вещества является такое количество его, выраженное в граммах, которое в данной реакции соединяется, вытесняет или эквивалентно 1,008 г водорода (т. е. 1 г-атом). Грамм-эквивалент одного и того же вещества может иметь различную величину в зависимости от той химической реакции, в которой это вещество участвует.
Грамм-эквивалент E в реакциях замещения вычисляют путем деления молекулярного веса на основность кислоты или полученной из нее соли, кислотность основания или при окислительно-восстановительных реакциях — на число переходящих электронов n:
Ввиду того что нормальные растворы для большийства аналитических целей и работ слишком концентрированы, обычно готовят более разбавленные растворы (полунормальные, децинормальные и т. д.). При записях нормальность обозначают русской буквой н. или латинской буквой N; перед буквенным обозначением ставят число, указывающее, какая часть грамм-эквивалента (или сколько грамм-эквивалентов) взята для приготовления. 1 л раствора. Так, полунормальный раствор обозначается 0,5 н., децинормальный 0,1 н. и т. д.
Титром называют содержание вещества в граммах в 1 мл раствора. Выражая концентрацию раствора при помощи титра, указывают число граммов вещества, содержащихся в 1 мл раствора. Пусть, например, в 1 л раствора содержится 5,843 г серной кислоты; тогда титр раствора будет равен;
Моляльными называют растворы, приготовляемые растворением одного (или части) моля вещества в 1 кг растворителя. Например, для приготовления одномоляль-ного раствора NaCl растворяют 58,457 г этой соли в 1 кг воды, приведя массу воды в данных условиях к объему. Следует помнить, что при приготовлении моляльных растворов расчет ведут именно на 1 кг растворителя, а не раствора, как в случае молярных или нормальных растворов.
Объемные проценты для выражения концентрации применяют только при смешивании взаимно растворяющихся жидкостей. Здесь указаны только основные, важнейшие приемы выражения концентраций. При специальных исследованиях могут применяться и другие единицы для выражения содержания вещества.
К оглавлению
см. также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
Соль и здоровье
Соль — пожалуй, самый противоречивый продукт на нашем столе и в быту. Научные споры относительно влияния соли на здоровье человека не утихают до сих пор. Одни называют ее «белой смертью», «медленным ядом» и придерживаются так называемых бессолевых диет. Однако существует много доказательств того, что в ежедневном рационе соль необходима для здоровья. Любые колебания содержания соли в плазме крови приводят к нарушению обмена веществ, влияют на физиологические процессы в организме.
Поваренная соль — это кристаллический хлористый натрий, содержит 39,4% натрия и 60,6% хлора.Как известно, соль хорошо растворяется в воде любой температуры. Натрий входит в состав желчи, крови, цереброспинальной жидкости, сока поджелудочной железы. Он участвует в поддержании кислотно-щелочного равновесия, обмен натрия составляет важное звено водно-солевого обмена организма, обеспечивает постоянство внутренней среды организма. Он так же необходим и для нормальной работы нервных окончаний, передачи нервных импульсов и мышечной деятельности, включая мышцы сердца, а также для усвоения определенных питательных веществ тонким кишечником и почками.
Хлор, в свою очередь участвует в образовании особых веществ, способствующих расщеплению жиров. Необходим в образовании соляной кислоты — основного компонента желудочного сока, заботится о выведении из организма мочевины, стимулирует работу половой и центральной нервной систем, способствует формированию и росту костной ткани. Мышечная ткань человека содержит 0,20-0,52% хлора, костная — 0,09%; основная масса этого микроэлемента содержится в крови и внеклеточной жидкости.
Суточная потребность в соли в зонах умеренного климата — 10-15 г в сутки (годовая потребность человека в соли составляет 7 кг). В жарких странах идет большее отделение пота, большее потребление жидкости, поэтому соли требуется больше. В холодном климате водно-солевой обмен не такой интенсивный, потребление соли там меньше. Вот почему продолжительное время без соли могут обходиться многие народы Севера, например чукчи или эскимосы.
Потребность в соли увеличивается при физических нагрузках. И воду для утоления жажды рекомендуют пить не кипяченую, не дистиллированную, а минеральную, в которую входит хлорид натрия. А после интенсивных нагрузок (например, после длинных пеших переходов) рекомендуют пить слегка подсоленную воду и не пытаться утолять жажду чистой водой из горных ручьев, где очень низкое содержание соли.
При значительных потерях хлорида натрия организмом (неукротимая рвота, затяжные поносы) количество потребляемой соли сильно увеличивают, а в некоторых случаях даже приходится вводить раствор соли внутривенно.
Для питания человека соль не имеет заменителей и в этом смысле по значимости может быть сопоставима только с водой. Она необходима человеку, поскольку ее естественное количество в воде и растительной пище недостаточно для нашего организма.
Однако избыток соли в организме при усиленном потреблении ее не менее вреден – он вызывает различные заболевания. Отсюда видно, что необходим солевой баланс, который очень хрупок.Без соли невозможно существование ни одной живой клетки, в то же время смертельная доза для человека составляет всего 30 граммов.
Чрезмерное или просто повышенное потребление соли увеличивает риск сердечно-сосудистых заболеваний, может приводить к повышенному артериальному давлению, нарушению обмена кальция, отложению солей, различным заболеваниям суставов. Наряду с другими солями натрия, поваренная соль может стать причиной заболеваний глаз. Пересоленная пища — это возникновение отеков, увеличение нагрузки на почки. И еще одно коварство: чрезмерно соленые закуски возбуждают аппетит, а отсюда переедание, приводящее к лишнему весу — неприятная нагрузка на весь организм: в первую очередь на сердечно-сосудистую систему и на опорно-двигательный аппарат.
Однако многие ученые с этой точкой зрения не согласны. На их взгляд, если человек начинает страдать от гипертонии или ожирения, не соль является причиной. Скорее это свидетельствует о неправильном обмене веществ, а значит, надо искать причину, вызвавшую это нарушение, а не исключать соль из своего рациона.
К интересным результатам пришли болгарские и канадские медики, изучившие состояние здоровья и систему питания народностей, употребляющих в пищу много соли (например, буряты и монголы солят даже чай). Оказывается, у представителей этих народов гипертония встречается даже реже, чем у тех, кто ограничивает употребление соленой пищи. Ученые пришли к выводу, что соль опасна только для тех, кто генетически предрасположен к гипертонии.
Согласно новому заявлению ученых, суточная норма потребления соли не должна превышать 6 граммов (чайная ложка).Результаты последних исследований показали, что в среднем человек употребляет в день 12 граммов соли, что вдвое больше допустимой нормы. Надо иметь в виду, что натрий мы потребляем не только с поваренной солью, но и с другими соединениями натрия в виде консервантов (нитрат натрия), вкусовых добавок (глутамат натрия) или разрыхлителей (бикарбонат натрия).
В каких же продуктах оказывается большее количество соли, которое мы съедаем? Мало соли в овощах, плодах и крупах, а в сахарном песке хлорид натрия вовсе отсутствует. Наиболее высоко содержание натрия в продуктах, к которым добавлена соль: в хлебобулочных изделиях, колбасах, сыре и брынзе, соленой и копченой рыбе, квашеной капусте, консервированных оливках.
Так как мы употребляем в пищу, как правило, уже обработанные продукты, то большую часть соли мы получаем из них — в среднем 6,5 г в день. Только приблизительно 2 г мы съедаем, подсаливая пищу у домашней плиты или за столом. Добавление соли при приготовлении пищи и в готовые блюда необходимо, так как с натуральными продуктами ее поступает недостаточно.
Таким образом, можно сделать вывод о том, что соль является важным элементом, необходимым составляющим правильной и бесперебойной работы организма. Соль многоликая и одновременно полезная и вредная. Можно утверждать, что если контролировать содержание соли в рационе и соблюдать «золотую середину», то соль пойдет исключительно во благо и полностью оправдает словосочетание «соль жизни».
В настоящее время данная проблема, бесспорно, является весьма актуальной и современной. Каков же выход из положения? Самый правильный – разумное употребление соли в пределах положенной нормы. И желательно – натуральной соли, которую природа заготовила в свекле, моркови, картофеле, репе, морской растительности. Минералы из органических продуктов легче усваиваются организмом.
Важно помнить, что недостаток какого-либо вещества в нашем организме столь же вреден, сколь и переизбыток. Ведь в здоровом организме всё находится в равновесии, и любые крайности, связанные с переменой в питании, с отказом от какой-либо привычной для нас пищи, являются для нашего организма стрессом и это равновесие нарушают.
Кривель Е.В.- заведующий отделением общей врачебной практики.
плотность дробленого роговик соли гранита
Плотность водных растворов солей, кислот и оснований
В таблице представлены значения отношения плотности водных растворов кислот, солей, оксидов, оснований к плотности воды при 15°С (999,9 кг/м3) Например, плотность раствора соли NaCl равна 1008,5 кг/м3 при концентрации соли в
сг для дробленого гранита
Плотность дробленого камня Код ТН ВЭД ТС IFCG ПЕСОК ФРАКЦИИ 2 5 ММ ИЗ ОТСЕВОВ ДРОБЛЕНИЯ ЩЕБНЯ,ПО ЕВРОПЕЙСКОМУ СТАНДАРТУ en933 (ФРАКЦИЯ 25 ММ ГОСТ СТАНДАРТ РФ ), С СОДЕРЖАНИЕМ ДРОБЛЕНОГО КАМНЯ
Ответы Mailru: какова плотность гранита?
Плотность гранита 2600 кг/м3 Остальные ответы Дашка Лавренова Мастер (2299) 13 лет назад 2,6 м2/кг я заслужила 10 баллов! Дашка ЛавреноваМастер (2299) 13 лет назад в смысле 2,6 кг/см3 сорри, прост торопилась успеть раньше других И
плотность дробленого кварца
Плотность щебня различных фракций, его марки Плотность гранитного и строительного щебня разной фракции (зависит от количества примесей кварца, 1 2003 000 (из дробленого
Плотность поваренной соли в больших кусках 2160 кг/м^3, а
Верный ответ | вопрос: Плотность поваренной соли в больших кусках 2160 кг/м^3, а дробленный в поршок 800 кг /м^3как вы думаете, почему? на mozgotvet
сг для дробленого гранита
Плотность дробленого камня Код ТН ВЭД ТС IFCG ПЕСОК ФРАКЦИИ 2 5 ММ ИЗ ОТСЕВОВ ДРОБЛЕНИЯ ЩЕБНЯ,ПО ЕВРОПЕЙСКОМУ СТАНДАРТУ en933 (ФРАКЦИЯ 25 ММ ГОСТ СТАНДАРТ РФ ), С СОДЕРЖАНИЕМ ДРОБЛЕНОГО КАМНЯ
плотность гранита дробилки работают в кубический метр
23/07/2018· плотность дробилки пыли шлака объемная плотность дробленого гипса Шлака в нем должно содержаться 30/60%, гипса не больше 5% Плотность материала 28/3г/см³, объемная масса 900/1200кг/м³ Хотя этот цемент схватывается чуть
плотность дробленного бетона
Плотность Щебенка 1,05 1,6 1050 1600 1,05 1,6 Кусковые шлаки 2,1 2,8 2100 2800 2,1 2,8 Шлакобетон 2 2,4 2000 2400 2 2,4 Виды шлаковых расплавов и процесс их образования Read More плотность дробленого заполнителя кг м3 Плотность бетона кг/м3: Таблица
плотность дробленого совокупного базы
плотность дробленого совокупного базы; дробилка пластмасс стоимость; дробилка что удельный вес щебня дробилка китай Удельная плотность гранита: 2600 * 0,57 = 1482 кг/м 3 Из примера следует, что 1Онлайнзапрос насыпная пло
Плотность поваренной соли в больших кусках 2160 кг/м^3, а
ответ здесь | Плотность поваренной соли в больших кусках 2160 кг/м^3, а дробленный в поршок 800 кг /м^3как вы думаете, почему? / iznayka
Плотность поваренной соли в больших кусках 2160 кг/м^3, а
Верный ответ | вопрос: Плотность поваренной соли в больших кусках 2160 кг/м^3, а дробленный в поршок 800 кг /м^3как вы думаете, почему? на mozgotvet
объемная плотность измельченного гранита
Плотность гранита составляет 2600 2700 кг/м 3,,прочность на сжатие 300 Мпа, что в 2 раза превышает показатель мрамора плотность измельченного цемента плотность измельченного каменного балласта Сколько измельченного
плотность дробленого кварца
Плотность щебня различных фракций, его марки Плотность гранитного и строительного щебня разной фракции (зависит от количества примесей кварца, 1 2003 000 (из дробленого
плотность дробленного бетона
плотность дробленого заполнителя кг м3 Плотность бетона кг/м3: Таблица, классификация и 09/03/2018 Плотность такого бетона составляет примерно 2500кг/м3 и более Read More Плотность бетона кг м3: таблица, характеристики Плотнос�
Плотность поваренной соли в больших кусках 2160 кг/м^3, а
Верный ответ | вопрос: Плотность поваренной соли в больших кусках 2160 кг/м^3, а дробленный в поршок 800 кг /м^3как вы думаете, почему? на mozgotvet
Плотность поваренной соли в больших кусках 2160 кг/м^3, а
ответ здесь | Плотность поваренной соли в больших кусках 2160 кг/м^3, а дробленный в поршок 800 кг /м^3как вы думаете, почему? / iznayka
плотность гранита дробилки работают в кубический метр
23/07/2018· плотность дробилки пыли шлака объемная плотность дробленого гипса Шлака в нем должно содержаться 30/60%, гипса не больше 5% Плотность материала 28/3г/см³, объемная масса 900/1200кг/м³ Хотя этот цемент схватывается чуть
плотность дробленого совокупного базы
плотность дробленого совокупного базы; дробилка пластмасс стоимость; дробилка что удельный вес щебня дробилка китай Удельная плотность гранита: 2600 * 0,57 = 1482 кг/м 3 Из примера следует, что 1Онлайнзапрос насыпная пло
объемная плотность измельченного гранита
Плотность гранита составляет 2600 2700 кг/м 3,,прочность на сжатие 300 Мпа, что в 2 раза превышает показатель мрамора плотность измельченного цемента плотность измельченного каменного балласта Сколько измельченного
плотность дробленного бетона
Плотность Щебенка 1,05 1,6 1050 1600 1,05 1,6 Кусковые шлаки 2,1 2,8 2100 2800 2,1 2,8 Шлакобетон 2 2,4 2000 2400 2 2,4 Виды шлаковых расплавов и процесс их образования Read More плотность дробленого заполнителя кг м3 Плотность бетона кг/м3: Таблица
| Из коллегиального словаря Merriam Webster: Основная статья: 1 salt
Различные типы потребляемой соли:
Паспорт безопасности хлорида натрия | |||||||||
Концентрация
Концентрация
Концентрации молекулярных растворенных веществ
Рассмотрим простую молекулу этанола или CH 3 CH 2 OH, растворенную в воде.
Мы измеряем концентрацию молекулярного вещества в растворе по молярности. Молярность (M) — это количество молей молекулы на литр раствора.
Какова молярность раствора, полученного путем добавления 10 г этанола в 100 мл водного раствора?
(10 г CH 3 CH 2 OH) / (46 г / моль) = 0,22 моль
(0,22 моль) / (0,1 л) = 2,2 M
Этанол хорошо растворяется в воде. Он взаимодействует с водой через силы Лондона, диполь-дипольные взаимодействия и водородные связи.
Степень водородной связи между водой и этанолом на больше, чем на , чем между молекулами этанола в чистом этаноле. Это связано с тем, что кислород в этаноле может принимать 2 водородные связи, но есть только 1 атом водорода, который может образовывать водородные связи. Вода может принимать 2 водородные связи у каждого атома кислорода и может отдавать 2 водородные связи со своими атомами водорода. Водородная связь в чистом этаноле показана ниже.
И этанол, и вода являются жидкостями. Можно ожидать, что смесь этих двух веществ будет иметь объем, равный сумме объема этанола и объема воды.
Чистый этанол имеет более низкую плотность, чем вода, 0,789 г / мл при 25 градусах, в отличие от 1000 г / мл для чистой воды. Плотность раствора этанола в воде будет ниже плотности воды. Точная плотность зависит от соотношения этанола и воды.
Из-за взаимодействия между молекулами смесь этанола и воды имеет объем, немного меньший, чем сумма объемов двух компонентов.
Концентрации ионных растворенных веществ
Теперь рассмотрим соль, такую как NaCl, в воде.Соли диссоциируют в воде, поэтому для раствора, состоящего из 10 г NaCl в 100 мл раствора:
Число частиц вдвое превышает число молей на литр NaCl. Помните, что именно общее количество частиц влияет на коллигативные свойства, такие как понижение точки замерзания или повышение температуры кипения раствора.
Катионы натрия и анионы хлорида очень прочно взаимодействуют с водой. Атом кислорода молекул воды действует как основание Льюиса и координируется с кислым катионом натрия Льюиса в донорно-акцепторных связях.
Растворы хлорида натрия имеют плотность, очень близкую к плотности воды. 1,7 М раствор NaCl имеет плотность 1,069 г / мл по сравнению с 1000 г / мл для чистой воды при 25 град.
Изменение плотности при изменении концентрации
Кристаллический хлорид натрия, NaCl (s), имеет более высокую плотность, чем вода, и составляет 2,165 г / мл. Плотность любого раствора NaCl будет больше, чем у чистой воды, но, как мы видели выше, плотность близка к плотности чистой воды.
Плотность раствора хлорида натрия увеличивается с увеличением концентрации соли.
Институт соли
Назад
Компас
Показатель
Таблицы
Вступление
Следующий
Обнаружено, что поваренная соль повышает плотность хранения данных
Исследователи из Сингапура говорят, что они нашли способ использовать обычную поваренную соль для увеличения в 5,3 раза плотности, с которой биты данных могут храниться на пластине жесткого диска.
Исследователи заявили, что обнаруженный ими процесс будет поддерживать плотность от 1,9 до 3 терабит на дюйм.3 Тбит / дюйм, что в шесть раз больше, чем у жестких дисков Seagate емкостью 4 ТБ на сегодняшний день, то есть 625 Гбит / дюйм. Учитывая, что современные жесткие диски могут иметь емкость до 4 ТБ, теоретически новая технология позволит разместить на одном диске более 21 ТБ данных.
Секрет заключается в использовании литографии с электронным пучком чрезвычайно высокого разрешения, которая представляет собой процесс создания тонких схем в наномасштабе.
Добавляя хлорид натрия (соль) к раствору проявителя, используемому в процессах литографии, исследователи смогли создать наноструктуры с четко определенными характеристиками, размер которых составлял всего 4 штуки.5 нанометров, без необходимости в дорогостоящей модернизации оборудования.
Нанометр — это одна миллиардная часть метра. Сегодняшние твердотельные накопители на основе флэш-памяти NAND используют процессы литографии, которые создают схемы шириной около 25 нм; человеческий волос в 3000 раз толще 25 нм.
Пример того, как нанопаттерн более плотно упаковывает биты данных вместе.
Метод «соленого раствора проявителя» исследователей был изобретен Джоэлем Янгом, ученым из Института исследования материалов и инженерии (IMRE) Агентства по науке, технологиям и исследованиям Сингапура.Ян впервые разработал этот метод, когда был аспирантом Массачусетского технологического института. Янг и исследователи из Национального университета Сингапура и Института хранения данных усовершенствовали технику создания нанонарисовок.
Проще говоря, нанопаттернинг более плотно упаковывает миниатюрные структуры, которые хранят информацию в форме битов. «Мы показали, что биты можно объединить более плотно, уменьшив количество этапов обработки», — сказал Ян в своем заявлении. Ученые используют термин «зерно» для описания упаковок бит, нанесенных на поверхность диска.
В современных технологиях используются крошечные зерна размером около 7 или 8 мкм, которые осаждаются на поверхности носителя информации, — сказал Ян. Однако один бит данных хранится в кластере этих «зерен», а не в каком-либо отдельном «зерне». Биты исследователей имеют размер около 10 нм, но хранят информацию в единой структуре. В настоящее время исследователи работают над дальнейшим увеличением плотности хранения.
Лукас Мириан охватывает хранение, аварийное восстановление и непрерывность бизнеса, инфраструктуру финансовых услуг и ИТ для здравоохранения для Computerworld .Следуйте за Лукасом в Twitter на @lucasmearian или подпишитесь на RSS-канал Лукаса. Его адрес электронной почты: [email protected].
Copyright © 2011 IDG Communications, Inc.
Плотность водных растворов неорганических натриевых солей
Обратите внимание на единицы концентрации на рисунках:
мас.%: Масса растворенного вещества / общая масса раствора * 100%
моль / кг: Моляльность = моль растворенного вещества / кг воды
моль / литр: Молярность = моль растворенного вещества / литр раствора
Значения приведены в таблице под рисунками.
См. Также плотность водных растворов неорганических хлоридов, неорганических солей калия, некоторых других неорганических веществ, органических кислот и органических веществ, таких как сахара и спирты.
Плотность водных растворов при 20 ° C, выраженная в г / см 3 :
Для полного стола — поверните экран!
| Массовый% | Ацетат натрия | Натрия бромид | Карбонат натрия | Натрия хлорид 0| дигидрат натрия | дигидрат натрия | Гидрокарбонат натрия | Гидрофосфат натрия | Гидроксид натрия | Нитрат натрия | Фосфат натрия | Натрия фосфат | Сульфат натрия | Сульфат натрия Сульфат натрия 9 1.0034 | 1.006 | 1.0086 | 1.0053 | 1.0049 | 1.0056 | 1.0054 | 1.0082 | 1.0095 | 1.002 | 1.0095 | 1.005 | 1.01 | 0001.0 1.0502 1.034 | 1.0331 | 1.0358 | 1.0337 | 1.048 | 1.0538 | 1.0322 | 1.0579 | 1.0436 | 1.0399 | 10 | 1.0495 | 1.0803 | 1.1029 | 1.0707 | 1.0708 | 1.0747 | 310 | 00 1.0747 | 310 | 2 | 1.0747 | 2 | 2 9102 9102 | 1,1050 | 1,1745 | 1,1478 | 1,1492 | 1,1576 | 1,2192 | 1.1429 | 1.1907 | 1.174 | 30 | 1.1602 | 1.2842 | 1.2488 | 1.3277 | | 00 1.3277 | 9102 9102 9102 | 1.3277 | 9102 9102 9102 | 1,3493 | 1,4299 | 1,3175 | 1,3827 | Плотность при 20 ° C в г / см3 | | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
моль растворенного вещества / кг воды = моляльность):
Для полного стола — поверните экран!
| Массовый% | Ацетат натрия | Натрия бромид | Карбонат натрия | Натрия хлорид 0| дигидрат натрия | дигидрат натрия | Гидрокарбонат натрия | Гидрофосфат натрия | Гидроксид натрия | Нитрат натрия | Фосфат натрия | Натрия фосфат | Сульфат натрия | Сульфат натрия Сульфат натрия 9 0.123 | 0,098 | 0,095 | 0,173 | 0,039 | 0,084 | 0,12 | 0,071 | 0,253 | 0,119 | 0,062 | 0,071 | 0,062 | 0,071 | 0,62 0,497 | 0,901 | 0,204 | 0,439 | 0,627 | 0,371 | 1,316 | 0,619 | 0,321 | 0.371 | 0,333 | 10 | 1,354 | 1,08 | 1,048 | 1,901 | 0,431 | 0,926 | 2,778 | 2,778 | 9107 2,778 | 9107 2,43 | 4,278 | 0,969 | 2,084 | 6,25 | 2,941 | 1,76 | 1.581 | 30 | 5,224 | 4,165 | 3,572 | 10,715 | 5,042 | 2,711 | 9109 2,711 | 9102 9109 2,711 | 9109 2,711 | 9102 9000 2,711 | 9102 9000 2,711 16,668 | 7,844 | 4,216 | Моляльность при 20 ° C, выраженная как моль / кг воды | | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Конверсия концентрации из массовых% в моль / литр (моль растворенного вещества / литр раствора = молярность):
Для полноценного стола — поворот экрана!
| Массовый% | Ацетат натрия | Натрия бромид | Карбонат натрия | Натрия хлорид 0| дигидрат натрия | дигидрат натрия | Гидрокарбонат натрия | Гидрофосфат натрия | Гидроксид натрия | Нитрат натрия | Фосфат натрия | Натрия фосфат | Сульфат натрия | Сульфат натрия Сульфат натрия 9 0.122 | 0,098 | 0,095 | 0,172 | 0,039 | 0,084 | 0,12 | 0,071 | 0,252 | 0,118 | 0,062 | 0,071 | 0,062 | 0,071 | 0,071 | 0,071 | 0,495 | 0,885 | 0,2 | 0,432 | 0,615 | 0,369 | 1,317 | 0,607 | 0,323 | 0.367 | 0,329 | 10 | 1,279 | 1,05 | 1,041 | 1,832 | 0,415 | 0,896 | 2,772 | 103 | 2,772 | 104000 | 102000 | 2,772 | 101 | 2,283 | 3,928 | 0,891 | 1,93 | 6,096 | 2,6989 | 1,677 | 1.485 | 30 | 4,243 | 3,744 | 3,123 | 9,958 | 4,326 | 2,417 | 0 4,4 9102 2,417 | 0 9102 9102 9000 2,417 | 0 9102 9102 9000 2,417 | 0 9102 9102 9000 2,417 | 9102 9000 2,417 | 9102 9000 14,3 | 6,2 | 3,48 | Молярность при 20 ° C в виде раствора моль / л | | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Нужно ли мне использовать кошерную соль?
| Тип соли | Вес на стакан | Вес на столовую ложку |
| Соль столовая | 10 унций; 280 г | 2/3 унции; 18 г |
| Кошерная соль Мортона | 8 унций; 225 г | 1/2 унции; 14 г |
| Кошерная соль Diamond Crystal | 5 унций; 140 г | 1/3 унции; 9g |
| Морская соль Мальдон | 4 унции; 115 г | 1/4 унции; 7g |
| Fleur de sel | 8 унций; 225 г | 1/2 унции; 14 г |
Таким образом, если рецепт требует кошерности Diamond Crystal (как и большинство наших рецептов) и все, что у вас есть под рукой, — это поваренная соль, вам придется вдвое уменьшить количество по объему, чтобы получить аналогичные результаты.
Погрузочно-разгрузочные работы
Вся соль технически кошерная. «Кошерная соль» — это действительно неправильное название кошерной соли или , поскольку ее крупные зерна делают ее более эффективной для удаления жидкости из мяса во время кошерного процесса. Но поварам это нравится не поэтому.
Самая большая причина, по которой повара любят использовать кошерную соль, заключается в том, что ее намного легче брать между пальцами, что дает вам более жесткий контроль над приправой. Подумайте об этом: сколько раз вы ходили в ресторан, брали солонку, встряхивали им еду и понимали, что соль почти не выходит? А как насчет обратного? Сколько раз вы случайно пересыпали пищу, пытаясь использовать поваренную соль из шейкера?
Фотографии: Shutterstock
Даже попытка нанести поваренную соль вручную — непростая задача.Его маленькие гладкие зерна скользят друг мимо друга, скользят сквозь пальцы, как песок в песочных часах. Это отсутствие контроля раздражает на кухне.
Кошерная соль, напротив, имеет более крупные и грубые зерна, которые легко нащупать и легко посыпать, что значительно упрощает определение правильного уровня приправы. Вы можете взять большую щепотку кошерной соли и подержать ее между пальцами, не уронив случайно крупинки, пока или не будут готовы начать разбрызгивание.
Равномерное распределение приправ также проще с кошерной солью. Попробуйте этот быстрый эксперимент: возьмите лист черной ткани, миску кошерной соли и миску поваренной соли. Теперь возьмите немного поваренной соли между пальцами и посыпьте ею ткань, стараясь равномерно покрыть квадрат размером два на два дюйма. Повторите то же самое с кошерной солью. Какой из них распределен более равномерно?
Ага, я так и думал.
Когда можно использовать столовую соль?
Тем не менее, бывают случаи, когда использовать поваренную соль совершенно нормально.Пока ваша соль будет растворена и равномерно распределена в готовом блюде — например, в супе, тушеном или тушеном мясе — нет никаких причин использовать кошерную соль, кроме удобства, когда вам не нужно покупать два разных типа соли. Просто не забудьте проверить свои рецепты и не забудьте учесть плотность поваренной соли при ее добавлении.
Есть один случай, когда поваренная соль на самом деле уступает кошерной соли: когда вам нужно быстро растворить ее в жидкости. Когда вы делаете раствор с высоким содержанием соли (например, рассол), поваренная соль растворяется немного быстрее, чем кошерная соль, из-за меньшего размера ее кристаллов.Кстати, знаете ли вы, что максимальная растворимость соли в воде практически одинакова, независимо от того, насколько горячая или холодная ваша жидкость? Вауза!
Когда мне следует использовать морскую соль для маскарадных штанов?
Честно говоря, у вас не , а , чтобы когда-либо использовать этот материал. Опять же, у вас нет , у вас есть , чтобы, скажем, посмотреть Ghostbusters . Ни то, ни другое не является необходимым для выживания, но оба делают жизнь более достойной.
Солевароды.
Фотография: dullhunk на Flickr.
Необычные соли добывают в океанах, соленых реках и озерах по всему миру.В зависимости от того, как именно они образованы, и содержащихся в них микроэлементов, их форма может варьироваться от влажных комковатых кусков до пирамидальных кружевных хлопьев, цвет которых варьируется от ярко-розового до черного как смоль.
Хотя различия в цвете в основном косметические, форма может влиять на вкусовые качества соли. Поварам нравится использовать морскую соль, потому что они обеспечивают хрустящую текстуру и повышенную соленость, что добавляет интереса к блюдам, приготовленным на тарелках. Их следует использовать исключительно для отделки блюд.Посыпать глазированные буханки хлебом перед выпечкой. Посыпать нарезанный идеально приготовленный стейк непосредственно перед подачей на стол. Добавление хрустящей корочки к кусочкам сырых гребешков. Вы уловили картину. Фантастическая еда.
С другой стороны, если вы используете свою причудливую морскую соль для приготовления пищи, вы также можете заменить туалетную бумагу долларовыми купюрами, потому что вы смываете все ее полезные свойства в унитаз.
Стоимость
Что касается вопроса об относительной стоимости, я быстро поискал в Интернете и обнаружил, что цены на кошерную соль в среднем примерно на 20% выше, чем на поваренную соль, если вы покупаете их оптом.Вряд ли это банкротство, особенно если учесть в первую очередь, что независимо от того, покупаете ли вы обычную соль или кошерную соль, в любом конкретном блюде вы, вероятно, будете использовать лишь малую часть стоимости. Для меня удобство и привычка иметь только один вид поваренной соли стоит этих незначительных дополнительных затрат.
Йод
Многие столовые соли содержат следы йода. Эта практика была начата в 1920-х годах для того, чтобы помочь бороться с зобом — проблемой, которая свирепствовала на Американском Севере, от Великих озер до Тихоокеанского Северо-Запада.В наши дни зоб практически ликвидирован среди нашего населения благодаря йодированной соли, хотя он все еще появляется в тех частях мира, где дефицит йода является обычным явлением.
Вам нужно использовать йодированную соль? Скорее всего, нет. Рыба и водоросли — лучшие источники йода, но большинство овощей также содержат йод, как и молочные продукты. Если вы едите много овощей и / или рыбы, вы будете получать необходимый вам йод, даже если используете только кошерную соль.
Что касается вкуса, то он в основном не обнаруживается в поваренной соли, хотя некоторые люди, особенно чувствительные к нему, могут заметить его в блюдах с более мягким вкусом.
Получите соляной погреб!
Наличие солонки на видном месте рядом с вашей подготовительной станцией или плитой — постоянное напоминание о вкусе и приправе пищи во время приготовления. Я гарантирую, что если у вас ее еще нет, поставив солонку на прилавок, вы сможете лучше готовить. Подойдет любой закрытый контейнер с широко открывающейся крышкой, но RSVP Salt Server делает это стильно.
Что я рекомендую?
Дома у меня есть солонка, наполненная кошерной солью Diamond Crystal.Я держу его у плиты во время готовки и перекладываю на обеденный стол во время ужина. Еще у меня есть небольшой запас крупной морской соли разной текстуры и размера, которую я использую для отделки блюд. Чаще всего я использую морскую соль Maldon из Англии (мне нравятся ее кружевные пирамиды) и fleur de sel от Guérande (красивые большие хрустящие кристаллы, которые останутся не растворенными на нарезанном мясе, пока вы не откусите их). Я не храню дома поваренную соль.
Формула хлорида натрия — применение, свойства, структура и формула хлорида натрия
Формула и структура: Химическая формула хлорида натрия — NaCl, а его молярная масса — 58.44 г / моль. Это ионное соединение, состоящее из катиона натрия (Na + ) и хлорид-аниона (Cl — ). Твердый NaCl имеет кристаллическую структуру, в которой каждый ион Na + окружен шестью ионами хлора в октаэдрической геометрии.
Прохождение: Хлорид натрия присутствует в водах моря и океана, что придает им соленость. Около 1-5% морской воды состоит из хлорида натрия. Он также встречается в виде минерала галита или каменной соли.
Приготовление: Соль получают в больших количествах путем испарения морской воды или соленой воды (рассола) из соленых озер и солевых колодцев.Поскольку морская вода содержит несколько других солей (кальция, магния и других элементов), процесс испарения проводится осторожно, чтобы различные соли выпадали в осадок в разное время в зависимости от их растворимости. Другой важный метод производства — добыча запасов каменной соли.
Физические свойства: Хлорид натрия представляет собой белое кристаллическое твердое вещество с плотностью 2,16 г / мл и температурой плавления 801 ° C. Он также доступен в виде водных растворов различной концентрации, называемых солевыми растворами.
Химические свойства: Хлорид натрия легко растворяется в воде и других полярных растворителях. Это стабильное твердое тело. Он разлагается только при высоких температурах с образованием токсичных паров соляной кислоты (HCl) и оксида динатрия (Na 2 O).
Применение: Хлорид натрия, наиболее известный как поваренная соль, широко используется в пищевой промышленности для ароматизации и консервирования. Он также используется в производстве многих важных химических веществ, включая гидроксид натрия, карбонат натрия, пищевую соду, соляную кислоту и т. Д.Он также применяется на нефтеперерабатывающих заводах, в текстильной, целлюлозно-бумажной, антипиреновой, резиновой и дорожной промышленности. Еще одно важное применение — это защита от обледенения дорог и тротуаров в холодных и заснеженных регионах. Солевые растворы также используются во многих медицинских целях.
Воздействие на здоровье / опасность для здоровья: В низких концентрациях хлорид натрия нетоксичен и неопасен, а также является важным источником электролита для организма. Высокое потребление соли в течение длительного времени может вызвать дисбаланс электролитов в организме.Проглатывание в высоких концентрациях может вызвать рвоту, тошноту, диарею и обезвоживание. Он также может раздражать глаза и вызывать повреждение глаз при высоких концентрациях.
5.1: Сахар и соль — Chemistry LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \ (\ ce {NaCl} \), представляющей соотношение 1: 1 ионов натрия и хлорида. . Он обычно используется в качестве приправы и пищевого консерванта. Соль можно создать, сложив вместе два очень реактивных элемента: металл натрия (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ label {eq1} \]
Элемент натрий (рисунок \ (\ PageIndex {1a} \)) — очень реактивный металл; при возможности он вступит в реакцию с потом на ваших руках и образует гидроксид натрия, который является очень едким веществом. Элемент хлор (рис. \ (\ PageIndex {1b} \)) — это бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитости. Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.{-}} \) ионы необходимы для нормальной работы нервов и дыхания. Оба эти иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний из известных ароматизаторов и один из немногих камней, которые мы едим. Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ ref {eq1}), образующийся солевой продукт имеет радикально разные свойства (как физические, так и химические). Наблюдать за этой реакцией очень интересно (Видео \ (\ PageIndex {1} \)).
Видео \ (\ PageIndex {1} \): Приготовление столовой соли с использованием металлического натрия и газообразного хлора
Еще одно соединение — сахар, общее название сладких растворимых углеводов, многие из которых используются в пище.Сахар имеет химическую формулу \ (\ ce {C12h32O11} \) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
\ [\ ce {C12h32O11 (s) + тепло → 12C (s) + 11h3O (g)} \ label {eq2} \]
Видео \ (\ PageIndex {2} \): Научный эксперимент на кухне показывает, что происходит с молекулами сахара, когда они нагреваются. Эксперимент не разочаровал!
Как и соль, сахар имеет радикально отличные свойства (как физические, так и химические) от составляющих его элементов.Это различие в свойствах составляющих элементов и соединений является главной особенностью химических реакций.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
.

 dpva.info).
dpva.info). Сколько крупы, соли, сахара в стакане, ложке и т.д. Вооружаемся для прочтения дебильных рецептов на упаковках.
Сколько крупы, соли, сахара в стакане, ложке и т.д. Вооружаемся для прочтения дебильных рецептов на упаковках.