Насыщенный раствор соли в воде: «Как приготовить насыщенный раствор соли?» – Яндекс.Кью
Как сделать насыщенный раствор поваренной соли.
 Насыщенный раствор соли как приготовить
Насыщенный раствор соли как приготовить
Под термином «кристалл» следует понимать вещество, в котором мельчайшие частицы, атомы, располагаются в определенном порядке. Они образуют кристаллическую решетку — трехмерно-периодическую упорядоченную пространственную укладку.
Вследствие этого внешне кристаллы имеют вид правильных симметричных многогранников. Они могут сильно различаться по форме и иметь от четырех и до нескольких сотен граней, которые пересекаются под определенными углами друг с другом.
Соль — представитель семейства кристаллов
Одним из таких твердых тел с упорядоченным симметрическим строением является обычная соль.
Она представляет собой пищевой продукт, встречающийся в природе в виде минерала под названием галит. Большое ее количество находится в и других соленых источниках. Если вы рассмотрите при помощи микроскопа или лупы крупинки соли, то заметите, что они имеют плоские грани. А значит, находятся в кристаллическом состоянии. В этой статье мы расскажем о том, как сделать кристалл из соли самостоятельно. На самом деле это несложно. Чтобы понять, как происходит образование кристаллов соли, то есть процесс кристаллизации, предлагаем вам осуществить интересный опыт в домашних условиях. Ребенку желательно выполнять его под руководством взрослого. Помните, что форма кристалла соли может быть различной, в том числе кубической, призматической или любой другой — более сложной. Тем не менее грани соли всегда пересекаются под прямым углом.
В этой статье мы расскажем о том, как сделать кристалл из соли самостоятельно. На самом деле это несложно. Чтобы понять, как происходит образование кристаллов соли, то есть процесс кристаллизации, предлагаем вам осуществить интересный опыт в домашних условиях. Ребенку желательно выполнять его под руководством взрослого. Помните, что форма кристалла соли может быть различной, в том числе кубической, призматической или любой другой — более сложной. Тем не менее грани соли всегда пересекаются под прямым углом.
Расскажем о том, как сделать кристалл из соли: необходимые расходные материалы и инструменты
Ну что же, давайте приступим к работе. Какие материалы и инструменты нам понадобятся для проведения этого интересного опыта? Конечно, вода, прозрачные стеклянные стаканы, веревочка или толстая нить, деревянная лопатка. Также следует подготовить стержень шариковой ручки или обычный карандаш.
А самое главное — нужно запастись терпением. Дело в том, что процесс кристаллизации требует времени — около трех недель. Как сделать кристалл из соли? Возьмите хорошую соль, без примесей. Желательно приобрести продукт чистотой не ниже 98%, в противном случае опыт может не удаться. Если в составе соли будет большое количество разнообразных примесей, то экземпляр получится некрасивый и будет иметь изъяны. из соли начнем с приготовления сильно концентрированного раствора. Нальем в стакан или банку теплую воду (200 мл) и начнем добавлять соль. Не забываем постоянно помешивать жидкость деревянной лопаткой. Это необходимо для того, чтобы соль хорошо растворялась. После того как раствор будет готов (определить это можно по тому, что вносимая соль перестала растворяться в стакане с водой при обычном помешивании), следует подогреть смесь. Наполним кастрюльку водой, поставим на огонь, подогреем воду. После чего аккуратно поместим в нее стакан с концентрированным солевым раствором и подождем, пока он нагреется.
Как сделать кристалл из соли? Возьмите хорошую соль, без примесей. Желательно приобрести продукт чистотой не ниже 98%, в противном случае опыт может не удаться. Если в составе соли будет большое количество разнообразных примесей, то экземпляр получится некрасивый и будет иметь изъяны. из соли начнем с приготовления сильно концентрированного раствора. Нальем в стакан или банку теплую воду (200 мл) и начнем добавлять соль. Не забываем постоянно помешивать жидкость деревянной лопаткой. Это необходимо для того, чтобы соль хорошо растворялась. После того как раствор будет готов (определить это можно по тому, что вносимая соль перестала растворяться в стакане с водой при обычном помешивании), следует подогреть смесь. Наполним кастрюльку водой, поставим на огонь, подогреем воду. После чего аккуратно поместим в нее стакан с концентрированным солевым раствором и подождем, пока он нагреется.
Продолжаем работу по выращиванию красивых солевых кристаллов
Затем вынимаем наш стеклянный стакан из кастрюли и оставляем его в покое.
На стержне шариковой ручки (карандаше) закрепляем нить, к которой привязываем маленький кристаллик соли. Кладем стержень на стакан и погружаем в раствор веревочку с «затравкой». Именно на этом кристаллике соли будет расти наш красивый экспонат. Вот и все, теперь остается только ждать. Стакан ставим в теплое место и следим каждый день за процессом кристаллизации. Ни в коем случае нельзя трясти, переворачивать или поднимать емкость с раствором. Постепенно кристалл вырастет и станет достаточно большим. Когда это произойдет, можно аккуратно вынимать его из раствора. Советуем обсушить его салфеткой, но будьте крайне осторожны — ваш экземпляр очень хрупок. Обрежьте лишнюю нить и покройте кристалл бесцветным лаком, чтобы продлить срок его «жизни». Теперь вы знаете, как получить кристаллы соли в домашних условиях. Надеемся, у вас получится повторить наш несложный опыт.
Кристаллы из опыт по созданию красивого экспоната
Если вы хотите вырастить крупные, ровные и красивые образцы — обратите внимание на следующий опыт. Для работы вам потребуются такие материалы и инструменты:
Для работы вам потребуются такие материалы и инструменты:
- прозрачный стакан;
- вода;
- морская соль;
- бумага;
- салфетка;
- деревянная лопатка;
- плоский камешек среднего размера.
Технология процесса выращивания кристалла такова. Сначала налейте в стакан не слишком горячую воду и начинайте насыпать в нее морскую соль, постепенно, по одной чайной ложке. При этом не забывайте мешать лопаткой. Соль необходимо добавлять в жидкость до тех пор, пока она не прекратит растворяться. Теперь берем салфетку и процеживаем через нее полученный раствор. Это делается для того, чтобы соринки не мешали образованию ровного и красивого образца.
Процесс создания крупных солевых кристаллов
Как сделать кристалл из соли: после фильтрации кладем в раствор небольшой камешек (можно заменить гайкой) и ставим охлаждаться. Помните, что чем медленнее будет остывать наша соленая жидкость, тем больше по размеру получатся кристаллы. Желательно прикрыть стакан бумагой и поставить его в темное место, защищенное от сквозняков. Спустя двое-трое суток вы увидите, как ваш камешек обрастет маленькими кристалликами. Внимательно следите за тем, чтобы раствор все время полностью покрывал «затравку». Также следует еженедельно очищать жидкость от пыли и лишних кристаллов, формирующихся на дне стакана. По мере испарения нужно доливать в емкость сильно концентрированный Следите за тем, чтобы он был чистым и нехолодным (комнатной температуры). Кроме того, необходимо периодически удалять корку, появляющуюся на дне емкости. Спустя две-три недели ваш кристалл достигнет примерно 2-3 см в длину. А для того чтобы получить более крупный экземпляр, потребуется больше времени — порядка 6 недель.
Спустя двое-трое суток вы увидите, как ваш камешек обрастет маленькими кристалликами. Внимательно следите за тем, чтобы раствор все время полностью покрывал «затравку». Также следует еженедельно очищать жидкость от пыли и лишних кристаллов, формирующихся на дне стакана. По мере испарения нужно доливать в емкость сильно концентрированный Следите за тем, чтобы он был чистым и нехолодным (комнатной температуры). Кроме того, необходимо периодически удалять корку, появляющуюся на дне емкости. Спустя две-три недели ваш кристалл достигнет примерно 2-3 см в длину. А для того чтобы получить более крупный экземпляр, потребуется больше времени — порядка 6 недель.
Корректируем кристаллы соли
Помните, что у вас могут и не получиться сразу красивые и ровные кристаллы. В любом деле нужна практика. Советуем вам аккуратно корректировать кристаллизацию образцов, убирая не очень красивые наросты. Сделать это можно при помощи острого ножа, соскабливая им лишнее. Также, используя вазелин, можно прекратить формирование граней. При необходимости слой вазелина можно удалить с образца ацетоном. Когда ваш кристалл дорастет до нужной величины, можно аккуратно вынимать его из раствора. После этого следует мягко протереть грани салфеткой. Покрыть образец можно лаком для волос: так ваш кристалл станет менее хрупким, ломким и надолго сохранит свой красивый внешний вид.
При необходимости слой вазелина можно удалить с образца ацетоном. Когда ваш кристалл дорастет до нужной величины, можно аккуратно вынимать его из раствора. После этого следует мягко протереть грани салфеткой. Покрыть образец можно лаком для волос: так ваш кристалл станет менее хрупким, ломким и надолго сохранит свой красивый внешний вид.
Оригинальная поделка из кристаллов поваренной соли
В домашних условиях вы можете не только вырастить обычный солевой кристалл, но и сделать интересную поделку. Для этого вам потребуются такие инструменты и материалы:
- вода;
- поваренная соль;
- проволока;
- нитки;
- фильтровальная бумага;
- банка — 2 шт.;
- кастрюля;
- деревянная лопатка.
Работу начнем с растворения соли в воде. Вносим ее в жидкость небольшими порциями, добавляя следующую только после окончательного растворения предыдущей. Когда соль перестанет растворяться, переходим к следующему этапу. Берем кастрюлю, наполняем водой и ставим емкость на плиту на небольшой огонь. В нее помещаем банку с солевым раствором. Следим за процессом нагрева. Продолжаем растворять соль, доведя температуру до 65 градусов. Все, выключаем газ, но пока не вынимаем банку из кастрюли. Дело в том, что разница температур может привести к тому, что стеклянная тара лопнет. После остывания раствора можно смело доставать банку из кастрюли.
В нее помещаем банку с солевым раствором. Следим за процессом нагрева. Продолжаем растворять соль, доведя температуру до 65 градусов. Все, выключаем газ, но пока не вынимаем банку из кастрюли. Дело в том, что разница температур может привести к тому, что стеклянная тара лопнет. После остывания раствора можно смело доставать банку из кастрюли.
Фильтрация раствора и кристаллизация
После этого приступаем к очищению раствора от примесей. Берем чистую банку и закрепляем на ее горлышке фильтровальную бумагу. Теперь аккуратно переливаем раствор в новую емкость. Все нерастворенные кристаллики соли и примеси остаются на фильтровальной бумаге. У нас получается чистый раствор. Теперь ставим банку с жидкостью в прохладное место и делаем «затравку». Берем медную проволоку и выполняем из нее любую фигуру животного, цветок, веточку, звездочку. Обматываем проволоку нитью. Помещаем заготовку в банку с солевым раствором, накрываем емкость салфеткой, оставляя лишь небольшой зазор. Вот и все, остается только ждать, пока произойдет выращивание кристаллов из соли. После того как проволока обрастет, можно доставать ее из раствора. Делать это нужно очень осторожно, так как кристаллы соли могут ломаться.
Вот и все, остается только ждать, пока произойдет выращивание кристаллов из соли. После того как проволока обрастет, можно доставать ее из раствора. Делать это нужно очень осторожно, так как кристаллы соли могут ломаться.
Поваренная соль в чистом виде, или хлористый натрий содержит натрия 39,34, хлора 60,66%,
В природе поваренная соль встречается в воде морей, океанов, некоторых озер и подземных источников, а также в виде пластов кристаллических отложений. В зависимости от характера месторождений и способов добычи различают каменную соль, самосадочную, садочную, или бассейновую, и выварочную.
Каменную соль добывают из пластов, расположенных на той или иной глубине под землей. Ближайшие крупные месторождения каменной соли находится в районе г. Соль-Илецка Чкаловской области и г. Артемовска Лугансхой области Украины. После распада СССР Россия продолжила закупать соль на Украине. Самосадочную соль добывают из пластов соли, осевшей на дне озер. Кристаллизация соли происходит летом в результате естественного испарения воды озер. Различают текущую кристаллизацию и старую (коренную).
Различают текущую кристаллизацию и старую (коренную).
Значительное количество сам осадочной соли добывают в озере Баскунчак, в озере Куули, в озерах Павлодарской области.
Садочную, или бассейновую соль добывают из осадка ее, получаемого в специальных бассейнах, в результате естественного испарения воды лиманов или некоторых озер, отделяемых от моря неширокими полосами берега. Садочную соль по преимуществу добывают из воды лиманов или соленых озер Крымской области. Выварочную соль получают испарением воды из естественных или искусственных рассолов в специальных выпарных установках или вакуум-выпарных аппаратах. Добыча выварочной соли сосредоточена в Славянске, Усолье Иркутской области и некоторых других месторождениях.
Свойства поваренной соли.
Чистый хлористый натрий получается после кристаллизации в виде бесцветных, правильной кубической формы, кристаллов с удельным весом 2,167 и температурой плавления 800°.
Удельный вес природной соли колеблется от 1,95 до 2,2 в зависимости от величины кристаллов и вида соли.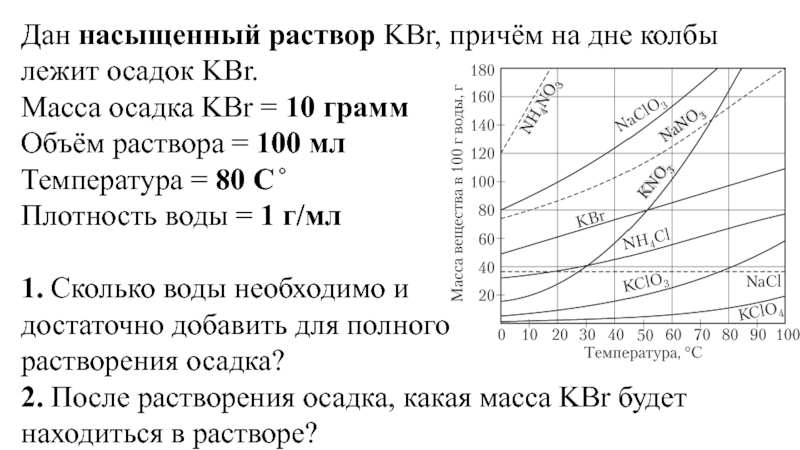 При кристаллизации (выпадении в осадок) внутри кристаллов задерживается часть рассола тем больше, чем больше размеры выпадающих кристаллов. Удельный вес рассола меньше удельного веса чистых кристаллов, поэтому кристаллы природной соли и имеют несколько пониженную величину последнего. В кристаллах каменной соли включений рассола меньше, чем в самосадочной и бассейновой соли текущей садки, поэтому удельный вес каменной соли больше удельного веса самосадочной и бассейновой соли. Для практических расчетов удельный вес можно принять равным 2,2.
При кристаллизации (выпадении в осадок) внутри кристаллов задерживается часть рассола тем больше, чем больше размеры выпадающих кристаллов. Удельный вес рассола меньше удельного веса чистых кристаллов, поэтому кристаллы природной соли и имеют несколько пониженную величину последнего. В кристаллах каменной соли включений рассола меньше, чем в самосадочной и бассейновой соли текущей садки, поэтому удельный вес каменной соли больше удельного веса самосадочной и бассейновой соли. Для практических расчетов удельный вес можно принять равным 2,2.
Кристаллы хлористого натрия при относительной влажности воздуха выше 75,5% поглощают (впитывают) влагу, а при относительной влажности ниже 75,5% — теряют ее. Этим свойством объясняется изменение влажности соли при хранении на воздухе без герметической упаковки. Природные соли, особенно самосадочные и бассейновые, содержащие примеси солей кальция и магния, обладают повышенной гигроскопичностью по сравнению с чистым хлористым натрием. При хранении в сыром помещении или в бунтах на воздухе содержание влаги в соли может достигнуть не сопровождаясь заметным растворением,
дальнейшее же поглощение влаги приводит к частичному растворению соли. Гигроскопичностью обусловлено в значительной степени слеживание соли при хранении, т, е. сцепление между собой отдельных кристаллов, вследствие чего соль уплотняется в твердую однородную массу.
Гигроскопичностью обусловлено в значительной степени слеживание соли при хранении, т, е. сцепление между собой отдельных кристаллов, вследствие чего соль уплотняется в твердую однородную массу.
Влажная соль вследствие более прочного взаимного сцепления кристаллов, вызываемого наличием на кристаллах пленки насыщенного раствора, плохо рассеивается; равномерно распределить ее разбрасыванием с лопатки по поверхности слоя рыбы, находящейся в чанах, значительно труднее, чем сухую соль.
Ho влажная соль (содержащая влаги больше 4-5%), по сравнению с сухой, при перемешивании образует плотные, нерассыпающиеся комочки, которые более прочно и в большем количестве прилипают к рыбе. Следовательно, при посоле рыбы с предварительным перемешиванием ее с солью лучше применять влажную соль, в то время как при посоле с разбрасыванием соли по слоям рыбы — сухую.
При смешивании соли со снегом или мелкодробленым льдом наблюдается таяние последнего, так как при температуре выше -21,2° соль и снег (лед) одновременно присутствовать не могут. При таянии льда (снега) га окружающей среды поглощается большое количество тепла, и на этом свойстве основано приготовление охлаждающих смесей. Наиболее низкая температура, равная -21,2°, получается при смещений 100 весовых частей льда (снега) с 33 частями соли (состав смеси: 24,4% соли и 75,6%, снега или льда).
При таянии льда (снега) га окружающей среды поглощается большое количество тепла, и на этом свойстве основано приготовление охлаждающих смесей. Наиболее низкая температура, равная -21,2°, получается при смещений 100 весовых частей льда (снега) с 33 частями соли (состав смеси: 24,4% соли и 75,6%, снега или льда).
Примеси в соли.
Природная поваренная соль, помимо хлористого натрия как основного соединения, содержит примеси других солеобразных соединений, чаще всего солей щелочноземельных металлов (кальция, магния), нерастворимых примесей и воды. Содержание воды зависит от условий хранения, в то время как содержание примесей солеобразных соединений зависит от вида соли и способов ее добычи. В табл. 1 приведен состав наиболее распространенных в РФ видов поваренной соли.
Примеси солей магния и кальция при посоле рыбы являются нежелательными. При наличии значительного количества этих примесей поверхность рыбы сильно обезвоживается, при сухом посоле задерживается образование тузлука и проникновение соли в рыбу, а соленая рыба приобретает горький привкус. Установлено, что при содержании солей магния и кальция в поваренной соли свыше 2%, последняя становится непригодной для посола рыбы. Из других растворимых примесей в соли могут присутствовать хлористый калий, сернокислый натрий, но обычно в таких незначительных количествах, что оказать какое-либо влияние па скорость посола и качество рыбы не могут.
Установлено, что при содержании солей магния и кальция в поваренной соли свыше 2%, последняя становится непригодной для посола рыбы. Из других растворимых примесей в соли могут присутствовать хлористый калий, сернокислый натрий, но обычно в таких незначительных количествах, что оказать какое-либо влияние па скорость посола и качество рыбы не могут.
Нерастворимые вещества примешиваются к соли как при добыче ее, таки при хранении и перевозках без упаковки. При неправильно организованной добыче, перевозках и хранении количество нерастворимых примесей может быть настолько велико, что при посоле они обволакивают поверхность рыбы и с трудом удаляются даже при тщательной промывке.
В состав нерастворимых примесей входят как органические, так и неорганические соединения. Среди неорганических могут быть песок, глина, уголь, попадающие главным образом при хранении и перевозках, а также окислы железа, алюминия, углекислые соли щелочно-земельных металлов. Окислы железа, алюминия всегда присутствуют в каменной соли, в то время как углекислые соли кальция находятся в соли, получаемой из морской воды.
Самосадочные и садочные соли, помимо загрязнений примесями органического и минерального происхождения, содержат микроорганизмы, попадающие в нее из рапы озер и бассейнов, а также извне при хранении на промыслах, транспортировке и на местах потребления. Наибольшее количество микроорганизмов, попадающих в соль из рапы, находится в свежей соли; при хранении (выдержке) количество их уменьшается. Среди этих микроорганизмов наибольшее значение имеют микроорганизмы из группы микрококков, обладающие способностью к пигментации. При повышении температуры воздуха при хранении на мясе рыбы, насоленной такой солью, появляется красная окраска, сопровождающаяся появлением слизи и запаха продуктов распада белков. Попадая вместе с солью на предприятия рыбной промышленности, пигментообразующие бактерии заражают склады, площадки для хранения соли и находящуюся на складе соль выварочную, каменную.
Требования к качеству соли.
Государственным стандартом на поваренную соль допущено следующее наименьшее содержание хлористого натрия и наибольшее — примесей (табл. 2).
2).
Содержание сернокислого натрия в пересчете на сухое вещество допускается:
а) для соли экстра — не более 0,2%;
б) для других сортов — не более 0,5%;
Исследованиями, по изучению влияний примесей, содержащихся в соли, на качество готовой соленой продукции, проводившимися в разное время, а также практикой посола установлено, что для разных способов и видов посола предельное содержание примесей в соли должно быть следующее (табл. 3).
Для посола вполне пригодными являются сорта соли от экстра (специальные посолы икры) до I сорта включительно.
Помол соли.
Поваренная соль в зависимости от помола (величины кристаллов) делится на несколько номеров: 0,1,2,3. Соль экстра имеет помол № 0; высшего и I сортов — от №0 до 3: соль II сорта — от № I до 3. Характеристика помолов приведенa в табл. 4.
Помол соли или, другими словами, величина кристаллов соли имеет весьма важное значение для посола рыбы: от их величины зависит скорость растворения соли, насыпной вес ее рассеиваемость, гигроскопичность.
Отношение поверхности кристаллов к их объему, так называемая удельная поверхность у крупных кристаллов меньше, чем у мелких. При растворении с каждой единицы поверхности переходит в раствор одно и то же количество соли. Ho если это количество отнести к единице объема или веса кристаллов, то за один и тот же срок соли в мелких кристаллах растворится значительно больше, чем в крупных, так как суммарная поверхность первых значительно больше вторых. Если требуется, чтобы растворение соли протекало быстро, необходимо применять более мелкую соль.
Кроме того, для равномерного посола необходимо наиболее плотное распределение кристаллов соли для того, чтобы занимаемая ими поверхность была близка к поверхности рыбы. Достигнуть этого можно только, если при определении величины кристаллов соли будет приниматься во внимание поверхность рыбы или, точнее, удельная поверхность ее (отношение поверхности к весу рыбы). Например, сельдь тихоокеанская весом 200 г имеет поверхность 280 см2, а весом 22 г — 74 см2. Для насыщенного посола первой требуется соли 60 г, а второй — 6 г; на 1 см2 поверхности должно распределиться соответственно 0,21 и 0,08 г. При одинаковом размере кристаллов отношение поверхности соприкосновения их к общей поверхности крупной сельди будет в 2,5 раза больше, чем у мелкой сельди, поскольку количество соли, приходящейся на 1 см3 поверхности рыбы, в первом случае в 2,5 раза больше, чем во втором. Следовательно, чтобы отношение поверхности соприкосновения к общей поверхности рыбы было одинаково, для посола мелкой сельди следует применять более мелкую соль, имеющую при одном и том же весе большую поверхность, чем крупная.
Для насыщенного посола первой требуется соли 60 г, а второй — 6 г; на 1 см2 поверхности должно распределиться соответственно 0,21 и 0,08 г. При одинаковом размере кристаллов отношение поверхности соприкосновения их к общей поверхности крупной сельди будет в 2,5 раза больше, чем у мелкой сельди, поскольку количество соли, приходящейся на 1 см3 поверхности рыбы, в первом случае в 2,5 раза больше, чем во втором. Следовательно, чтобы отношение поверхности соприкосновения к общей поверхности рыбы было одинаково, для посола мелкой сельди следует применять более мелкую соль, имеющую при одном и том же весе большую поверхность, чем крупная.
В связи с этим можно сделать и второй вывод: чем ниже дозировка соли при посоле, тем меньшую величину кристаллов соли и меньший номер помола следует применять для того, чтобы иметь наибольшую поверхность соприкосновения соли с рыбой
Применение очень мелкой соли (помол № 0 и 1) в больших количествах при посоле может приводить к нежелательным результатам. Мелкая соль, обладая повышенной гигроскопичностью, по сравнению с более крупными кристаллами, при недостатке воды на рыбе для образования первых порций рассола, сильно обезвоживает покровные ткани и тем самым замедляет проникновение соли в мясо. Это явление аналогично обезвоживанию поверхности рыбы вследствие присутствия в соли большого количества солей магния и кальция. Чтобы избежать при насыщенном посоле сухой солью интенсивного обезвоживания поверхности рыбы, предпочитают применять поваренную соль, состоящую из смесей кристаллов различной величины — до 3-4 мм включительно (помол № 2). В подобной смеси имеются в достаточном количестве кристаллы величиной 1 мм и меньше, которые увеличивают поверхность соприкосновения соли с рыбой, и, быстро растворяясь, образуют первые порции рассола без сильного обезвоживания тканей. Последующие порции рассола образуются за счет растворения кристаллов, имеющих большую поверхность; наблюдения показывают, что при наличии в соли смеси кристаллов различных размеров растворение в рыбосольной посуде протекает, при наличии начавшегося процесса посола, нормально.
Мелкая соль, обладая повышенной гигроскопичностью, по сравнению с более крупными кристаллами, при недостатке воды на рыбе для образования первых порций рассола, сильно обезвоживает покровные ткани и тем самым замедляет проникновение соли в мясо. Это явление аналогично обезвоживанию поверхности рыбы вследствие присутствия в соли большого количества солей магния и кальция. Чтобы избежать при насыщенном посоле сухой солью интенсивного обезвоживания поверхности рыбы, предпочитают применять поваренную соль, состоящую из смесей кристаллов различной величины — до 3-4 мм включительно (помол № 2). В подобной смеси имеются в достаточном количестве кристаллы величиной 1 мм и меньше, которые увеличивают поверхность соприкосновения соли с рыбой, и, быстро растворяясь, образуют первые порции рассола без сильного обезвоживания тканей. Последующие порции рассола образуются за счет растворения кристаллов, имеющих большую поверхность; наблюдения показывают, что при наличии в соли смеси кристаллов различных размеров растворение в рыбосольной посуде протекает, при наличии начавшегося процесса посола, нормально.
Объемный вес соли.
Для учета количества соли в солехранилищах и текущего расхода ее полезно знать насыпной вес соли. Насыпным весом сыпучих продуктов называется вес единицы объема (1 м3) в тоннах или килограммах. Насыпной вес зависит от удельного веса продукта, величины его частиц и соотношения различных размеров их, влажности и степени давления на него вышележащих слоев. Для различного вида солей, находящих применение в рыбной промышленности, насыпной вес колеблется от 1038 до 1365 кг (табл. 5). Насыпной пес соли одного и того же вида и района добычи больше у мелкой, чем у крупной.
Свойства растворов поваренной соли.
Хлористый натрий растворим в воде, причем растворимость, т. е. предельное количество его, необходимое для получения насыщенного раствора, незначительно изменяется с повышением температуры (табл. 6).
Д.И. Менделеев для промежутка температур от 0 до 108° вывел следующую формулу для определения предельного растворения соли в 100 г воды
где t — температура в градусах Цельсия
Растворимость может быть выражена в граммах хлористого натрия в 100 г раствора или в граммах на 100 г воды. Между этими величинами существует довольно простая зависимость. Обозначим содержание соли (в г) в 100 г раствора через с, а количество соли (в г), растворяющееся в 100 г воды для получения раствора с указанным содержанием соли, через a. Очевидно, что с граммов соли растворилось в (100-с) г воды, в 100 г воды растворится:
Между этими величинами существует довольно простая зависимость. Обозначим содержание соли (в г) в 100 г раствора через с, а количество соли (в г), растворяющееся в 100 г воды для получения раствора с указанным содержанием соли, через a. Очевидно, что с граммов соли растворилось в (100-с) г воды, в 100 г воды растворится:
Зная a, можно вычислить с по формуле:
Растворимость хлористого натрия в 100 г воды, вычисленная по формуле (2), приведена в табл. 6.
Почти одинаковая растворимость хлористого натрия в пределах температуры от 0 до 20° имеет важное значение для практики посола, так как не требуется изменять дозировку соли с изменением температуры в этих пределах.
Растворы хлористого натрия тяжелее воды и удельный вес их больше единицы. Для температуры 15° удельный вес раствора, отнесенный к удельному весу воды при 4°, может быть вычислен по следующей формуле Д. И. Менделеева:
где с — концентрация соли в растворе в процентах к его весу Для определения удельного веса применяются ареометры или денсиметры, на шкале которых нанесены числа, показывающие значение удельного веса при 20° по отношению к удельному весу воды при 4°, принятому равным единице. При пользовании обычными ареометрами (денсиметрами) удельный вес определяется с точностью до 0,0! и только лишь при наличии специальных ареометров удается повысить точность определения до 0,001.
При пользовании обычными ареометрами (денсиметрами) удельный вес определяется с точностью до 0,0! и только лишь при наличии специальных ареометров удается повысить точность определения до 0,001.
Наряду с ареометрами и денсиметрами для определения удельного веса в недавнем прошлом применялись ареометры с условной шкалой градусов Боме. 0° этой шкалы соответствует глубине погружения в чистую воду, а 10°-в 10%-ный раствор хлористого натрия. Для перевода градусов Боме на удельный вес пользуются следующей формулой:
где n — показатель ареометра Боме.
В табл. 7 привезены удельные веса растворов соли при 0°, 10°, 20° и соответствующие им значения концентрации соли а процентах к весу раствора.
При определении удельного веса раствора, температура которого не совпадает с температурой градуировки ариометра для приведения найденной величины удельного веса к температуре 20°, может быть использована следующая формула:
где: d4в20 — удельный вес при 20°;
d4в1 — то же при температуре измерений t;
0,0004 — коэффициент температурного изменения платности раствора соли.
Температура кипения и замерзания растворов хлористого натрия зависит от концентрации последнего: чем концентрированнее раствор, тем выше температура кипения и тем ниже температура замерзания (табл. 8).
При охлаждении насыщенного раствора ниже 0° сначала выделяется в осадок избыток растворенной соли, вследствие чего концентрация соли в растворе уменьшается, и, после того как она уменьшится до 24,4%, раствор замерзает при температуре -21,2°. Cоль, выделяющаяся в осадок при температуре ниже 0°, имеет состав NaCl 2Н20. т. е. кристаллизуется с двумя молекулами воды. При дальнейшем увеличении концентрации температура замерзания не понижается, а повышается, причем в твердом виде выделяется не вода, а соль. Tемпература -21,2° является самой низкой из всех возможных температур замерзания раствора поваренной соли.
Реакция растворов хлористого натрия и природных солей почти нейтральная. По стандарту на соль поваренную пищевую реакция водного раствора соли на лакмус должна быть нейтральной или близкой к ней.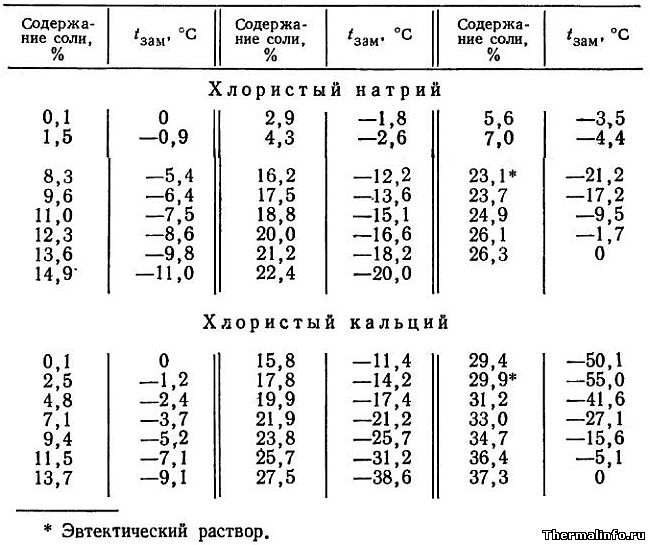
Насыщенный раствор соли при относительной влажности воздуха равной 75,5 % не теряет влаги испарением и не поглощает ее из воздуха. Эта равновесная относительная влажность называется гигроскопической точкой насыщенного раствора соли и приближенно равняется гигроскопической точке твердой соли.
Рассолоконценраторы.
Помимо кристаллической соли, при посоле расходуется большое количество водных растворов ее рассола или искусственного тузлука. Для приготовления их целесообразно использовать специальные установки — рассолоконцентраторы, производительность которых может колебаться в широких пределах, Рассолоконцентратор небольшой производительности представляет деревянный сосуд цилиндрической или конической формы, высотой около 60-70 см, в котором на расстоянии 10-15 см от дна укреплена решетка, покрытая тканью (мешковиной) или чистой сеткой, служащая для размещения на ней слоя высотой не менее 50-40 см.
Непосредственно около дна рассолоконцентратора имеется сливная труба. Вода поступает в верхнюю часть через перфорированный трубопровод или через перфорированную поверхность и равномерно распределяется по всему поперечному сечению слоя соли в рассолоконцентраторе. Регулируя скорость истечения воды и высоту слоя соли, легко добиться вытекания насыщенного рассола, имеющего удельный вес 1,2.
Регулируя скорость истечения воды и высоту слоя соли, легко добиться вытекания насыщенного рассола, имеющего удельный вес 1,2.
Для быстрого получения больших количеств рассола предлагаем рассолоконцентратор, в который вода подается насосом в нижнюю часть под давлением, а рассол вытекает из верхней части.
Слой соли в этом случае поддерживается высотой не менее 1 м, чтобы полное насыщение происходило при однократном движении воды через слой соли.
На вопрос Подскажите идиоту, как правильно сделать кристалл из соли? Я в воде растворял до фига соли (в теплой). заданный автором XMatvey
лучший ответ это Насыпьте пищевую соль в стакан и оставьте минут на 5, предварительно помешав. За это время стакан с водой нагреется, а соль растворится. Желательно, чтобы температура воды пока не снижалась. Затем добавьте ещё соль и снова перемешайте. Повторяйте этот этап до тех пор, пока соль уже не будет растворяться и будет оседать на дно стакана. Мы получили насыщенный раствор соли. Перелейте его в чистую ёмкость такого же объёма, избавившись при этом от излишек соли на дне. Выберите любой понравившийся более крупный кристаллик поваренной соли и положите его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана. Теперь нужно подождать. Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться. А если проделать всё то же ещё раз (приготовить насыщенный раствор соли и опустить в него этот кристаллик) , то он будет расти гораздо быстрее (извлеките кристаллик и используйте уже приготовленный раствор, добавляя в него воды и необходимую порцию пищевой соли) . Помните, что раствор должен быть насыщенным, то есть при приготовлении раствора на дне стакана всегда должна оставаться соль (на всякий случай) . Для сведений: в 100г воды при температуре 20°С может раствориться приблизительно 35г поваренной соли. С повышением температуры растворимость соли растёт.
Перелейте его в чистую ёмкость такого же объёма, избавившись при этом от излишек соли на дне. Выберите любой понравившийся более крупный кристаллик поваренной соли и положите его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана. Теперь нужно подождать. Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться. А если проделать всё то же ещё раз (приготовить насыщенный раствор соли и опустить в него этот кристаллик) , то он будет расти гораздо быстрее (извлеките кристаллик и используйте уже приготовленный раствор, добавляя в него воды и необходимую порцию пищевой соли) . Помните, что раствор должен быть насыщенным, то есть при приготовлении раствора на дне стакана всегда должна оставаться соль (на всякий случай) . Для сведений: в 100г воды при температуре 20°С может раствориться приблизительно 35г поваренной соли. С повышением температуры растворимость соли растёт.
Так выращивают кристаллы поваренной соли (или кристаллы соли, форма и цвет которых Вам больше нравится)
Ответ от 22 ответа
[гуру]
Привет! Вот подборка тем с ответами на Ваш вопрос: Подскажите идиоту, как правильно сделать кристалл из соли? Я в воде растворял до фига соли (в теплой).
Ответ от Взрослить
[новичек]
нужно привязать на кристаллик соли нить и опустить на дно стакана так чтобы он не касался его стенок, и оставить его на несколько дней с каждым днём кристаллик будет расти.
Ответ от Волосок
[гуру]
Соль и так из кристаллов состоит, но маленьких.
Ответ от Ѐашид Габбасов
[гуру]
Максимальная растворимость примерно при 41 С (забавная дуга расворимости, дальше греешь и меньше растворяется) . У любимий девушки сдёрните волосок и самый крупный кристал погрузите на весу. Вырастают очень крупные. Сколькл грамм на литр не помню. Рекорд азотистого серебра. 1700 г. на литр.
Ответ от Двутавровый
[гуру]
«…Выберите любой понравившийся более крупный кристаллик поваренной соли и положите его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана. Теперь нужно подождать. Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться… «
Цитируем все!
Ответ от Andrey Shahnov
[гуру]
шерстяная нить свисающая по цетру стакана
Ответ от Миротворец С базукой
[гуру]
Кристаллы поваренной соли — процесс выращивания не требует наличия каких-то особых химических препаратов. У нас всех есть пищевая соль (или поваренная соль) , которую мы принимаем в пищу. Её также можно назвать и каменной — всё одно и то же. Кристаллы поваренной соли NaCl представляют собой бесцветные прозрачные кубики. Начнём. Разведите раствор поваренной соли следующим образом: налейте воды в ёмкость (например стакан) и поставьте его в кастрюлю с тёплой водой (не более 50°С — 60°С). Конечно, в идеальном варианте, если вода не будет содержать растворённых солей (т. е. дистилированная) , но в нашем случаем можно воспользоваться и водопроводной. Насыпьте пищевую соль в стакан и оставьте минут на 5, предварительно помешав. За это время стакан с водой нагреется, а соль растворится. Желательно, чтобы температура воды пока не снижалась. Затем добавьте ещё соль и снова перемешайте. Повторяйте этот этап до тех пор, пока соль уже не будет растворяться и будет оседать на дно стакана. Мы получили насыщенный раствор соли. Перелейте его в чистую ёмкость такого же объёма, избавившись при этом от излишек соли на дне. Выберите любой понравившийся более крупный кристаллик поваренной соли и положите его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана. Теперь нужно подождать. Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться. А если проделать всё то же ещё раз (приготовить насыщенный раствор соли и опустить в него этот кристаллик) , то он будет расти гораздо быстрее (извлеките кристаллик и используйте уже приготовленный раствор, добавляя в него воды и необходимую порцию пищевой соли). Помните, что раствор должен быть насыщенным, то есть при приготовлении раствора на дне стакана всегда должна оставаться соль (на всякий случай). Для сведений: в 100г воды при температуре 20°С может раствориться приблизительно 35г поваренной соли. С повышением температуры растворимость соли растёт.
Так выращивают кристаллы поваренной соли (или кристаллы соли, форма и цвет которых Вам больше нравится)
ссылка
1. При приготовлении растворов следует соблюдать чистоту. Вся необходимая посуда должна быть заранее тщательно вымыта. Готовить растворы следует, используя чистые реактивы и дистиллированную воду.
2. Подлежащие растворению твердые вещества, особенно трудпорастворимые, рекомендуется измельчать, так как растворение крупных кристаллов и комков происходит очень медленно.
3. Некоторые вещества, будучи растертыми в тонкий порошок, имеют свойство плавать по поверхности воды, не смачиваясь. Перед растворением такие порошки следует растереть в ступке с небольшим количеством воды до образования однородной кашицы, которую затем смывают водой в стакан и далее растворяют как обычно. Иногда перед растворением смачивают порошок несколькими каплями спирта.
4. Применение для приготовления растворов горячей воды при точных работах не рекомендуется. Хотя нагревание и ускоряет процесс растворения, оно приводит к изменению концентрации за счет испарения и к неточностям в измерении объемов.
5. Если растворение происходит медленно, суспензию необходимо перемешивать с помощью механической мешалки или, лучше, взбалтывать в закрытой склянке или колбе на механическом встряхивателе.
6. Легко растворяющиеся твердые вещества и жидкости перемешивают вручную в закрытом сосуде (если не предвидится выделения газов или паров) путем встряхивания или многократного перевертывания сосуда; можно перемешивать их стеклянной лопаточкой в стакане.
7. При растворении сильных кислот, особенно серной и азотной, следует приливать кислоту в воду, но ни в коем случае не наоборот.
8. Следует помнить, что взвешивание жидких кислот, а также летучих жидкостей можно производить только в герметически закрывающихся сосудах. Чаще же нужные количества жидкостей отмеряют мерными цилиндрами или пипетками.
Плотность жидкости при этом либо измеряют с помощью денсиметра
, либо находят в справочниках. В последнем случае измерение объема жидкости необходимо производить при той же температуре, для которой указана плотность: разница даже в несколько градусов может привести к заметным ошибкам.
9. Растворение сухих щелочей в воде необходимо производить, добавляя щелочь в воду небольшими порциями и осторожно перемешивая. Если оставить гранулированную или чешуированную щелочь в сосуде с водой на некоторое время без перемешивания, гранулы слипнутся в единый комок, на растворение которого уйдет очень много времени, даже если перемешивание затем возобновить.
10. Концентрированные растворы едких щелочей не рекомендуется хранить; их готовят непосредственно перед употреблением. Если потребность в хранении все же возникает, используют бутыли из полиэтилена или покрывают стеклянные бутыли изнутри слоем парафина, поскольку концентрированные щелочи выщелачивают стекло. Для нанесения защитного слоя готовят 10-15%-ный раствор парафина в бензине и наливают его в бутыль в таком количестве, чтобы хватило для равномерного смачивания всей внутренней поверхности. Затем бутыль продувают воздухом до полного удаления паров бензина.
11. Если необходимо приготовить насыщенный раствор вещества, растворимость которого в воде неизвестна, вещество добавляют небольшими порциями, каждый раз добиваясь полного растворения, до тех пор, пока последняя порция уже не будет растворяться. Следует иметь в виду, что с повышением концентрации раствора скорость растворения падает. Поэтому быть уверенным, что состояние насыщения достигнуто, можно лишь в том случае, если количество твердого вещества не уменьшилось после по крайней мере получасового перемешивания раствора.
Рекомендуется также готовить насыщенный раствор в теплой воде, а затем охладить его до комнатной температуры. Некоторое количество растворенного вещества должно при этом выпасть в осадок. Исключение составляют очень немногие вещества (например, карбонат лития), растворимость которых в воде с повышением температуры уменьшается.
Инструкция
Для того чтобы вырастить соляной кристалл дома, вам следует подготовить необходимое оборудование, материалы и инструменты.
1) Основным компонентом является соль. Чем она чище, тем успешнее будет результат эксперимента, и тем четче получатся грани кристалла. Учитывая то, что поваренная соль в большинстве случаев в себе большое количество мелкого мусора, предпочтение лучше отдать морской соли без красителей и всевозможных добавок.
2) Воду также правильнее брать ту, которая максимально очищена от разнообразных примесей, т.е. дистиллированную. Если же таковой под рукой не оказалось, предварительно отфильтруйте обычную воду.
3) Для выращивания кристаллов используйте тщательно вымытую неметаллическую емкость, которая не будет окисляться под воздействием солей. Лучше взять стеклянную посуду. Если внутри чаши все же окажутся даже мельчайшие соринки, они непременно замедлят рост основного кристалла, превратившись в своеобразную основу для развития мелких экземпляров.
4) Основой для будущего большого кристалла может стать как небольшой кристаллик соли, так и любой другой объект, например, проволока, нитка, кусочек ветки.
5) Также пригодятся при формировании кристалла из соли деревянная палочка для помешивания раствора, бумажные салфетки, фильтровальная или марля, лак для покрытия готового соляного кристалла.
Подготовьте необходимые для выращивания кристалла материалы и инструменты, запаситесь терпением и приступайте к работе. Сам процесс не потребует от вас особого участия. В стеклянной чашке приготовьте насыщенный солевой раствор из 100 мл горячей воды и 40 г соли, дайте жидкости остыть и пропустите ее через фильтрованную бумагу или свернутую в несколько слоев марлю.
Следующий этап – помещение предмета, вокруг которого впоследствии сформируется кристалл, в емкость с соляным раствором. Если вы хотите получить экземпляр традиционной формы, положите обычную крупинку соли на дно чашки. Если желаете вырастить вытянутый кристалл, привяжите соляную крупинку к нитке и закрепите ее в емкости так, чтобы она не касалась ее дна и стенок. Если же в ваших планах получение сложной причудливой формы, основой для будущего кристалла должна послужить небольшая изогнутая веточка или скрученная проволока. В качестве основы для кристалла можно использовать совершенно любой предмет, который не подвержен окислению солей.
Чашку с кристаллом обязательно накройте крышкой, листом бумаги или салфеткой для исключения попадания в нее мусора и пыли. Далее отправьте емкость на хранение в темное прохладное место без сквозняков и обеспечьте ей полное спокойствие. На протяжении развития кристалла не допускайте изменения влажности воздуха и резких скачков температуры в помещении, где он находится, исключите его встряхивание и слишком частые передвижения. Не размещайте кристалл вблизи отопительных приборов и возле кухонной плиты.
По мере роста кристалла содержание соли в окружающей его жидкости будет уменьшаться. Учитывая это, раз в неделю добавляйте в емкость насыщенный соляной раствор. Когда кристалл вырастет до необходимых размеров, аккуратно выньте его из жидкости, выложите на чистую бумажную салфетку и осторожно промокните мягкой тканью. Для того чтобы хрупкий кристалл приобрел прочность, покройте его бесцветным маникюрным лаком. Если этого не сделать, поделка разрушится. В сухой воздушной среде кристалл рассыплется в порошок, при повышенной влажности воздуха превратится в кашицу.
Из поваренной и морской соли получаются кристаллы белого . Получить поделку другого оттенка вы можете с помощью нескольких нехитрых способов.
1) Цветной соляной кристалл можно получить, если использовать не обычную соль, а к примеру, медный купорос, который может наделить результат ваших трудов насыщенным синим цветом.
2) Вместо прозрачного лака для ногтей для обработки кристалла вы можете использовать цветное покрытие.
3) На стадии приготовления кристалла добавьте в соляной раствор пищевые красители, например, для окрашивания пасхальных яиц.
Если вы заметили, что кристалл приобретает не ту форму, какая была запланирована, аккуратно соскоблите с помощью острого ножа или маникюрной пилочки для ногтей лишние участки. В последствие обработайте те места кристалла, роста которых вы не хотели бы допускать, глицерином или любым другим густым жирным составом. Удалить нанесенное средство можно с помощью спирта или ацетона.
Потерпеть неудачу в выращивании кристалла из соли можно по нескольким причинам. Во-первых, взятый за основу кусочек соли может раствориться. Об этом, как правило, сигнализирует недостаточно насыщенный соляной раствор, который вы использовали для роста поделки. Во-вторых, вместо одного большого кристалла вы можете получить сразу несколько маленьких. Такое может случиться из-за наличия в растворе посторонних примесей или попадания в него соринок, частичек пыли и прочих нежелательных объектов. В-третьих, при получении цветных экземпляров окраска готовых кристаллов может оказаться неравномерной. Основная причина такой реакции – недостаточно тщательное размешивание красителя после добавления его в соляной раствор.
Мало-мальски приличный по величине кристалл сформируется не ранее, чем через 3-4 недели после помещения его основы в солевой раствор, поэтому наберитесь терпения и не забывайте выполнять основные рекомендации по самостоятельному выращиванию кристаллов из соли в домашних условиях.
Связанная статья
Для того чтобы вырастить кристалл из соли, сначала необходимо приготовить достаточно концентрированный соляной раствор. Соль добавляется в стакан с водой, до тех пор, пока она не перестанет растворяться во время перемешивания.
Теперь следует нагреть полученную смесь, чтобы достичь полного растворения выбранной соли. Стакан с соляным раствором ставится в емкость с горячей водой. Затем полученный концентрированный раствор соли переливается в специальный стакан или емкость. В стакан при помощи перемычки (ее можно и из стержня шариковой ) подвешивается на нитке кристаллическая «затравка» – кристалл поваренной соли, так, чтобы он был полностью погружен в полученный раствор и не касался стенок химического стакана. Также кристалл можно опустить на дно стакана. На данной «затравке» и предстоит расти вашему будущему кристаллу. Емкость с солевым раствором следует поставить в теплое место и оставить открытой.Чтобы вырастить кристалл из соли необходимо подождать некоторое время. Через несколько дней ваш кристалл будет значительно увеличиваться в размерах. По истечению трех дней после начала эксперимента нитка с «затравкой», которая опущена в концентрированный соляной раствор, превратится в «ожерелье» из маленьких кристаллов.Если вы хотите, чтобы ваш кристалл вырос еще быстрее, необходимо еще раз провести процедуру приготовления соленого раствора. Вашу «затравку» можно поместить в новый раствор соли и добавить необходимую порцию поваренной соли. Нужно помнить, что соляной раствор обязательно должен быть сильно концентрированным – во время приготовления смеси на дне химического стакана должна оставаться соль. К примеру, в 100 мл воды при температуре 20 градусов Цельсия можно растворить примерно 35 грамм пищевой соли. При увеличении температуры растворимость поваренной соли повышается.Когда ваш кристалл вырастет до нужного размера, его следует вытащить из раствора и высушить при помощи мягкой тряпочкой или бумажной салфетки. Затем нитка обрезается, а грани кристалла покрываются бесцветным лаком, для того чтобы сохранить его от «выветривания» на воздухе.С помощью данного метода можно выращивать поваренной соли любого оттенка или формы.
Видео по теме
Источники:
- что можно сделать из соли
Одним из видов поделок из природных материалов являются выращенные в домашних условиях кристаллы соли. Кроме того, многих интересует, можно ли вырастить соль самостоятельно, чтобы употреблять ее в пищу. Но в действительности вырастить красивый кристалл можно исключительно в декоративных целях, ведь для этого вы будете использовать ту соль, которую приобретаете в магазине.
Вам понадобится
- Вода, емкость, в которой можно нагревать воду, хлорид натрия, мелкий твердый предмет, плита, на которой можно нагревать воду, нить, вазелин.
Инструкция
Возьмите нить и закрепите на ней мелкий твердый предмет, например, бусину, бисер или небольшую гайку. Всю нитку выше нашего мелкого предмета нужно обработать вазелином. Опустите нитку с этим предметом в насыщенный солевой раствор. Раствор должен полностью покрывать груз (мелкий предмет на нитке), но груз не должен касаться дна.
Продержите груз в растворе как минимум несколько дней. Если кристаллы прекратили рост слишком рано, то следует удалить вазелин с нити около кристалла.
Видео по теме
Обратите внимание
Любые химические опыты требуют осторожности, даже в том случае, если вы работаете с относительно безопасными реагентами, такими, как поваренная соль. Используя другие соли и красители, вы должны быть уверены, что хорошо знакомы с их свойствами.
Полезный совет
Чем больше времени вы затратите на процесс выращивания, тем большего размера будут кристаллы. Если вы планируете долго выращивать кристаллы, емкость нужно держать в теплом месте. А для регулировки формы можно соскабливать ножом лишние наросты.
Источники:
- На этой странице вы найдете подробное описание всего процесса выращивания кристаллов соли.
Вырастить кристалл самостоятельно, в домашних условиях станет под силу даже мало ознакомленным с химическими процессами людям, а полученный результат, как и сам процесс изготовления, несомненно, доставит огромное удовольствие. Итак, приготовьтесь, мы начинаем колдовать и «химичить».
Вам понадобится
- Цветная растворимая соль (двухлористый или сернокислый никель) или поваренная соль; родниковая или фильтрованная вода, металлическая емкость, плита, веревка (шерстяная или ворсовая нить), бесцветный лак для ногтей.
Инструкция
Для начала приобретите цветную растворимую соль, например, двухлористый или сернокислый . Купить данное вещество можно практически в любой аптеке либо заказать через интернет. В случае невозможности достать вышеуказанный материал, подойдет также обычная поваренная соль.
Возьмите стакан с чистой водой. Вода и соль должны быть в соотношении 1/2,5, т.е., например, на 100 мл воды вам понадобится не менее 250 граммов соли. Медленно всыпьте соль в воду и размешайте до полного растворения.
Снимите емкость с полученным перенасыщенным раствором и, не давая остыть, опустите внутрь небольшую веревку ( будет шерстяная или любая другая ворсовая нить, так как поможет кристаллу лучше крепиться на основании).
В течение последующих трех дней начинается кристаллизация соли. Слишком быстрое охлаждение раствора может повлечь за собой неправильную и непривлекательную форму. Именно поэтому его следует охлаждать , лучше всего это делать при комнатной температуре. Тогда вы, получите правильные по форме, изящные кристаллы.
Готовый кристалл выньте из раствора и промокните со всех сторон бумажной салфеткой. При необходимости обрежьте конец шерстяной нитки и сразу же покройте все грани бесцветным лаком (подойдет обычный лак для расщепления со временем при непосредственном контакте с воздухом)
Как видите, выращивание кристаллов — очень занимательное и не требующее больших усилий дело. По истечение трех суток опущенная в воду нитка в буквальном смысле превращается в блестящее, сверкающее ожерелье, способное стать стильным аксессуаром, украшением на новогодней елке или просто предметом гордости первого удачного колдовства на домашней кухне!
Полезный совет
Внимание: от качества воды напрямую зависит успех эксперимента и красота кристалла, поэтому лучше выбирать родниковую или фильтрованную.
Связанная статья
Источники:
- кристаллы поваренной соли
Хотите вырастить в домашних условиях красивый минерал? Легко! В природе минералы зачастую формируются в водных минерализованных растворах. Этот же принцип можно использовать и дома. Все, что нужно — выбрать, какой именно минерал вы бы хотели. Например, посмотрите как просто вырастить дома восхитительный синий минерал халькантит.
Вам понадобится
- 100 грамм медного купороса, банка, 100-150 мл воды, нитка, карандаш.
Инструкция
Купите два пакетика медного купороса в любом садовом магазине. Обычно продается по 50 грамм, следовательно, вам необходимо приобрести 100 грамм купороса для выращивания кристалла. Возьмите небольшую банку и налейте в нее воды. Количество воды не должно быть большим, не более 150 и не мне 100 мл. Нагрейте воду.
Остальное содержимое пакетиков высыпьте в банку. Помните, вода должна быть горячей. Хорошенько размешайте, чтобы добиться перенасыщенного раствора. Раствор должен быть темно-синего . В дальнейшем на дне банки будет образовываться осадок, пока раствор не станет насыщенным. Когда раствор избавится от перенасыщения, цвет изменится на . Если же раствор получился не перенасыщенным, есть два решения. Либо купите еще один пакетик медного купороса, либо подождите, пока исчезнет воды. В этом случае придется подождать несколько дней.
Остудите раствор. Когда температура достигнет комнатных значений, опустите в раствор ранее заготовленные зерна на нитке. Как только начнется выпадение осадка, зернышко начнет расти. Минерал растет около 4 дней.
Один раз в день кристалл необходимо вытаскивать и нагревать раствор. Также размешивайте осадок, снова остужайте раствор и снова опускайте зерно купороса. Для ровных краев будущего кристалла наросты с нитки можно счищать или растворять.
Спустя несколько дней достаньте минерал
, высушите. Обрежьте нитку. Не допускайте долгого нахождения в воде. Выпавший осадок можно использовать повторно.
Видео по теме
Приготовление насыщенного горячего раствора в воде
Бензидин солянокислый, насыщенный водный раствор. Для приготовления бесцветного раствора 2 г солянокислого бензидина растворяют в 100 мл горячей воды, добавляют 50 мг активированного угля и фильтруют в горячем состоянии. После охлаждения снова фильтруют. [c.199]
Приготовление насыш,енных растворов. Насыщенный раствор готовят, растворяя в определенном объеме твердое вещество до тех пор, пока оно не перестанет растворяться. Большинство химических соединений лучше растворяются при нагревании, поэтому насыщенные растворы обычно готовят путем растворения в горячей воде с последующим охлаждением. [c.61]
ПРИГОТОВЛЕНИЕ НАСЫЩЕННОГО ГОРЯЧЕГО РАСТВОРА В ВОДЕ [c.113]
Примечание. Колбу с кристаллами КЫОз, закрыв пробкой, можно сохранить для дальнейших демонстраций. Иодид свинца сохранить нельзя — он при длительном стоянии разлагается. Для приготовления насыщенных растворов можно использовать и многие Другие вещества например, дихромат калия, хлорид свинца, борную кислоту, бензойную кислоту. Все они легко растворяются в горячей воде и при охлаждении дают красивые кристаллические осадки. [c.65]
Аскорбинат натрия eHjO Na, молекулярная масса 198,11 [а]р =- -105 (вода) хорошо растворим в воде, нерастворим в безводном спирте, эфире и других органических растворителях. Аскорбинат натрия получают путем нейтрализации насыщенного водного раствора аскорбиновой кислоты бикарбонатом натрия при температуре 55—70° С и осаждения полученной соли из водного раствора спиртом [35] или путем добавления горячего спиртового раствора NaOH к спиртовому раствору аскорбиновой кислоты и последующей кристаллизации 21]. Аскорбинат натрия применяют вместо аскорбиновой кислоты для приготовления инъекционных растворов [151], а также для витаминизации пищевых продуктов. [c.290]
Взвесить на технохимических весах 18 г бихромата калия и высыпать в химический стакан. Рассчитать, какое количество воды надо прибавить, чтобы получить насыщенный при 70° С раствор. Отмерить мерным цилиндром воду и вылить ее в стакан с навеской бихромата калия. Нагреть стакан с приготовленной смесью до кипения, помешивая раствор стеклянной палочкой. Если в полученном растворе есть нерастворимые примеси, то его надо профильтровать, пользуясь воронкой для горячего фильтрования. Горячий раствор охладить, поместив стакан с раствором в чашку с холодной водой. Измерить температуру охлажденного раствора. Образующиеся кристаллы отфильтровать на воронке Бухнера, высушить между двумя листами фильтровальной бумаги и поставить на 30—40 мин в сушильный шкаф, нагретый до 100° С. После охлаждения полученный бихромат взвесить. Определить выход в процентах по отношению к исходной навеске. [c.44]
Однако его влияние обычно устраняют. Это достигается включением промежуточного электролита между двумя полуэлементами (см. рис. 62). Для этого чаще всего берут КС1, электропроводность ионов которого приблизительно одинакова / i =66,3 и /к = 63,5 (при одинаковой электропроводности катиона и аниона диффузионный потенциал, вызываемый таким электролитом, равен нулю). Концентрация промежуточного электролита должна быть выше, чем концентрация раствора в полуэлементах. Кроме того, промежуточный электролит должен быть химически индифферентен по отношению к веществам, составляющим данную цепь. Обычно пользуются насыщенным раствором хлористого калия, который помещают в соединительную трубку (сифон) М. (рис. 66). Для того чтобы раствор не выливался из сифона, поступают следующим образом. В горячей воде растворяют агар-агар и сюда же вносят соль. После растворения соли еще горячим раствором заполняют сифон, держа его отверстиями вверх. Заполненным трубкам дают остыть. При охлаждении агар застудневает. Приготовленные таким путем [c.267]
Приготовление смеси для заполнения стеклянного мостика 3 г агара нарезают на мелкие куски, заливают их 100 мл воды и кипятят в фарфоровой чашке или лучше в небольшой колбе Эрленмейера до образования коллоидного раствора. В горячий раствор вносят при помешивании 10 г хлористого калия и продолжают нагрев до полного растворения соли. Горячей массой заполняют предварительно нагретый стеклянный мостик, который хранят в насыщенном растворе хлористого калия. [c.119]
Выполнение работы. На техно-химических весах отвесить около 6 г дихромата калия и высыпать его в химический стакан вместимостью 50 мл. По таблице растворимости (Приложение, табл. 5) вычислить количество воды, необходимое для получения насыщенного раствора дихромата калия при 100 °С. Мензуркой отмерить объем воды на, 2—3 мл больше вычисленного и вылить ее в стакан с дихроматом калия. Стакан с раствором поставить иа кольцо штатива на асбестированную сетку и нагревать на небольшом пламени горелки до полного растворения соли, все время перемешивая стеклянной палочкой. Приготовить воронку для горячего фильтрования. В стеклянную воронку с коротким широким концом вложить бумажный фильтр, смочить его дистиллированной водой и вставить стеклянную воронку в металлический конус воронки для горячего фильтрования. Под воронку поставить чистый стакан (см. рис. 23). Нагретый до кипения раствор профильтровать горячим, сливая его небольшими порциями по палочке в приготовленную воронку для горячего фильтрования. Стакан с первоначальным раствором все время нагревать на сетке. Полученный фильтрат в стакане охладить до комнатной температуры, все время перемешивая стеклянной палочкой, а затем поставить в холодную воду, продолжая перемешивать до полного охлаждения. [c.26]
Основные соли получают при неполном насыщении оснований. Однако обычно для их получения смешивают растворы нейтральных солей и сво- бодных оснований или частично гидролитически разлагают нейтральную соль, например вливая ее раствор в горячую воду. (Так получают прежде всего труднорастворимые основные соли сурьмы и висмута.) В случае приготовления солей тяжелых металлов и слабых кислот при работе с, водными растворами часто вместо нейтральных солей получают основные соли. [c.877]
Кристаллический КС1 осторожно прокаливают в фарфоровой чашке на горелке, чтобы удалить из него воду, и охлаждают в эксикаторе. Для приготовления О, I н. раствора 0,7456 г прокаленного хлорида калия растворяют в 100 мл дистиллированной воды. Насыщенный раствор КС1 приготовляют, внося в горячую (около 80 ) дистиллированную воду твердую соль до тех пор, пока она не перестанет растворяться. По охлаждении раствора избыток соли выпадает в осадок, а жидкость над ним становится насыщенным раствором. Раствор хранят, не сливая его с выделившихся кристаллов. [c.381]
Из баков 11 насосом солевую пульпу через холодильники 5 подают в напорный бак 4. Температуру в баке поддерживают 18— 20 °С, меняя расход захоложенной воды, подаваемой на холодильник. Здесь происходит окончательное насыщение рассола сульфатом натрия. Из бака 4 пульпа поступает на центрифугу 10 для выделения твердой поваренной соли из рассола. Кристаллическую поваренную соль из центрифуги выводят в бак приготовления обратного рассола 13. Отфугованный рассол, насыщенный сульфатом натрия, собирают в баки 14. Из баков насосом обогащенный сульфатом рассол подают в спиральные теплообменники 6, где его нагревают до 60—75 °С горячим обедненным сульфатным рассолом. Затем подогретый рассол поступает в кристаллизатор 7— вертикальный цилиндрический аппарат, состоящий из сепаратора, теплообменника и циркуляционного насоса. В кристаллизаторе раствор нагревается до 100—105 °С водяным паром, подаваемым в греющую камеру аппарата. [c.208]
Все они более или менее легко растворимы в воде. Задача производства селитры заключается в систематическом выщелачивании ее горячей водой, для чего издавна и до сих пор еще неизменно в Чили пользуются способом Шанкса в том виде, в каком он применяется в производстве соды при приготовлении щелока из содового плава по Леблану. Для отделения селитры от вышеупомянутых солей—примесей, пользуются различной растворимостью их при данной температуре растворяющей воды и различной концентрацией их в растворе, т. е. различным количеством каждой соли в одном и том же об емеводы. Для приготовления раствора, размельченную в дробилках, руду (диаметр куска раздробленной руды не должен превышать 5 сантиметров для успешности выщелачивания] вносят в кипятильные котлы, воду в которых нагревают закрытым паром, проводимым в эти котлы через железные трубы. Крепкий раствор солей кипятится довольно продолжительное время, пока не насыщается нитратом и, по насыщении, пропускается в кристаллизаторы, где, охлаждаясь, освобождает нитрат [c.7]
Приготовление 0,1 н. или 0,02 и. раствора К2СГ2О7. Раствор бихромата калия готовят из химически чистого, дважды перекристаллизованного бихромата калия. Для перекристаллизации кристаллический бихромат калия растирают в ступке в порошок и растворяют его в воде до насыщения при температуре, близкой к кипению. Затем горячий раствор фильтруют через складчатый фильтр, вставленный в воронку. Стакан с фильтром ставят в охлаждающую среду (снег, лед, холодную воду) и раствор энергично перемешивают. Выделившиеся в стакане кристаллы отделяют от маточного раствора фильтрованием на воронке Бюхнера. После второй кристаллизации бихро-йата калия высушивают в сушильном шкафу при температуре 150—200 °С. [c.170]
Для приготовления реактивного порошка силикагель растирают в ступке и, просеивая через сито, отделяют фракцию с размером частиц 0,5—1,0 жж затем силикагель помещают в фарфоровый стакан, заливают разбавленной соляной кислотой (1 1) из расчета 3 мл кислоты на 1 г силикагеля и кипятят, перемешивая содержимое стакана стеклянной палочкой. После этого кислоту сливают и силикагель промывают теплой дистиллированной водой до отрицательной реакции на ион хлора. Обработанный таким способом силикагель сушат при температуре 90—100° С, а затем в течение 2 ч прокаливают в муфельной печи при 750° С и после охлаждения ссыпают в склянку с притертой пробкой. Для приготовления реактивного поропша зерна этого силикагеля насыпают в фарфоровую чашку и тотчас же заливают их избытком горячего насыщенного водного раствора перманганата калия. После тщательного перемешивания раствор сливают, силикагель высушивают на воздухе и помещают в склянку с притертой пробкой, в которой и хранят без доступа воздуха до употребления. [c.177]
Мастер производственного обучения должен объяснить, чем отличается очистка от примесей технического нитрата калия методом перекристаллизации от выполненной ранее работы по очистке поваренной соли. Поскольку растворимость нитрата калия при нагревании от 20 до 60°С возрастает более чем вдвое, растворение ведут в горячей воде (65—70°С) и приготовленный раствор фильтруют горячим. Перед фильтрацией в раствор можно добавить немного активированного угля, являющегося эффективным адсорбентом, чтобы очистить раствор от смолистых примесей. После очистной фильтрации горячего раствора фильтрату дают медленно охладиться. При этом происходит кристаллизация чистого нитрата калия, который выпадает в виде мелких кристаллов. Их отфильтровывают и высушивают. Растворимые в воде примеси остались в фильтрате, представляющем собой насыщенный раствор нитрата калия, в котором находятся все водорастворимые примеси. Нужно обьяснить учаищмся, что при такой очистке выход перекристаллизованной соли составляет около 50% от взятой на очистку. При упаривании фильтрата можно вьщелить остальной нитрат калия, но он снова будет содержать водорастворимые примеси. На этом примере следует показать, что даже относительно простая очистка вещества от примесей сопряжена с потерями вещества. [c.32]
Крупнопористый силикагель, измельченный до размера зерен 0,5—1 мм, дважды кипятят в разбавленном растворе НС1 (1 1) до получения бесцветных растворов, отмывают кипящей водой до отсутствия С[- в промывных водах. Затем силикагель сушат в сушильном шкафу 2—3 ч при 100—120 °С, после чего загружают в трубку и сушат при 200 °С в токе сухого кислорода 2 ч. Свежевысушенный еще горячий силикагель переносят в коническую колбу вместимостью 200 мл с пришлифованной пробкой и по каплям прибавляют раствор бихромата калия в 98%-ной серной кислоте, энергично встряхивая содержимое колбы. На 80—90 г силикагеля берут 50 мл раствора. О насыщении силикагеля раствором судят по начинающемуся прилипанию гранул к стенкам колбы. Если раствора внесено слишком много, добавляют сухой силикагель из запасной склянки. Готовый препарат высыпают в заранее приготовленные ампулы порциями, достаточными для одного наполнения поглотительного аппарата, и тотчас же запаивают. В таком виде препарат может храниться неопределенно долгое время. Серную кислоту и силикагель также хранят в запаянных ампулах небольшими порциями. [c.75]
Цинковая соль наиболее характеристична для этой кпслоты. Она труднорастворима как в горячей, так и в холодной воде. Приготовленная насыщенном кислоты углекислым цинком, при выпаривании выделяется в виде белых, блестящих, гибких чешуек, которые под микроскопом являются шестиугольными таблицами. При высушнва-нии в водяной бане она теряет свою кристаллизационную воду, не изменяя наружного вида. При медленной кристаллизации из большого количества раствора получаются явственные четырехсторонние ромбические таблицы. Соль содержит две частицы кристаллизационной воды. [c.157]
В пашей работе мы пользовались 99,%-м препаратом радия. Для каждого определения растворимости применялся свежеосажденньп сульфат радия. Приготовление растворов производилось исключительно путем растворения соли, методика работы была такая же, как и при определении растворимости сульфата радия в воде, только вместо воды соответственно применялись растворы серной кислоты или сульфата натрия. Достижение состояния равновесия осуществлялось путем встряхивания раствора с твердой фазой в течение 5—6 суток в термостате при 20°. Этого времени, как показала наша предыдущая работа, вполне достаточно для установления равновесия. После 3-часового отстаивания отбирали пробы порциями по 5 мл и пропускали через один и тот же коллоидный фильтр. Достижение максимального значения содержания радия в отдельных отфильтрованных порциях показывало, что наступило насыщение фильтра раствором сульфата радия и следующие порции насыщенного раствора сульфата радия не должны уже терять радия за счет адсорбции его на фильтре. Следует еще заметить, что всю используемую в этих опытах стеклянную посуду из иеиского стекла выдерживали перед употреблением в концентрированной серной кислоте, в то время как барбаторы предварительно обрабатывали горячим раствором хлористого бария. После такой обработки насыщенные растворы сульфата радия в воде в продолже- [c.252]
Получение пирофорного железа. К горячему насыщенному раствору железного купороса Ре804-7Н20, содержащему 6 г последнего, прилейте горячий насыщенный раствор оксалата натрия, приготовленный из 3 г соли. Выпавший осадок отфильтруйте на воронке Бюхнера, предварительно промыв его несколько раз горячей водой по методу декантации. Полученный оксалат железа высушите при 100°С. Полученную соль поместите в сухую пробирку, укрепите ее в горизонтальном положении на штативе и нагревайте пламенем газовой горелки до тех пор, пока порошок не станет черным и прекратится выделение газа. После этого нагревание прекратите и быстро закройте пробирку пробкой, чтобы избежать окисления железа. После охлаждения пробирки порошкообразное железо высыпьте на лист асбеста с высоты 20—30 см. [c.279]
В насыщенный раствор Sr lj нли Sr(N03)j (ч. д. а.) приливают 25%-ный раствор NaOH (х. ч.), не содержащий GOj (приготовление см. в разд. Натрий гидроокись , п, 3—5), до полного осаждения Sr (ОН)д. SHgO. Кристаллы быстро отсасывают на воронке Бюхнера, промывают холодной водой, не содержащей Oj, и перекристаллизовывают из горячей воды. [c.342]
Плохо растворим в холодной воде (0,64 г в 100 жл при 0° С), лучше — в горячей (3,3 г при 100° С) нерастворим в этаноле и эфире. Растворимость РЬС1г в растворах соляной кислоты, по концентрации не превышающих 10%, уменьшается, а при содержании НС выше 10% — увеличивается. Насыщенный раствор РЬС в концентрированной соляной кислоте при разбавлении частично выделяет РЬС1г. Для приготовления стандартного раствора препарат перекристаллизовывают из кипящей воды, сушат при 105° С и сохраняют в плотно закрытых банках. [c.269]
Нитрозилсерную кислоту приготовляют следующим образом помещают крахмальную пасту, приготовленную из 50 г крахмала и равного количества воды, в дистилляционную колбу с тубусом, которую нагревают на водяной бане. Азотную кислоту прибавляют по каплям достаточно быстро к горячему крахмалу, чтобы создать постоянный ток окислов азота, поступающий в 30 мл серной кислоты. Почти насыщенный раствор нитрозилсерной кислоты в закрытой бутыли устойчив неопределенно долгое время. [c.247]
Приготовление силикагелевого поглотителя. Для приготовления поглотителя пригоден силикагель с размером частиц 0,5—1,0 мм. Гранулированный силикагель размалывают и просеивают через сито, отбирая нужную фракцию. Затем его обрабатывают при кипении разбавленной соляной кислотой (1 1) из расчета 3 мл кислоты на 1 г силикагеля, после чего отфильтровывают и промывают теплой дистиллированной водой до отрицательной реакции на С1 . Силикагель сушат при 100—110 °С, прокаливают 2 ч в муфельной печи при 700— 750 °С, охлаждают и ссыпают в склянку с притертой пробкой, затем заливают горячим насыщенным раствором перманганата калия, который после тщательного перемешивания сливают. Силикагель высушивают в вакууме без нагревания и хранят в склянке с притертой пробкой. [c.128]
Приготовление ангидрона, илк безводного хлсриокислого магния (по Алимарину). К 30%-нему раствору хлорной кислоты понемногу добавляют химически чистую окись магния до насыщения, т. е. до прекращения растворения ее. Избыток окиси магния отфильтровывают через пористый стеклянный фильтр № 2 в фарфоровую чашку, нейтрализуют фильтрат хлорной кислотой до слабокислой реакции по конго красному, после чего выпаривают раствор до начала кристаллизации на водяной бане. Когда будет заметно выпадение кристаллов, чашку охлаждают в холодной воде и выпавшие игольчатые кристаллы отсасывают на воронке Бюхнера, но без бумажного фильтра. Полученные кристаллы растворяют в горячей воде и снова перекри-сталлизовывают. [c.517]
В химический стакан емкостью 1 л, снабженный пропеллерной мешалкой (скорость вращения 100—ПО об1мин), вливают при перемешивании 600 мл минерального масла. Масло нагревают до 65 °С и прибавляют к нему предварительно приготовленный продукт конденсации -оксибензолсульфокислоты и формальдегида. Смесь выдерживают в течение 1 ч при 65 °С, затем охлаждают, гранулы отделяют и промывают на воронке Бюхнера 500 мл бензола и 1000 мл горячего 0,2%-ного раствора некаля. Затем катионит нейтрализуют насыщенным раствором соды, промывают водой и сушат 12 ч при 80 °С. [c.287]
Чтобы установить титр раствора кислоты, рекомендуется применять кристаллическую буру состава ЫагВ407-IOh3O. В зависимости от условий кристаллизации бура способна образовывать кристаллы и с меньшим количеством молекул воды, например Na2B40y2h30. Чтобы получить однородные кристаллы десятиводной буры, ее необходимо перекристаллизовать, соблюдая определенные условия. Нагревают воду до 70° Сив ней готовят насыщенный раствор буры . Для этого растворяют при постоянном помешивании около 12 г мелкорастертой буры в каждых 100 мл воды температуру поддерживают 65—70° С. Приготовленный раствор быстро фильтруют через бумажный складчатый фильтр, применяя воронку для горячего фильтрования (см. рис. 27). Профильтрованный раствор медленно охлаждают до 25—30° С. Затем сосуд с раствором помещают в холодную воду. Для ускорения кристаллизации раствор помешивают стеклянной палочкой. Выпавшие кристаллы буры отделяют от раствора фильтрованием через воронку для отсасывания (см. [c.249]
Первая лабораторная работа по анализу методом нейтрааизащ1и -приготовление рабочего раствора соляной кислоты и установка его титра. Установочное вещество — перекристаллизованный тетраборат натрия — готовит препаратор или сам учащийся (по усмотрению мастера производственного обучения). Технический тетраборат перекристаллизовьтают из горячей воды (температура около 60° С), вьшавшие при охлаждении кристаллы десятиводной соли отфильтровывают на воронке Бюхнера и высушивают между листами фильтровальной бумаги. При длительном хранении кристаллы тетрабората могут потерять часть кристаллизационной воды, поэтому их нужно хранить в банке с притертой пробкой или в эксикаторе, на дно которого помещена фарфоровая чашка с насыщенным раствором бромида натрия, содержащим нерастворенный избыток этой соли. [c.121]
Исходное вещество взвешивают и, определив по табличным данным растворимость, подсчитывают примерное количество воды, необходимое для его растворения. Вещество помещают в стакан, коническую колбу или в фарфоровую чашку и приливают к нему воду, нагретую до определенной температуры. Можно также к веществу прилить немного воды, нагреть смесь до нужной температуры и добавлять небольшими порциями воду до полного растворения вещества. Раствор необходимо все время перемещивать и подогревать, поддерживая постоянную температуру, которую контролируют термометром. Если приготовленный раствор окажется мутным, его профильтровывают с использованием воронки для горячего фильтрования. Затем насыщенный раствор охлаждают на воздухе, в холодильнике или в охладительной смеси до выпадения мелкокристаллического осадка. Выпавшие кристаллы отфильтровывают, промывают и высушивают. [c.24]
Поваренная соль растворимость в воде
Выполнение работы. Провести определение эквивалента карбоната натрия по известному эквиваленту диоксида углерода. Наполнить кристаллизатор 1 (рис. 29) на половину его объема насыщенным раствором поваренной соли, в котором растворимость диоксида углерода меньше, чем в воде. Тем же раствором наполнить вровень с краями мерный цилиндр 2 вместимостью 100 мл и закрыть его стеклянной пластинкой, надвигая последнюю скользящим движением. Перевернуть цилиндр вверх дном и опустить в кристаллизатор. Удалить под раствором стеклянную пластинку и закрепить цилиндр в лапке штатива так, чтобы края цилиндра были ниже уровня раствора в кристаллизаторе, следя за тем, чтобы в цилиндр не попал воздух. [c.37]
Природные растворимые соли встречаются в виде солевых залежей или естественных растворов (рассолы, рапы) озер, морей и подземных источников. Основные составляющие солевых залежей или рапы соляных озер хлорид натрия, сульфат натрия, хлориды и сульфаты калия, магния и кальция, соли брома, бора, карбонаты (природная сода). Советский Союз обладает мощными месторождениями ряда природных солей. В СССР имеется более половины разведанных мировых запасов калийных солей (60%) и огромные ресурсы природного и коксового газа для получения азотнокислых и аммиачных солей (азотных удобрений). В СССР есть большое количество соляных озер, рапа которых служит источником для получения солей натрия, магния, кальция, а также соединений брома, бора и др. Основными методами эксплуатацни твердых солевых отложений являются горные разработки в копях и подземное выщелачивание. Добычу соли в копях ведут открытым или подземным способом в зависимости от глубины залегания пласта. Таким путем добывают каменную соль, сульфат натрия (тенардит), природные соли калия и магния (сильвинит, карналлит) и т. д. Подземное выщелачивание является способом добычи солей (главным образом поваренной соли) в виде рассола. Этот метод удобен, когда поваренная соль должна применяться в растворенном виде — для производства кальцинированной соды, хлора и едкого натра и т. п. Подземное выщелачивание ведут, размывая пласт водой, накачиваемой в него через буровые скважины. Естественные рассолы образуются в результате растворения пластов соли подпочвенными водами. Добыча естественных рассолов производится откачиванием через буровые скважины при помощи глубинных насосов или сжатого воздуха (эрлифт). Естественные растворы поваренной соли, используемые как сырье для содовых и хлорных заводов, донасыщают каменной солью в резервуарах-сатураторах и подвергают очистке. Иногда естественные рассолы [c.140]
В зависимости от концентрации едкого натра эта реакция протекает с различной скоростью, причем образуются легко растворимые в воде соли сульфокислот и поваренная соль [c.383]
В настоящее время наибольшее значение имеет способ получения соды методом Сольве. Метод основан на образовании сравнительно трудно растворимого в воде бикарбоната натрия, который может быть получен при взаимодействии поваренной соли с растворимым гидрокарбонатом [c.98]
Концентрация насыщенных растворов чаще всего выражается в граммах вещества на 100 г растворителя. Растворимость при данных условиях в определенном растворителе является важной характеристикой вещества и приводится в химических справочниках. Например, растворимость поваренной соли Na l при 20°С составляет 36 г на 100 г воды, нитрата натрия NaNOj при тех же условиях — 88 г на 100 г воды. Растворимость некоторых соединений приведена в табл. 4. [c.109]
Атмофильные элементы — это кислород, азот, инертные газы (от гелия до ксенона). Гидрофильные элементы образуют соединения, растворимые в воде и поэтому содержащиеся в гидросфере Земли — в морях, океанах, реках, озерах главным образом поваренную соль (т. е. элементы натрий и хлор), соли калия, магния, кальция. Таким образом, часть гидрофильных элементов являются одновременно и литофильными. Это, как правило, элементы, проявляющие в своих соединениях невысокую степень окисления -1-1, +2, реже +3. [c.236]
При увлажнении щихты только водой образовывались очень непрочные гранулы, которые легко разрушались. Известно, что при введении в шихту различных добавок (например, извести, глины) прочность гранул повышается. В наших условиях введение значительных количеств глины нежелательно, так как приводит к снижению температур деформации и плавления шихты. Испытаны различные добавки, повышающие прочность гранул. В качестве увлажняющих растворов применялись растворы соды, поваренной соли, растворимого стекла, серной, фосфорной и кремнефтористоводородной кислот и сульфитно-спиртовой барды. [c.131]
Итак, в водных и неводных растворах одних и тех же исходных соединений взаимодействуют различные вещества, дающие продукты реакции с различными свойствами. Более того, исключительное своеобразие физико-химических свойств воды обусловливает и своеобразие химических свойств растворенных в ней соединений. Куда уж больше оказывается, что реакция между Ag + и С1 в воде приводит к образованию — подумать только — нерастворимого соединения АдС1. И что уж совсем удивительно хлористый натрий, поваренная соль, в воде превосходно растворима [c.82]
При содержании в воде электролитов (солей, кислот, оснований) ее растворяющая способность по отношению к неэлектролитам изменяется иногда она увеличивается, но в большинстве случаев становится меньше. Например, при добавлении к прозрачному раствору желатины обычной поваренной соли происходит помутнение раствора за счет уменьшения растворимости белка. Это явление называют высаливанием, а противоположное ему по эффекту — всаливание м. [c.218]
М. Г. Кучеров позаботился о том, чтобы при массовых анализах аналитики имели дело со спиртовыми жидкостями с одним и тем же содержанием винного спирта. Опытным путем он установил, что при 60%-ном содержании винного спирта, благодаря значительному количеству в нем воды, создаются условия для ограниченной растворимости высших спиртов, входящих в сивушное масло. Прибавлением электролита — насыщенного при комнатной температуре раствора поваренной соли — растворимость сивушного масла могла быть значительно понижена, но при этом нельзя было не считаться с наступлением кристаллизации соли, что мешало бы проведению количественных определений сивушного масла. Снова опытным путем Кучеров показал, что кристаллизации соли никогда не наблюдается при условии смешения одного объема 60%-ного спирта с 3—3,5 объемами насыщенного при 15° С раствора поваренной соли. [c.74]
К физическим методам относится и замещение рас-, творителя в насыщенном растворе. Например, поваренная соль растворима в этиловом спирте, но нерастворима в эфире. Если небольшое количество спиртового раствора соли вылить в большой объем эфира, фактическим растворителем становится эфир (спирт и эфир смешиваются). Полученный раствор соли в эфире пересыщен и образует коллоидный раствор. Аналогично и известное помутнение спиртового раствора мастики при добавлении воды. [c.125]
Из примесей, содержащихся в сыром рассоле, практически наиболее существенное влияние на электролиз оказывают соли кальция и магния. Они попадают в рассол из поваренной соли и из промышленной воды, применяемой для растворения. Абсолютное содержание и соотношение солей кальция и магния зависят как от источника поваренной соли, так и от жесткости местной промышленной воды. К регламентированным примесям рассола относятся также ионы сульфата и нерастворимые взвешенные примеси. Иногда рассол содержит небольшие количества соединений калия, брома, иода и железа, силикаты, хлораты и другие неорганические растворимые примеси. Кроме того, сырой рассол может быть загрязнен взвешенными нерастворимыми частицами глины и мелкого песка, поступающими в рассол из поваренной соли и воды. Соль, получаемая в качестве отхода калийной промышленности, а также каменная соль некоторых месторождений загрязнены органическими примесями. [c.47]
Массы растворенных веществ, приносимые речными водами в моря, ежегодно достигают колоссальных цифр. Так, например, река Дон ежегодно вносит в Азовское море около 16 10 кг растворимых веществ, главным образом, кальциевых, магниевых и натриевых солей. При испарении воды в морях и океанах твердые вещества остаются и накапливаются. Поэтому морская вода содержит значительно большее количество растворенных солей, чем речная. В среднем в 1 л морской воды находится около 35 г растворенных солей поваренной соли 27,0 г, хлорида магния 3,6 г, сульфата магния 2,3 г, сульфата кальция 1,4 г и хлорида калия 0,7 г. [c.625]
Поваренная соль (хлористый натрий) Na l (мол. вес, 58,5). В чистом виде поваренная соль имеет уд. вес 2,16 и представляет собой бесцветные кристаллы. Насыщенный водный раствор содержит 26,4% поваренной соли и имеет уд. вес 1,2 при 20°. Растворимость поваренной соли в воде мало меняется при повышении температуры. [c.66]
Растворимость газов в растворах также иная, чем в чистом растворителе. Например, при 20° С и 1 am 1 г воды растворяет 2,26 см хлора, а в 26-процентном растворе поваренной соли растворимость хлора падает до 0,3 см . Этим пользуются, например, для хранения хлора над водой. [c.146]
Растворимость в системе Na l—HjO приведена на рис. 4-4. Растворимость поваренной соли в воде мало зависит от температуры и давления. В табл. 4-1 и 4-2 приведена растворимость чистой поваренной соли и КС1 в воде при различных температурах. [c.197]
В большой шахтенной печи помещают и раскаляют кварц, а потом пропускают пары поваренной соли и воды образующаяся соляная кислота улетает, а в печи остается кремненатровое соединение (растворимое натровое стекло), которое растворяют В кипящей воде и обрабатывают угольною кислотою, чтобы получить соду и кремнезем. Это объяснял сам г. Госсаж. На выставке стоят образцы стекла и соды, добытых этим способом, и экспонент уверяет, что производство в большом уже виде имело удачу. Трудно, впрочем, думать, чтобы этот способ приготовления соды оказался выгоднее обыкновенного леблановского способа, хотя здесь и бросается в глаза отсутствие потребления серы и приготовления серной кислоты, а также избегается и образование тягостного для заводчиков огромного количества содовых остатков. Сера и серная кислота в этом способе, так сказать, заменяются кремнеземом, находящимся всюду и возобновляющимся при производстве. [c.35]
В большинстве случаев промывка производится путем вытеснения водой маточной жидкости (фильтрата) из слоя осадка. Для обработки растворимых в воде осадков в качестве промывной жидкости применяют разбавленные растворы солей и кислот (поваренной соли, хлористого калия, серной кислоты и др.), а иногда — насыщенный раствор вещества, из которого состоит осадок. [c.285]
Полученные в результате сульфирования ароматические сульфокислоты отделяют от избытка серной кислоть с помощью бариевых солей, так как в отличие от сернокислого бария бариевые соли сульфокислот легко растворимы в воде. Для разделения кислот можно также насытить разбавленный водой сернокислотный раствор поваренной солью, в результате чего натриевые соли сульфокислот выпадут в кристаллическом виде (высаливание). [c.532]
Из растворителей более тяжелых, чем вода, применяются хлористый метилен, хлороформ, четыреххлористый углерод. Для уменьшения растворимости в воде веществ, относительно хорошо в ней растворимых, водные растворы таких соединений насыщают сульфатом аммония или поваренной солью. Такой прием называется высаливанием. [c.41]
Натрий образует соли со всеми кислотами. Почти все они растворимы в воде. Важнейшие соли натрия — хлорид натрия (поваренная соль), сода и сульфат натрия. [c.173]
Насыщенным называется раствор, находящийся в равновесии с растворенным веществом. Иными словами, насыщенный раствор может существовать только в гетерогенный равновесной системе, одной из фаз которой служит растворенное вещество. Это может быть, водный раствор аммиака, находящийся в равновесии с газообразным аммиаком или водный раствор поваренной соли, находящийся в равновесии с твердым хлоридом натрия или в системах с ограниченной, но заметной взаимной растворимостью, два находящихся в контакте раствора на основе каждого из компонентов, как в случае системы эфир—вода или медь—цинк и т. д. При отсутствии равновесия (отсутствии растворенного вещества в отдельной фазе, или невозможности обмена веществом между фазами из-за отсутствия контакта или слишком медленной [c.230]
На рис. 22 представлена графически совместная растворимость в системе Na l—КС1—НгО при 25°. На этой диаграмме точка А соответствует растворимости хлористого калия в воде при 25° (в отсутствие Na l), а точка — растворимости поваренной соли в воде (в отсутствие КС1). Точка С соответствует составу раствора, насыщенного обеими солями. Линия АС показывает изменение состава раствора, насыщенного хлористым калием, при внесении в него различных количеств поваренной соли. Вследствие растворения другой соли с одноименным ионом хлористый калий выпадает в твердую фазу. Аналогично, линия ВС представляет растворы, находящиеся в равновесии с поваренной солью в качестве твердой фазы. Подобные диаграммы равнове- [c.102]
Растворы поваренной соли в воде или канифоли в спирте даже при самом длительном хранении не изменяют дисперсности растворенных частиц они не слипаются и не укрупняются. Но если к спиртовому раствору канифоли прилить немного воды, то отдельные молекулы канифоли начинают объединяться друг с другом, так как в спиртно-водной смеси канифоль плохо растворима. Размеры образовавщихся частиц зависят от количе- [c.14]
Растворы поваренной соли в воде или канифоли в спирте даже при самом длительном хранении не изменяют дисперсности растворенных частиц они не слипаются и не укрупняются. Но если к спиртному раствору канифоли прилить немного воды, то отдельные молекулы канифоли начинают объединяться друг с другом, так как в спиртно-водной смеси канифоль плохо растворима. Размеры образовавшихся частиц зависят от количества прилитой воды, и полученная система может быть коллоидной или даже типа суспензии. [c.13]
Растворимость поваренной соли в воде относительно мало зависит от температуры (табл. 1) при 0°С насыщенный раствор содержит 26,3% Na l, а при 100°С —28,25% (табл. 2). Насыщенный раствор кипит под атмосферным давлением прн 108,7 °С и содержит 28,41 % Na l. [c.11]
Древнеримский ученый Плиний Старший (I в. н. э.) в Естественной истории в 37 книгах писал …существует своеобразный факт, что, если ввести в 5 весовых частей воды больше одной весовой части соли (поваренной), растворяющее действие воды будет истрачено и больше соли уже не растворится . Рассчитайте коэффициент растворимости и процентную концентрацию соли по данным Плиния и сравните с значениями, найденными по рисунку 3. [c.22]
Зависимость растворимости от температуры. Растворимость большинства твердых веществ с повышением температуры увеличивается, причем у некоторых веществ это увеличение растворимости весьма значительное (например, растворимость калийной селитры KNO3 в воде при 100° примерно в 8 раз больше, чем при 20°), а у других веществ — незначительное (наиример, растворимость поваренной соли в воде при 100° всего [c.58]
Выполнение работы. Приготовить насыщенный раствор хлорида натрия. Отвесить на техно-химических весах 40 г поваренной соли, растереть ее в ступке и высыпать в стакан. Добавив 100 мл дистиллированной воды, поставить стакан на кольцо штатива на асбестированную сетку. Нагреть раствор до кипения и профильтровать его через складчатый фильтр (см. рис. 23) в чистый стакан. Отмерить мензуркой 50 мл концентрированной хлорово-дор )дной 1 ислоты (плотностью 1,19 г/см ). Стакан с теплым насыщенным раствором поваренной соли перенести в вытяжной шкаф и медленно небольшими порциями добавлять в него концентрированную хлороводородную кислоту при непрерывном перемешивании стеклянной палочкой. После охлаждения раствора до комнатной температуры отфильтровать выпавшие кристаллы на воронке -Бюхнера, перенести их в фарфоровую чашку и высушить в сушильном шкафу при 110°С. Описать проделанную работу, Отметить понижение растворимости хлорида натрия при добавлении концентрированной хлороводородной кислоты. Окажет ли такое же действие пропускание газообразного хлористого водорода в насыщенный раствор хлорида натрия [c.27]
При выпаривании данного раствора вначале выкристаллизовывается хлористый натрий, как менее растворимое по сравнению со щелочью вещество, и остается почти чистый раствор NaOH. Этот раствор сливают с поваренной соли и воду выпаривают. Полученный твердый едкий натр сплавляют и отливак)т в формы. [c.418]
Наш эксперимент не закончен. Нагреем раствор на спиртовке или электрической плитке. (Химическую посуду можно нагревать на открытом пламени, потому что она изготовлена из тонного стекла. Обычный граненый толстостенный стакан может треснуть при нагревании). Не растворявшаяся ранее соль при нагревании растворилась. Наблюдения можно прокомментировать следующим образом при нагревании растворимость некоторых твердых веществ увеличивается. Изучая зависимость концентрации насыщенных растворов от температуры, можно построить графики (Рис. 6.2.). Теперь, если мы оставим охлаждаться насыщенный при более высокой температуре раствор поваренной соли, то увидим, что в растворе появится осадок. Из насыщенного при 100°С раствора Na l может осадиться 5 г соли при охлаждении до 10°С, если исходный раствор был приготовлен в 100 г воды. Объяснить этот факт просто. При охлаждении данного насыщенного раствора выпадает осадок растворенного вещества, так как при понижении темпера 1уры растворимость некоторых [c.109]
До М. В. Ломоносова термин растворение понимали в самом широком смысле. Сюда включали и переход серебра при действии азотной кислоты в AgNOз, песка в присутствии щелочи в растворимое стекло, а также распущение смолы в спирте, сахара или поваренной соли в воде. Между тем различия этих процессов весьма существенны. Если, например, при действии на цинк соляной кислоты происходит вскипание (вы-деление газов), выделение тепла и образование нового вещества 4 2пСЬ, то ничего подобного не наблюдается при растворении са- хара в воде. М. В. Ломоносов впервые еще в 1747 г. ясно разграничил эти явления. К одной категории растворов М. В. Ломоносов относит растворы , например металлов в кислоте (т. е. явно химические превращения), проходящие, как правило, с выделением тепла. К другой категории он причисляет растворы солей, при образовании которых происходит поглощение тепла. Такое деление растворов по отличительным признакам химических и физических процессов имело большое научное значение. Спустя много лет после М. В. Ломоносова к тем же взглядам на процессы растворения пришли А. Лавуазье, Я. Берцелиус, В. Томсон и др. [c.17]
По условиям процесса электролиза содержание Na l в рассоле должно быть не менее 310 г/л, т. е. очень близким к пределу растворимости. Высокая растворимость поваренной соли в воде даже при низких температурах значительно облегчает получение больших количеств концентрированных рассолов (более 10 на I т вырабатываемого хлора). В связи с этим [c.78]
При очистке веществ белково-пептидной природы (в частности, ферментов), которые растворимы лишь в воде и водных растворах, нередко используют приемы, основанные на уменьшении их растворимости при прибавлении к водным растворам солей или смешивающихся с водой органических растворителей. Увеличивая концентрацию соли (например, сернокислого аммония или поваренной соли) в воде, можно осадить те или иные из растворенных веществ. Таким путем удается значительно очистить ферменты от сопровождающих веществ, так как нередко изучаемое вещество осаждается при другой концентрации соли, чем примеси (дробное осаждение). Повторяя такой процесс с небольшими модификациями (осаждение при разных значениях pH и при различной концентрации солей), обычно удается получить концентраты фермента (или другого биорегулятора) высокой степени очистки, но содержащие значительные примеси солей. Последние удаляют посредством диализа (при котором низкомолекулярные вещества проходят через полупроницаемую пленку, например из целлофана, и удаляются, а высокомолекулярные остаются) или путем гельхроматографии (в последнее время), что значите, ьно быстрее. [c.21]
Хлор хорошо растворим в воде при 10° и 760 мм рт. сг. в I л воды растворяется 9,65 г хлора при повышении температуры растворимость его понижается (при 20° — 7,25 г/л, а при 100° — 2,6 г/л). В насыщенном растворе поваренной соли растворимость хлора невелика в 1 л концентрированного водного раствора поваренной соли (297,5 г/л Na l) при 20° растворяется 1,86 г, при 40°—1,05 г при 60° — 0,54 г. [c.566]
Рассчитать предельную плотность локального тока коррозионной пары медь — цинк (площадь катодных участков равна площади анодных участков) в 3%-ном растворе поваренной соли при 293,2 К. Коэффициент диффузии кислорода принять равным 1,95-10- см2-с . Растворимость кислорода воздуха в воде при 293,2 К 6,36 см -л , растворимость кислорода в 3%-ном растворе Na l составляет 85% от его растворимости в чистой воде. Эффективную толщину диффузионного слоя принять равной 0,075 см (среднее ее значение для электролита в спокойном состоянии). [c.112]
Белки чрезвычайно разнообразны. При переходе от одного белка к другому не только и зменяется качественный и количественный аминокислотный состав, но наблюдаются также большие различия в ф изико-химических свойствах. Многие белки, подобно альбуминам, образуют в воде коллоидные растворы другие, например глобулины, не растворяются в воде, но растворимы в растворах нейтральных солей (поваренная соль и др.) кератин, эластин, фиброин и аналогичные им белки характеризуются полной нерастворимостью. Между белками, образующими коллоидные растворы, в свою очередь, существуют различия в отношении способности к высаливанию и осаждению. Эти различия в растворимости используются для разделения белков наряду с описанными [c.395]
Возьмем широкую стеклянную трубку, нижний конецпергаментной бумаги, так чтобы наливаемый в сосуд раствор не вытекал через место соприкосновения пленки и стенки цилиндра. Нальем в цилиндр-раствор поваренной соли и сахара. Погрузим цилиндр с раствором в большой сосуд с водой. Через некоторое время можно обнаружить, что вкус раствора и вкус воды изменится. Произошло разделение растворенных веществ это явление называется диализом. Нарисуйте схему процесса. Укажите, какое вещество перешло в воду и какое осталось в растворе. Попытайтесь объяснить это явление. Предскажите, как будут вести себя следующие растворы 1) СН3СООН и сахар, 2) глицерин и сахар, 3) сахар и ЫаОН, 4) сахар и фенол, 5) растворимое-стекло и сахар. [c.63]
Так, поваренная соль вредно действует на бетон главным образом потому, что в водных растворах Na l растворимость Са(0Н)2 значительно выше, чем в чистой воде поэтому ускоряется коррозия первого вида. По этой же причине хлоркалиевые минеральные удобрения являются агрессивным по отношению к бетону. [c.188]
NaHjP04, полученная в результате действия НзРО на смесь исходных солей, к сожалению, нецелесообразно использовать как удобрение, так как она очень хорошо растворима в воде и не будет удерживаться е почве, однако обработка этой соли раствором хлористого кальция даст раствор поваренной соли и осадок двойного суперфосфата [c.447]
Для перевода сульфидов металлов в растворимые соединения можно применять и хлорирующий обжиг. Наиболее дешевым хлорирующим агентом является хлорид натрия. Смесь сульфидной руды и поваренной соли подвергают действию воздуха при 550—600 С. При этом образуется диоксид серы, который, взаимодействуя с Na l в присутствии паров воды, дает хлор и хлороводород. Эти газы, вступая в реакции с сульфидами и оксидами металлов, превращают их в хлориды. Другими хлорирующими агентами могут быть НС1, Nh5 I, I2. [c.339]
ВОДА КАК РАСТВОРИТЕЛЬ. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ ИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ
ВОДА КАК РАСТВОРИТЕЛЬ. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ ИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ
Мойсеева Д.Д. 1
1
Егорова Т.Ю. 1
1
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Научно-исследовательская работа
Вода как растворитель.
Выращивание кристаллов из водных растворов солей
Выполнила:
Мойсеева Дарья Денисовна
учащаяся 5 класса
МБОУ «СОШ № 8 г. Выборга»
Руководитель:
Егорова Татьяна Юрьевна
учитель химии МБОУ «СОШ № 8 г. Выборга»
Оглавление
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Введение
Растворы играют важную роль в природе, науке и технике. Вода, столь широко распространенная в природе, всегда содержит растворенные вещества. В пресной воде рек и озер их мало, в то время как в морской воде содержится около 3,5% растворенных веществ. Человек употребляет для питья воду, содержащую от 0,02 до 2 граммов минеральных веществ в 1 литре. Большое значение имеют вещества, находящиеся в малых дозах, но играющие важную роль во многих физиологических процессах организма.
Проблема: вода, широко распространена в природе, всегда содержит растворенные вещества.
Гипотеза: вода – хороший растворитель солей для получения различных растворов и выращивания кристаллов.
Мы решили приготовить водные растворы разных солей и вырастить из них кристаллы.
Актуальность работы: роль растворов в природе, науке и технике.
Цель работы: исследование процесса растворения и кристаллизации солей на примере выращивания кристаллов солей из их водных растворов.
Задачи:
-
Изучить общие сведения о воде как растворителе, используя литературные источники. -
Приготовить водные растворы солей и вырастить из них кристаллы. -
Провести наблюдение за процессами растворения и кристаллизации. -
Проанализировать результаты исследований.
Методы исследования:
-
Работа с источниками информации. Теоретические исследования. -
Экспериментальные методы. -
Наблюдение и фотографирование. -
Анализ полученных результатов.
1. Литературный обзор. Основные сведения о кристаллизации из водных растворов 1.1. Растворимость веществ в воде
Вода является универсальным растворителем значительного количества веществ, в связи с чем в природе химически чистой воды нет. В первичном океане массовая доля солей, по предположениям, была низка, около 1%.
«Именно в этом растворе впервые зародились живые организмы» — так оценивает роль растворов в возникновении и развитии жизни на Земле известный американский химик, лауреат Нобелевской премии Лайнус Полинг. (Приложение1 рис.1)
Внутри нас, в каждой нашей клеточке – воспоминание о первичном океане, в котором зародилась жизнь, — водном растворе, обеспечивающем саму жизнь. В каждом живом организме бесконечно течёт по сосудам – артериям, венам и капиллярам – волшебный раствор, составляющий основу крови, массовая доля солей в нём такая же, как в первичном океане, — 0,9%. Сложные процессы, происходящие в организмах человека и животных, также протекают в растворах. Усвоение пищи связано с переводом питательных веществ в раствор. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Воду, содержащую значительное количество солей кальция и магния, называют жесткой в отличие от мягкой воды, например, дождевой. Жесткая вода дает мало пены с мылом, а на стенках и спирали чайников при её кипячении образуется накипь. Жесткость воды зависит от количества растворенных в ней солей. Многие технологические процессы в разных отраслях промышленности протекают в растворах. Растворимость веществ в воде зависит от температуры. Как правило, растворимость твёрдых веществ в воде увеличивается с повышением температуры. (Приложение 1 рис. 2). Вещество считают хорошо растворимым, если при комнатной температуре в 100 г воды растворяется больше 1 г этого вещества. 1.Совершенно нерастворимых веществ в природе не существует.
1.2. Кристаллизация из водных растворов солей
Кристаллизация – от греческого — лёд – процесс образования кристаллов из газов, расплавов, растворов. 4
В самом солёном из морей мира – Мёртвом море – концентрация солей так велика, что на любом помещённом воду этого моря предмете нарастают причудливые кристаллы. Мгновенная кристаллизация вещества происходит из пересыщенного раствора. Пересыщенным называют такой раствор, в котором при данной температуре находится в растворённом состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. 1 Из некоторых веществ легко получить пересыщенные растворы. Например, глауберова соль и медный купорос. Приготовить пересыщенный раствор соли можно следующим способом. При высокой температуре воды (близкой к кипению) приготовить насыщенный раствор соли. 5. Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется 1. Затем избыток соли нужно отфильтровать и медленно охладить при комнатной температуре. Если в такой пересыщенный раствор нести стеклянную палочку, на кончике которой имеется несколько крупинок этой соли, — немедленно начнётся её кристаллизация из раствора. 5.
1.3. История изучения кристаллов в России
Одним из основоположников учения о кристаллах в России был ближайший преемник М.В. Ломоносова по кафедре химии Петербургской Академии наук — Товий Егорович Ловиц (1757-1804гг). (Приложение 1, рис 3).
Исключительно ценными оказались результаты исследований учёного в области кристаллизации. Т.Е. Ловиц применил процесс перекристаллизации растворенных веществ в фармацевтических опытах, широко используя этот метод для очистки веществ. Вместе с тем он внёс важный вклад в теорию процессов кристаллизации. Т.Е. Ловиц различал два вида кристаллизации – принудительную (при выпаривании раствора) и самопроизвольную (при переохлаждении) – и установил, что состав кристаллов в обоих случаях может быть различным. Он описал метод зародышивания при инициировании процесса кристаллизации. Вместе с тем, он разработал условия получения кристаллов правильной формы, а также кристаллов большого размера, применяя медленную кристаллизацию из теплых растворов. Т.Е. Ловиц был первым учёным, систематизировавшим кристаллы. Он лично изготовил восковые модели 288 форм кристаллов. [3] Т.Е. Ловиц разработал также метод качественного микрохимического анализа, кристаллизуя вещества из капли раствора и рассматривая получившиеся кристаллы под микроскопом. 3. Если взять каплю насыщенного раствора обычной поваренной соли, поместить ее на предметное стекло, поднести к микроскопу, подождать, когда лишняя вода испарится, то можно рассмотреть получившиеся кристаллы.
Наш эксперимент – приготовить водные растворы разных солей и вырастить из них кристаллы, наблюдая за их ростом.
2. Практическая часть. Выращивание кристаллов из водных растворов солей
Обычная поваренная соль, которой мы каждый день пользуемся на кухне, имеет химическое название – хлорид натрия. Эта соль белого цвета. Есть ещё цветные соли.
2.1. Ознакомление с образцами солей для выращивания кристаллов
Результат ознакомления с солями изложен в виде таблицы
Таблица 1. Свойства солей
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Приложение 2, фото 4-6).
Поваренная соль – химическая формула NaCl (хлорид натрия)
Медный купорос — химическая формула CuSO4∙5Н2О (сульфат меди пятиводный).
Железный купорос – FeSO4∙7Н2О (сульфат железа семиводный)
Вывод: рассматриваемые соли – рассыпчатые кристаллические вещества, которые отличаются цветом.
2.2. Приготовление насыщенных растворов солей
Для приготовления раствор, необходимо навеску соли растворить в воде. Какую воду лучше взять для приготовления раствора: холодную или горячую?
Существует гипотеза: соль лучше растворяется в горячей воде.
Провела небольшой опыт. (Приложение 2, фото 7).
Цель опыта: сравнить растворимость соли при разной температуре растворителя (воды).
Сырье: поваренная соль, медный купорос, железный купорос.
Ход работы: в две одинаковые пробирки я насыпала по 0,5 г соли (объем приблизительно со спичечную головку). Налила в первую пробирку 1 мл холодной воды (примерно 10 капель). Налила во вторую пробирку 1 мл горячей воды. Наблюдала за процессом растворения в течение 1-й минуты.
Результат опыта зафиксирован в таблице
Таблица 3.Зависимость растворимости соли от температуры воды
|
|
| |
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
Гипотеза подтвердилась: в горячей воде легче приготовить сильно-концентрированный раствор, так как соль растворяется быстрее, чем в холодной.
Исследование процесса растворения отражено в таблице
Таблица 4. Наблюдение за процессом растворения
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Результат: в 100 мл воды растворилось:
поваренной соли – 50 г,
медного купороса – 65 г,
железного купороса –140 г.
В горячей чистой воде (кипяток не нужен, 70-80 ˚C) растворяем порошок медного купороса с расчетом 100-150 г медного купороса на 200 мл воды. Перемешиваем раствор палочкой до тех пор, пока купорос не перестанет растворяться в воде.
В определённый момент раствор может настолько насытиться солью, что превратится в «насыщенный» раствор. Раствор может быть ненасыщенным (это явление наблюдалось в начале приготовления раствора) и насыщенным (это явление я обнаружила в конце процесса растворения).
Результат: получены насыщенные растворы солей. (Приложение 2, фото 8).
Для чистоты эксперимента растворы нужно фильтровать.
Исследование процесса фильтрования отражено в таблице
Таблица 5. Наблюдение за процессом фильтрования
|
|
|
|
|
|
Фильтрование необходимо для того, чтобы избавиться от примесей, присутствующих в рабочих образцах солей.
Результат: получен чистый фильтрат. (Приложение 2, фото 9-10).
Нужно вырастить затравку для будущего кристалла.
Затравка – это небольшой кристалл (размером чуть меньше горошины), который опускается в подготовленный раствор. Для затравки добавили в полученный фильтрат несколько маленьких кристалликов соли – это центры кристаллизации, вокруг которых будут расти кристаллы.
Рабочие растворы оставили на один день.
2.3. Подготовка затравки
На следующий день на дне химических стаканов образовались кристаллы. (Приложение 3, фото 11-12). Кристаллы высыпала в чашку Петри, выбрала по одному кристаллику разной соли, которые послужат затравками для выращивания кристаллов. (Приложение 3, фото 13).
Взяла карандаш и привязала к нему леску такой длины, чтобы она погрузилась в раствор. К свободному концу лески аккуратно подвязала кристалл. Карандаш закрепила в бумажной самодельной крышке. В три одинаковых стакана с насыщенными растворами №1, 2, 3 опустила по кристаллику на леске и накрыла их крышечками, чтобы не попадала пыль и оставила растворы медленно испаряться. (Приложение 3, фото 14-15).
2.4. Выращивание кристаллов
В течение 25 дней вела наблюдения за состоянием кристаллов, периодически освежая и фильтруя растворы. Образцы находились в одинаковых условиях и содержались при комнатной температуре.
В ходе работы со всех образцов периодически снимались размеры. (Приложение 3, фото 16-17.Приложение 4, фото 18-21).
Таблица 6. Наблюдение за ростом кристаллов
|
|
| ||
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В ходе наблюдений замечено, что кристаллизация начинается при понижении температуры раствора. При этом практически мгновенно возникает множество мелких кристалликов. Кристаллизация начинается у стенок и дна стакана, а затем распространяется на помещенный в раствор кристалл-затравку, который растет, увеличиваясь в размерах, рост граней происходит послойно.
По мере остывания раствора (ближайший час) в стакане резко повышается концентрация соли, т.к. при более низкой температуре в воде растворяется гораздо меньше вещества и лишнее вещество, образующееся при остывании, выпадает в осадок в виде кристаллов. По мере остывания все «лишнее» при данной температуре вещество переходит в твердую фазу, выстраивая кристаллическую структуру в очаге кристаллизации – на леске. В итоге на леске образуется много маленьких кристаллов, которые все новыми слоями наращиваются друг на друга, образуя красивое поликристаллическое тело. Кристаллы образуются не только на леске, но еще на дне и стенках банки. Это вредит нашим целям, т.к. эти кристаллы будут также отбирать из жидкости материал для собственного строительства и нашему основному кристаллу на леске достанется меньше материала для роста и, следовательно, он будет расти гораздо медленнее. За неделю может вырасти кристалл длинной 1 см, за 3-4 недели – 3-4 см. (Приложение 4, фото 22-23).
Если в стакане образуется осадок мелких кристалликов, надо переливать раствор в чистый стакан и помещать в него кристалл. При прикосновении растущих кристаллов их правильная форма может нарушиться, поэтому раствор надо чаще фильтровать.
Чтобы увеличить скорость роста кристалла, нужно обновлять рабочий раствор. Для поддержания уровня раствора в стакане необходимо доливать свежий раствор соли. Рост кристалла происходит за счет соли, растворенной в воде.
Со временем на нитке тоже образуются мелкие кристаллики, которые начинают расти. Избежать этого сложно, разве что можно поднять кристалл повыше, чтобы меньший отрезок нитки контактировал с раствором. Когда концентрация соли в растворе становится ниже, то рост кристалла замедляется.
Вывод: в свежеприготовленном фильтрованном растворе кристалл растет быстрее и имеет более правильную геометрическую форму.
Работа проведена — кристаллы выращены, их нужно сохранить так, чтобы в них не попали примеси. Многие вещества, например, кристаллы сахара, активно поглощают из воздуха пары воды. Чтобы защитить кристаллы от влаги их надо покрыть несколькими слоями прозрачного лака для ногтей.
Заключение
Временной результат моей работы – кристаллы росли 25 дней. В ходе работы я узнала много новой, интересной и полезной информации.
Гипотеза подтвердилась – вода, действительно, хороший растворитель солей для получения различных растворов и выращивания кристаллов. Не все вещества имеют одинаковую растворимость в воде например, растворимость сульфата меди (II) в воде при 20 С. составляет 22,2 г/100 г воды. Данное вещество можно считать хорошо растворимым. Растворимость зависит от температуры воды. Какие-то вещества растворяются лучше, какие-то хуже. Но полностью нерастворимых веществ в природе, оказывается, нет. Даже физико-химические процессы, происходящие в нашем организме, протекают в среде растворов. Многие природные и технологические процессы происходят в растворах. Растворы бывают ненасыщенными, насыщенными и пересыщенными.
В практической части работы приготовлены растворы солей: поваренной соли, медного и железного купоросов. Из полученных насыщенных растворов солей выращены кристаллы (Приложение 4, фото 24-25). Можно вырастить поли- и монокристаллы. Кристаллизация используется для получения веществ в чистом виде, выделения кристаллов заданного размера, при получении концентрированных непищевых продуктов.
На будущий год планируем вырастить многоцветные кристаллы алюмокалиевых (бесцветные) и хромовых (фиолетовые) квасцов.
Выводы:
-
На основе изучения литературных источников и практических опытов можно сделать вывод, что вода – хороший растворитель. Образцы всех солей, использованных в работе, являются хорошо растворимыми, так как при комнатной температуре в 100 г воды растворяется больше 1 г соли. -
Для приготовления водных растворов солей необходимо использовать горячую воду и навеску соли. Оптимальная температура воды при растворении медного купороса для выращивания кристалла — 80С. В практической части работы опытным путём установлено, что в 100 мл горячей воды для получения насыщенного раствора соли, можно растворить поваренной соли – 50г, медного купороса – 65г, железного купороса – 140г. При этом, на дне емкости должен остаться нерастворимый осадок соли. -
В практической части работы использован способ, основанный на свойстве кристаллических веществ — выращивание кристаллов из растворов. Кристаллизация – это физико-химический процесс, который широко используется в природе и человечеством. Кристалл растет потому, что вода из насыщенного раствора постепенно испаряется, а кристаллическое вещество переходит из жидкого состояния в твердое. -
В ходе работы проведены опыты и наблюдения с фиксацией полученных сведений в рабочую тетрадь. В работе проводились наблюдения за динамикой роста кристаллов разных солей для наблюдения динамики роста в одинаковых условиях содержания. Проведенный практикум показал, что кристаллы разных солей растут по-разному и имеют разную геометрическую форму. Например, кристалл поваренной соли имеет форму куба.
Список литературы
-
Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учреждений – М.: Дрофа, 2013 – 267с -
Журин А.А., Зазнобина Л.С. Начала химического эксперимента: Практические занятия по химии. 8-й класс сред. общеобразоват. школы. –М.: Школьная Пресса, 2001 – 128 с. -
Крицман В.А. Книга для чтения по неорганической химии. Пособие для учащихся. – М.: Просвещение, 2004 – 303с. -
Ушаков Д.Н. Большой толковый словарь современного русского языка. – М.: Роосса, 2008 – 1247с. -
Электронный ресурс: статья Кристаллизация на dic.academic.ru. -
Электронный ресурс: Словари и энциклопедии на Академике. dic.academic.ru.
Приложения
Приложение 1
Рис. 1 Портрет Лайнуса Полинга. Фото с сайта biopeoples.ru
Рис.2. График растворимости солей в зависимости от температуры растворителя.
Рис.3. Портрет Т.Е. Ловица. Фото с сайта ponipro.ru.
Приложение 2
Фото 4-6. Свойства солей. Фото автора.
Фото 7. Опыт: растворимость соли в зависимости от температуры растворителя. Фото автора.
Фото 8. Насыщенный раствор соли. Фото автора.
Фото 9-10. Процесс фильтрования. Фото автора.
Приложение 3
Фото 11-12. Кристаллы на дне химического стакана. Фото автора.
Фото 13. Образцы для затравки в чашке Петри. Фото автора.
Фото 14-15. Кристаллы в растворах. Фото автора.
Фото 16-17. Замеры образца №1. Фото автора.
Приложение 4
Фото 18-19. Замеры образца №2. Фото автора.
Фото 20-21. Замеры образца №3. Фото автора.
Фото 22. Рост кристаллов в растворе через 1 неделю. Фото автора.
Фото 23. Рост кристаллов в растворе через 4 недели. Фото автора.
Фото 24-25. Выращенные кристаллы. Фото автора.
Просмотров работы: 778
Иванова Ирина Викторовна | Официальный сайт МОУ СОШ №14
Это интересно!!!
Домашний эксперимент.
Выращивание кристаллов в домашних условиях
Как вырастить кристалл
Выращивание кристаллов в домашних условиях.Что нужно знать?
Выращивание кристаллов — процесс очень интересный, но бывет достаточно длительным. Полезно знать, какие процессы управляют его ростом; почему разные вещества образуют кристаллы различной формы, а некоторые их вовсе не образуют; что надо сделать, чтобы они получились большими и красивыми.
Если кристаллизация идёт очень медленно, получается один большой кристалл (или монокристалл, например при выращивании искусственных камней), если быстро — то множество мелких (или поликристалл, например металлы).
Выращивание кристаллов в домашних условиях производят разными способами. Например, охлаждая насыщенный раствор. С понижением температуры растворимость веществ уменьшается и они, как говорят, выпадают в осадок. Сначала в растворе и на стенках сосуда появляются крошечные кристаллы-зародыши. Когда охлаждение медленное, а в растворе нет твёрдых примесей (скажем, пыли), зародышей образуется немного, и постепенно они превращаются в красивые кристаллики правильной формы. При быстром охлаждении возникает много мелких кристалликов, почти никакой из них не имеет правильную форму, ведь их растёт множество и они мешают друг другу.
Выращивание кристаллов можно осуществить и другим способом — постепенным удалением воды из насыщенного раствора. И в этом случае чем медленнее удаляется вода, тем лучше получается результат. Оставьте открытым сосуд с раствором при комнатной температуре на длительный срок, накрыв его листом бумаги, — вода при этом будет испаряться медленно, и пыль в раствор попадать не будет. Растущий кристаллик можно либо подвесить в насыщенном растворе на тонкой прочной нитке, либо положить на дно сосуда. В последнем случае кристаллик периодически надо поворачивать на другой бок. По мере испарения воды в сосуд следует подливать свежий раствор. Даже если нащ исходный кристаллик имел неправильную форму, он рано или поздно сам выправит все свои дефекты и примет форму, свойственную данному веществу, например превратится в октаэдр, если используете соль хромокалиевых квасцов, ромб — если используете медный купорос.
Выращивание кристаллов — процес занимательный, но требующий бережного и осторожного отношения к своей работе. Теоретически размер кристалла, который можно вырастить в домашних условиях таким способом, неограничен. Известны случаи, когда энтузиасты получали кристаллы такой величины, что поднять их могли только с помощью товарищей.
Но к сожалению есть некоторые особенности их хранения (конечно каждая соль и вещество имеют свои особенности). Например, если кристаллик квасцов оставить открытым в сухом воздухе, он, постепенно теряя содержащуюся в нём воду, превратится в невзрачный серый порошок. Чтобы предохранить его от разрушения, можно покрыть бесцветным лаком. Медный купорос и поваренная соль — более стойки и вы смело можете с ними работать.
Как вырастить кристалл
Вырастить кристалл можно из разных веществ: например из сахара, даже каменные — искусственное выращивание камней, с соблюдением строгих правил по температуре, давлению, влажности и других факторов (искусственые рубины, аметисты, кварц).
В домашних условиях, конечно, всего этого у нас не получится, поэтому поступим другим образом. Будем выращивать кристаллы соли. У всех у нас есть дома обычная пищевая соль (как наверное, занете, что её химическое название хлорид натрия NaCl). Подойдёт и любая другая соль (соль — с химической точки зрения), например, можно получить красивые синие кристаллы из медного купороса или или любого другого купороса (например железного). Можно использовать квасцы (двойные соли металлов серной кислоты), тиосульфата натрия (раньше использовался для изготовления фотографий). Для всех этих солей (да и вообще для соли) не требуется особых каких-то условий: сделали раствор, опустили туда «зародыш» (всё это подробно описано ниже) и растёт он себе, каждый день прибавляя в росте.
Да, не следует раскрашивать раствор, где растёт Ваш кристалл, например красками или чем нибудь подобным, — это лишь испортить сам раствор, а кристалл всё же не покрасит! Лучший способ получить цветные кристаллы — это подобрать нужную по цвету соль! Но будьте внимательными: например кристаллы жёлтой кровяной соли имеют красно-оранжевый цвет, а раствор получается жёлтым.
Вот теперь можем приступить!
Выращивание кристаллов поваренной соли
Кристаллы поваренной соли — процесс выращивания не требует наличия каких-то особых химических препаратов. У нас всех есть пищевая соль (или поваренная соль), которую мы принимаем в пищу. Её также можно назвать и каменной — всё одно и то же. Кристаллы поваренной соли NaCl представляют собой бесцветные прозрачные кубики. Начнём. Разведите раствор поваренной соли следующим образом: налейте воды в ёмкость (например стакан) и поставьте его в кастрюлю с тёплой водой (не более 50°С — 60°С). Конечно, в идеальном варианте, если вода не будет содержать растворённых солей (т.е. дистиллированная), но в нашем случаем можно воспользоваться и водопроводной. Насыпьте пищевую соль в стакан и оставьте минут на 5, предварительно помешав. За это время стакан с водой нагреется, а соль растворится. Желательно, чтобы температура воды пока не снижалась. Затем добавьте ещё соль и снова перемешайте. Повторяйте это до тех пор, пока соль уже не будет растворяться и будет оседать на дно стакана. Мы получили насыщенный раствор соли. Перелейте его в чистую ёмкость такого же объёма, избавившись при этом от излишек соли на дне. Выберите любой понравившийся более крупный кристаллик поваренной соли и положите его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана. Теперь нужно подождать. Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться. А если проделать всё то же ещё раз (приготовить насыщенный раствор соли и опустить в него этот кристаллик), то он будет расти гораздо быстрее (извлеките кристаллик и используйте уже приготовленный раствор, добавляя в него воды и необходимую порцию пищевой соли). Помните, что раствор должен быть насыщенным, то есть при приготовлении раствора на дне стакана всегда должна оставаться соль (на всякий случай). Для сведений: в 100г воды при температуре 20°С может раствориться приблизительно 35г поваренной соли. С повышением температуры растворимость соли растёт.
Так выращивают кристаллы поваренной соли (или кристаллы соли, форма и цвет которых Вам больше нравится)
Выращивание кристаллов медного купороса
Кристаллы медного купороса — выращиваются подобным образом, также, как с поваренной солью: cначала готовится насыщенный раствор соли, затем в этот раствор опускается понравившийся маленький кристаллик соли медного купороса.
Внимание! Медный купорос- — химически активная соль! Поэтому для удачности опыта в этом случае воду нужно взять дистиллированную, т.е. не содержащую других растворённых в ней солей. Из-под крана воду тоже лучше не брать, так как она, во-первых, содержит растворённые соли, во-вторых, может быть сильно хлорированной. Примеси (особенно карбонаты в жёсткой вроде) вступают в химические реакции с медным купоросом, из-за чего раствор сильно портится.
Если всё в порядке — продолжим. Если вы решили не переливать раствор из ёмкости, в которой первоначально рос маленький кристаллик, тогда подвесьте кристаллик, чтобы он не касался других кристалликов, оставшихся на дне!
Выращивание кристаллов производят не только из растворов, но и из расплавов соли. Ярким примером могут служить жёлтые непрозрачные кристаллы серы, имеющие форму ромба или вытянутых призм. Но с серой, особо, работать не советую. Газ, образующийся при её испарении, вреден для здоровья.
Можно избежать роста отдельных граней кристаллика. Для этого эти грани надо нанести раствор вазелина или жира.
Итак, процесс выращивания кристаллов в домашних условиях разделим на основные этапы:
Этап 1: Растворить соль, из которой будет расти кристалл, в подогретой воде (подогреть нужно для того, чтобы соль растворилось немного больше, чем может раствориться при комнатной температуре). Растворять соль до тех пор, пока будете уверены, что соль уже больше не растворяется (раствор насыщен!). Рекомендую использовать дистиллированную воду (т.е. не содержащую примесей других солей)
Этап 2: Насыщенный раствор перелить в другую ёмкость, где можно производить выращивание кристаллов (с учётом того, что он будет увеличиваться). На этом этапе следите, чтобы раствор не особо остывал.
Этап 3: Привяжите на нитку кристаллик соли, нитку привяжите например к спичке и положите спичку на края стакана (ёмкости), где налит насыщенный раствор (этап 3). Кристаллик опустите в насыщенные раствор.
Этап 4: Перенесите ёмкость с насыщенным раствором и кристалликом в место, где нет сквозняков, вибрации и сильного света (выращивание кристаллов требует соблюдение этих условий).
Этап 5: Накройте чем-нибудь сверху ёмкость с кристалликом (например бумагой) от попадания пыли и мусора. Оставьте раствор на пару дней.
Важно помнить!
1. Кристаллик нельзя при росте без особой причины вынимать из раствора
2. Не допускать попадание мусора в насыщенный раствор, наиболее предпочтительно использовать дистиллированную воду
3. Следить за уровнем насыщенного раствора, периодически (раз в неделю или две) обновлять при испарении раствор.
Объявляется конкурс на лучший кристалл!
Как замерзают растворы. Движение. Теплота
Как замерзают растворы
Если охладить раствор какой-либо соли в воде, то обнаружится, что температура замерзания понизилась. Нуль градусов пройден, а затвердевание не происходит. Только при температуре на несколько градусов ниже нуля в жидкости появятся кристаллики. Это кристаллики чистого льда, в твердом льде соль не растворяется.
Температура замерзания зависит от концентрации раствора. Увеличивая концентрацию раствора, мы будем уменьшать температуру кристаллизации. Самую низкую температуру замерзания имеет насыщенный раствор. Понижение температуры замерзания раствора совсем не малое: так, насыщенный раствор поваренной соли в воде замерзнет при ?21 °C. При помощи других солей можно добиться еще большего понижения температуры; хлористый кальций, например, позволяет довести температуру затвердевания раствора до ?55 °C.
Рассмотрим теперь, как идет процесс замерзания. После того как из раствора выпадут первые кристаллики льда, крепость раствора увеличится. Теперь относительное число чужих молекул возрастет, помехи процессу кристаллизации воды также увеличатся, и температура замерзания упадет. Если не понижать температуру далее, то кристаллизация остановится. При дальнейшем понижении температуры кристаллики воды (растворителя) продолжают выделяться. Наконец, раствор становится насыщенным. Дальнейшее обогащение раствора растворенным веществом становится невозможным, и раствор застывает сразу, причем если рассмотреть в микроскоп замерзшую смесь, то можно увидеть, что она состоит из кристалликов льда и кристалликов соли.
Таким образом, раствор замерзает не так, как простая жидкость. Процесс замерзания растягивается на большой температурный интервал.
Что получится, если посыпать какую-нибудь обледеневшую поверхность солью? Ответ на вопрос хорошо известен дворникам – как только соль придет в соприкосновение со льдом, лед начнет таять. Чтобы явление имело место, нужно, конечно, чтобы температура замерзания насыщенного раствора соли была ниже температуры воздуха. Если это условие выполнено, то смесь лед – соль находится в чужой области состояния, а именно в области устойчивого существования раствора. Поэтому смесь льда с солью и будет превращаться в раствор, т.е. лед будет плавиться, а соль растворяться в образующейся воде. В конце концов либо весь лед растает, либо образуется раствор такой концентрации, температура замерзания которого равна температуре среды.
Площадь дворика в 100 квадратных метров покрыта ледяной коркой в 1 см – это уже не мало льда, около одной тонны. Подсчитаем сколько соли нужно для очистки двора, если температура ?3 °C. Такой температурой кристаллизации (таяния) обладает раствор соли с концентрацией 45 г/л. Примерно 1 л воды соответствует 1 кг льда. Значит, для таяния 1 т льда при ?3 °C нужно 45 кг соли. Практически пользуются гораздо меньшими количествами, так как не добиваются полного таяния всего льда.
При смешении льда с солью лед плавится, а соль растворяется в воде. Но на плавление нужно тепло, и лед забирает его у своего окружения. Таким образом, добавление соли ко льду приводит к понижению температуры.
Мы привыкли сейчас покупать фабричное мороженое. Раньше мороженое готовили дома, и при этом роль холодильника играла смесь льда с солью.
насыщенных и ненасыщенных растворов | Химия для неосновных
Цели обучения
- Определите насыщенный раствор.
- Определите ненасыщенный раствор.
- Определить равновесие раствора.
Как убедиться, что соединение чистое?
Когда соединения синтезируются, они часто содержат примеси загрязняющих веществ. Для удаления этих примесей можно использовать процесс перекристаллизации.Кристаллы растворяются в горячем растворителе, образуя раствор. Когда растворитель охлаждается, соединение теряет свою растворимость и выпадает из раствора в осадок, оставляя другие материалы растворенными.
Насыщенные и ненасыщенные растворы
Поваренная соль (NaCl) легко растворяется в воде. Предположим, у вас есть стакан с водой, в который вы добавляете немного соли, помешивая, пока она не растворится. Так что вы добавляете еще, и он растворяется. Вы продолжаете добавлять все больше и больше соли, в конечном итоге достигая точки, когда соль больше не будет растворяться, независимо от того, как долго и как сильно вы ее перемешиваете.Почему? На молекулярном уровне мы знаем, что действие воды заставляет отдельные ионы отделяться от кристалла соли и попадать в раствор, где они остаются гидратированными молекулами воды. Также случается, что некоторые из растворенных ионов снова сталкиваются с кристаллом и остаются там. Перекристаллизация — это процесс возврата растворенного вещества в твердое состояние. В какой-то момент скорость растворения твердой соли становится равной скорости перекристаллизации растворенного вещества.По достижении этой точки общее количество растворенной соли остается неизменным. Равновесие раствора — это физическое состояние, описываемое противоположными процессами растворения и перекристаллизации, происходящими с одинаковой скоростью. Равновесие раствора при растворении хлорида натрия можно представить одним из двух уравнений.
Хотя это показывает изменение состояния между твердым и водным раствором, предпочтительное уравнение также показывает диссоциацию, которая происходит при растворении ионного твердого вещества.
Когда достигается точка равновесия раствора и растворенные вещества больше не растворяются, говорят, что раствор насыщен. Насыщенный раствор — это раствор, который содержит максимальное количество растворенного вещества, которое может растворяться. При 20 ° C максимальное количество NaCl, которое может раствориться в 100 г воды, составляет 36,0 г. Если после этого момента добавить еще NaCl, он не растворится, потому что раствор насыщен. Что, если вместо этого добавить в раствор больше воды? Теперь большее количество NaCl может растворяться в дополнительном растворителе.Ненасыщенный раствор — это раствор, который содержит меньше максимального количества растворенного вещества, которое способно раствориться. Рисунок ниже иллюстрирует вышеуказанный процесс и показывает различие между ненасыщенными и насыщенными.
Рис. 1. Когда 30,0 г NaCl добавляют к 100 мл воды, все растворяется, образуя ненасыщенный раствор. При добавлении 40,0 г 36,0 г растворяется, а 4,0 г остается нерастворенным, образуя насыщенный раствор. От фонда CK-12 — Кристофер Ауён.
Как определить насыщенный или ненасыщенный раствор? Если добавлено больше растворенного вещества, и оно не растворяется, значит исходный раствор был насыщенным. Если добавленное растворенное вещество растворяется, то исходный раствор был ненасыщенным. Раствор, которому позволили достичь равновесия, но который имеет дополнительные нерастворенные растворенные вещества на дне контейнера, должен быть насыщенным.
Сводка
- Определены насыщенные и ненасыщенные растворы.
- Равновесие в растворе существует, когда скорость растворения равна скорости перекристаллизации.
Практика
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
- Какое исходное решение используется?
- Какой источник тепла для испарения?
- Почему соль выпадает в осадок из раствора?
Обзор
- Почему предпочтительным уравнением для равновесия раствора NaCl является равновесие между твердым NaCl и ионами.
- Что произойдет, если я добавлю воду в насыщенный раствор сахарозы?
- Если нагреть раствор и удалить воду, я увижу кристаллы на дне емкости. Что случилось?
Глоссарий
- перекристаллизация: Процесс возврата растворенного вещества в твердое состояние.
- насыщенный раствор: Раствор, содержащий максимальное количество растворенного вещества, которое может растворяться.
- равновесие раствора: Физическое состояние, описываемое противоположными процессами растворения и перекристаллизации, происходящими с одинаковой скоростью.
- ненасыщенный раствор: Раствор, который содержит меньше максимального количества растворенного вещества, которое может растворяться.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
7.4: Концентрация и молярность — Chemistry LibreTexts
Как описано в предыдущем разделе, хлорид натрия хорошо растворяется в воде. При 25 ˚C (около комнатной температуры) 359 граммов хлорида натрия растворятся в одном литре воды.Если бы вы добавили в раствор больше хлорида натрия, он не растворился бы, потому что данный объем воды может растворить, диспергировать и стабилизировать только фиксированное количество растворенного вещества (вещества, которое растворяется). Это количество отличается для каждого соединения и зависит от структуры конкретного соединения и от того, как эта структура взаимодействует с сольватной оболочкой. Когда вещество растворяется в воде до такой степени, что больше не переходит в раствор, мы говорим, что раствор является насыщенным на .Для большинства соединений нагревание раствора позволит растворить большее количество вещества, поэтому важно учитывать температуру, когда вы говорите о растворимости конкретного соединения.
Если бы у нас был насыщенный раствор хлорида натрия при 25 ˚C, мы могли бы указать концентрацию как 359 г / л, но поскольку мы знаем молярную массу хлорида натрия (58,44 г / моль), мы также могли бы выразить нашу концентрацию как :
\ [\ left (\ frac {(359 \, g) \ times \ frac {1 \, мол} {58.44 \, g}} {1 \, L} \ right) = 6,14 \, моль / л \]
В химии единицы моль / л называются молярностью с аббревиатурой M. Таким образом, мы можем сказать, что наш насыщенный раствор хлорида натрия был 6,14 молярный , или 6,14 M .
Преимущество выражения концентраций в терминах молярности состоит в том, что эти растворы теперь можно использовать в химических реакциях известной стехиометрии, поскольку любой объем раствора непосредственно соответствует известному числу молей конкретного соединения.Например, молярная масса бромида калия составляет 119,0 г / моль. Если бы мы растворили 119,0 граммов KBr в 1.000 л воды, концентрация была бы 1.000 моль / л, или 1.000 М. Если бы мы теперь взяли половину этого раствора (0,500 л), мы знали бы, что у нас также будет 0,500 моль KBr.
Мы можем определить концентрацию раствора, используя алгоритм решения проблем, который мы представили в главе 1. Например, если вы хотите найти молярность раствора, содержащего 42,8 грамма KBr в 1,00 л воды, вы должны определить даны и 42.8 г, ваше отношение — это молярная масса (119 г / моль), и вы хотите, чтобы находила молярность (или моль / л). Не забудьте настроить уравнение так, чтобы единицы при появлялись в знаменателе отношения , количество молей составляет:
\ [42,8 \, g) \ times \ left (\ frac {1 \, моль} {119 \, g} \ right) = 0,360 \, моль \]
и молярность:
\ [\ left (\ frac {0,360 \, моль} {1,00 \, L} \ right) = 0,360 \, моль / л \; или же\; 0,360 \, M \]
Когда вы освоитесь с простым двухэтапным методом, вы можете комбинировать шаги и просто разделить заданную массу на заданный объем, чтобы сразу получить результат.Таким образом, если бы у вас было 1,73 грамма KBr в 0,0230 л воды, ваша концентрация была бы:
\ [\ left (\ frac {(1.73 \, g) \ times \ frac {1 \, моль} {119 \, g}} {0.0230 \, L} \ right) = 6.32 \, моль / л \; или же\; 0,632 \, М \]
Мы также можем решить эти проблемы в обратном порядке, то есть преобразовать молярность в массу. Например; определить количество граммов KBr, которые присутствуют в 72,5 мл 1,05 М раствора KBr. Здесь нам дан объем 0,0725 л, и наше соотношение — молярность, или (1.05 моль / л). Сначала решаем родинки,
\ [0,0725 \, L \ times \ left (\ frac {1.05 \, моль} {1,00 \, L} \ right) = 0,0761 \, моль \]
, а затем преобразовать в массу, используя:
\ [0,0761 \, моль \ раз \ влево (\ frac {119 \, грам} {1 \, моль} \ справа) = 9,06 \, грам \, из \, KBr \]
Упражнение \ (\ PageIndex {1} \)
Образец 12,7 г сульфата натрия (Na 2 SO 4 ) растворяют в 672 мл дистиллированной воды.
- Какова молярная концентрация сульфата натрия в растворе?
- Какая концентрация иона натрия в растворе?
Упражнение \ (\ PageIndex {1} \)
Рассчитайте массу хлорида натрия, необходимую для получения 125.0 мл 0,470 М раствора NaCl. Если вы растворите 5,8 г NaCl в воде, а затем разбавите до 100,0 мл, какой будет молярная концентрация полученного раствора хлорида натрия?
ФАЗОВЫЕ ДИАГРАММЫ ТВЕРДОГО-ЖИДКОГО: РАСТВОРА СОЛИ На этой странице рассматривается фазовая диаграмма для смесей соли и воды — как построена диаграмма и как ее интерпретировать.Он включает краткое обсуждение кривых растворимости. | |
Важно: Эта страница на самом деле предназначена только для введения в тему, подходящую для курсов для детей от 16 до 18 лет, например, UK A level Chemistry. Если вы попали на эту страницу прямо из поисковой системы, было бы неплохо сначала прочитать страницу о фазовой диаграмме олово-свинец. Это довольно простая в использовании система, которая дает представление о некоторых идеях, которые могут вам понадобиться. | |
Кривые растворимости Две типичные кривые растворимости Кривая растворимости показывает, как растворимость такой соли, как хлорид натрия или нитрат калия, зависит от температуры. Растворимость часто (хотя и не всегда) измеряется как масса соли, которая насыщает 100 граммов воды при определенной температуре. Раствор считается насыщенным, если он больше не растворяет соль при данной температуре — в присутствии кристаллов соли. | |
Примечание: При отсутствии некоторых твердых кристаллов иногда можно получить пересыщенных растворов . Эти растворы обычно нестабильны, и излишки материала кристаллизуются, если вокруг кристаллов есть что-то образовывать. Это может быть всего лишь один крошечный дополнительный кристалл или царапина на стекле емкости. | |
Для большинства веществ растворимость увеличивается с температурой.Для некоторых (например, нитрата калия) увеличение происходит довольно быстро. Для других (например, хлорида натрия) существует лишь небольшое изменение растворимости с температурой. | |
Примечание: Эти кривые растворимости являются лишь эскизами. Значения примерно правильные, но не следует использовать кривые для получения каких-либо точных данных. | |
Интерпретация кривой растворимости Очевидно, кривая растворимости показывает растворимость вещества при определенной температуре.Для целей фазовой диаграммы один из важных способов взглянуть на это — изучить, что произойдет, если вы уменьшите температуру раствора с некоторой заданной концентрацией. Например, предположим, что у вас есть почти кипящий раствор нитрата калия в воде. Возьмем раствор, содержащий 100 г нитрата калия и 100 г воды. Теперь дайте раствору остыть. При всех температурах выше указанной на графике (около 57 ° C) в 100 г воды растворяется более 100 г нитрата калия.Весь нитрат калия останется в растворе. При 57 ° C вы попадаете на кривую растворимости. Это температура, при которой в 100 г воды растворяются 100 г нитрата калия с образованием насыщенного раствора. Если температура упадет хоть чуть-чуть ниже 57 ° C, вода больше не будет растворять столько нитрата калия, и поэтому некоторая ее часть будет кристаллизоваться. Чем ниже падает температура, тем больше кристаллизуется нитрат калия, потому что вода будет растворять его все меньше и меньше. Вы можете думать об этом как о простой фазовой диаграмме. Если у вас смесь 100 г нитрата калия и 100 г воды и температура выше 57 ° C, у вас одна фаза — раствор нитрата калия. Если температура этой смеси ниже 57 ° C, у вас будет смесь двух фаз — раствора и твердого нитрата калия. Кривая растворимости представляет собой границу между этими двумя различными ситуациями. Теперь рассмотрим фазовую диаграмму раствора хлорида натрия более подробно. Фазовая диаграмма раствора хлорида натрия Как выглядит фазовая диаграмма Мы подробно обсудим, что все это означает, но прежде всего обратите внимание на две вещи по сравнению с аналогичной фазовой диаграммой олово-свинец, о которой, надеюсь, вы уже читали. Во-первых, мы рассматриваем только очень ограниченный диапазон температур. Верхняя часть этой конкретной диаграммы составляет всего около 50 ° C, хотя может быть и выше. Во-вторых, все действие происходит в левой части диаграммы. Вот почему отсутствует большая часть горизонтальной шкалы (представленная ломаным зигзагом на шкале). Обозначенные области на фазовой диаграмме Все эти области показывают то, что вы бы увидели, если бы у вас была определенная смесь соли и воды при данной температуре. Например, если температура была ниже -21,1 ° C, вы всегда будете видеть смесь твердой соли и льда.Какой бы пропорции воды и соли у вас ни были, не было бы никакой жидкости. При температурах выше этой, то, что вы увидите, будет зависеть от того, где ваш конкретный набор условий попадает на диаграмму. Вам просто нужно заметить, в какую область попадают условия. Что означают линии Давайте возьмем строки по очереди. Первый, на который стоит обратить внимание, — это выделенный жирным зеленым шрифтом на следующей диаграмме. Эта линия показывает влияние увеличения количества соли на температуру замерзания воды. До точки, когда в смеси содержится 23,3% соли, чем больше соли, тем ниже точка замерзания воды. | |
Примечание: Если вам интересно (хотя это не важно для понимания текущей страницы), вы можете узнать, почему соль снижает точку замерзания воды, прочитав страницу о законе Рауля и нелетучих растворенных веществах. Если вы решите перейти по этой ссылке, используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
Вторая линия на самом деле представляет собой кривую растворимости соли в воде, хотя она не совсем похожа на ту, которую мы описали ранее на этой странице. Причина, по которой он выглядит иначе, в том, что оси поменялись местами. На кривой нормальной растворимости по горизонтальной оси отложена температура, а по вертикальной оси показана растворимость в граммах на 100 г воды — мера концентрации. На этот раз мерой концентрации является горизонтальная ось, а температура — вертикальная. Если вы уже читали о системе олово-свинец, вам может показаться странным включать кривую растворимости в фазовую диаграмму. В системе олово-свинец обе наклонные линии показывают влияние одного из компонентов на температуру замерзания другого. Но если подумать, что это значит, это не так уж и странно. Точка замерзания — это температура, при которой кристаллы начинают появляться при охлаждении жидкой смеси. В случае солевого раствора с концентрацией соли более 23,3% кривая растворимости показывает температуру, при которой появляются кристаллы соли при охлаждении раствора заданной концентрации. Если вам это непонятно, вернитесь и перечитайте начало этой страницы. Мы расскажем об этом больше, когда вскоре опишем, как использовать фазовую диаграмму. Существует также скрытая разница между этой линией и соответствующей линией на диаграмме оловянно-свинцовый.В этом случае обе наклонные линии в конечном итоге достигли левой или правой оси. Можно было говорить о случае, когда у вас был 100% свинец или 100% олово. В этом случае невозможно получить 100% соль. Эта линия в конце концов подходит к концу. При давлении в 1 атмосферу температура не превысит 100 ° C, потому что вода закипит, и у вас больше не будет раствора. | |
Примечание: Раствор соли будет кипеть при температуре выше 100 ° C (в зависимости от его концентрации), потому что добавление нелетучих растворенных веществ к растворителю увеличивает его точку кипения.Это обсуждается на другой странице о законе Рауля и нелетучих растворенных веществах. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу, если вы решите перейти по этой ссылке. Это не обязательно для понимания остальной части этой страницы. | |
Даже если вы повысите давление, максимальная температура, которую вы сможете достичь, составит 374 ° C — критическая температура воды. Вода не существует в виде жидкости выше этой температуры. Чтобы попасть в правую часть графика, где у вас 100% соль, вам нужно получить температуру до 801 ° C — точку плавления соли. | |
Примечание: Если вы не уверены в критической температуре воды, вы можете прочитать страницу о фазовых диаграммах чистых веществ. Опять же, это не обязательно для понимания остальной части этой страницы. Вам просто нужно знать, что обсуждаемая линия не доходит до правой оси. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
После всех этих хлопот финальная линия проста! Эту линию просто проводят при самой низкой температуре, при которой смесь соли и воды может содержать любую жидкость.Это известно как эвтектическая температура . Конкретная смесь соли и воды (содержащая 23,3% соли), которая замерзает при этой температуре, известна как эвтектическая смесь . | |
Примечание: Эвтектические смеси и температура эвтектики более подробно обсуждаются на странице о системе олово-свинец, о которой я продолжаю говорить! | |
Использование фазовой диаграммы Фазовая диаграмма используется, чтобы узнать, что произойдет, если вы охладите солевой раствор определенной концентрации.Нам нужно рассмотреть три отдельных случая. Раствор охлаждающей соли эвтектического состава Это самый простой вариант! Ничего не происходит, пока вы не дойдете до эвтектической температуры. В этот момент вы начнете формировать как кристаллы льда, так и кристаллы соли. Если вы продолжите охлаждение, вы, очевидно, получите твердую смесь льда и соли. Вы переходите прямо из области «раствор соли» на фазовой диаграмме в область «твердая соль + лед». Охлаждающий солевой раствор более разбавленный, чем эвтектический состав Когда температура падает настолько, что достигает границы между двумя областями фазовой диаграммы, начинают формироваться кристаллы льда — другими словами, раствор начинает замерзать. | |
Примечание: Есть два способа посмотреть, что происходит, когда вы продолжаете охлаждать смесь.На странице о фазовой диаграмме олово-свинец я подробно рассмотрел оба этих способа. Однако на данной странице я решил придерживаться той, которую я считаю более простой для понимания. Эта страница уже достаточно сложна, и описание обоих способов взглянуть на нее будет слишком запутанным — тем более, что мне придется повторить это еще раз дальше по странице. Если вы хотите использовать другой метод (который учитывает изменения в составе присутствующей жидкости), вы сможете решить его, обратившись к странице с оловянным свинцом.Прочтите абзац под заголовком « Размышляя об изменениях в составе жидкости » и просто замените слова олово и свинец на соль и воду! | |
По мере того, как раствор продолжает охлаждаться, он опускается в область «лед + раствор соли». Очевидно, состав раствора изменился, потому что он содержит меньше воды — часть ее замерзла и превратилась в лед. Но состав системы в целом остается прежним, и поэтому мы продолжаем двигаться по той же линии. Чтобы узнать, что на самом деле находится в смеси, вы проводите горизонтальную связующую линию через точку, показывающую нужную вам температуру, и смотрите, что она достигает с обоих концов. Слева он попадает на вертикальную ось, показывающую 100% воды — в данном случае это чистые кристаллы льда. На другом конце он попадает в наклонную линию — это говорит вам о составе оставшегося солевого раствора. По мере того, как смесь продолжает охлаждаться, она в конечном итоге достигает эвтектической температуры, и в этот момент весь остальной раствор превратится в твердое вещество — смесь льда и кристаллов соли. Охлаждающий солевой раствор более концентрированный, чем эвтектический состав Фазовая диаграмма интерпретируется точно так же, за исключением того, что на этот раз сначала образуются кристаллы соли, а не кристаллы льда. На следующей диаграмме первые кристаллы соли образуются, когда температура достигает границы.По мере того, как температура продолжает падать до области «твердая соль + раствор соли», все больше и больше соли будет выкристаллизовываться. Чтобы точно определить, что присутствует при любой температуре, вы можете снова нарисовать связующую линию и посмотреть, что находится на обоих концах. На схеме показана связующая линия, когда температура упала до некоторого случайного места в области «твердая соль + солевой раствор». Опять же, посмотрев на концы этой связующей линии, вы можете увидеть, что смесь содержит твердую соль (100% соль в правом конце линии) и раствор, концентрацию которого можно определить, посмотрев на левую часть. рука конец линии. По мере того, как температура продолжает падать, вы в конечном итоге достигнете температуры эвтектики, когда все, что осталось — соль и вода — превратится в твердое вещество, давая вам смесь твердой соли и льда.
В меню фазового равновесия. . . В меню «Физическая химия». . . В главное меню. . . © Джим Кларк 2005 (изменено в январе 2014 г.) | |
Влияние солевых растворов и циклов абсорбции в капиллярах и коэффициент сушки образцов красного кирпича с разными стыками
Повышение влажности может снизить эстетическую ценность здания, комфорт и здоровье в сочетании с наличием растворимых солей в здании компоненты и в грунтовых водах могут даже привести к разложению материала и ухудшить его структурные характеристики.Целью данной исследовательской работы было изучение влияния различных циклов поглощения двух насыщенных растворов сульфата натрия и хлорида калия на кривые капиллярного поглощения, полученные путем частичного погружения образцов красного кирпича без и с различными соединениями. Результаты выявили существенные различия в капиллярных коэффициентах, полученных при испытании образцов с растворами солей. В конце статьи была представлена оценка кинетики сушки для всех испытанных образцов.Четыре различные модели кинетики первого порядка, доступные в литературе, были скорректированы для описания процесса сушки, и результаты указывают на то, что модели Пейджа и логарифмические модели позволяют лучше всего соответствовать. Также был оценен кажущийся коэффициент молекулярной диффузии для твердых образцов красного кирпича, насыщенных различными растворами и соединениями.
1. Введение
Повышенная влажность — одна из основных проблем строительства, особенно в старых, старинных и исторических зданиях, связанных с пористыми материалами, используемыми в этой отрасли.Это происходит из-за миграции растворенных в воде солевых ионов в пористую сеть стен здания, где они остаются и кристаллизуются после испарения воды, оказывая большое давление на стенки пор и в конечном итоге приводя к их разрушению после многих циклов кристаллизации / растворения. [1, 2]. Этот механизм имеет огромное влияние на деградацию исторических зданий, поскольку они были построены в то время, когда строительные технологии не предпринимали никаких усилий для предотвращения такого рода патологий.
Материалы, используемые в строительной индустрии, обладают пористыми характеристиками, которые способствуют фиксации влаги за счет таких механизмов, как капиллярность, гигроскопичность и конденсация [3–7]. Описанные в этой статье эксперименты напрямую связаны с повышением влажности, одним из явлений распространения влаги, вызывающих дальнейшее разрушение зданий. Повышение влажности можно объяснить капиллярной миграцией воды из почвы через пористую сеть материалов, из которых состоят элементы здания.Этот вид влаги получает большее распространение в старых зданиях, в основном построенных из каменной кладки, в которых используются пористые материалы, такие как керамический кирпич, строительный раствор и камни [1, 2].
Присутствие растворенных солей в воде, которая поднимается вверх через пористую сеть строительных элементов, является раздражающим фактором ее деградации [8, 9]. Если, с одной стороны, соли следуют за водой во время ее подъема в жидкой фазе, этого не происходит при испарении воды. Следовательно, соли остаются в пористой структуре строительных материалов и в конечном итоге кристаллизуются после того, как раствор достигнет состояния перенасыщения.Соль может кристаллизоваться на поверхности материалов, вызывая выцветание с эстетическими последствиями для здания или внутри пористой структуры, оказывая большое давление на стенки пор, которое может разрушить их при превышении ее механического сопротивления [10, 11]. Гигротермальные колебания окружающей среды могут способствовать циклам кристаллизации / растворения и потенциально развитию разрушающих напряжений в различных порах в каждом цикле.
Кроме того, конструктивные системы, элементы и компоненты, особенно кладка, основывают свою функциональную эффективность на сочетании материалов с различными характеристиками.Однако эта неоднородность значительно усложняет анализ влагопереноса, требуя знания не только об индивидуальных характеристиках материалов, но и об условиях непрерывности границы раздела, разделяющего отдельные материалы, и поэтому знания о соединениях влияют на эти явления переноса считаются ключевыми [12–14].
Эта статья представляет собой отчет об экспериментальной работе, проведенной с образцами кирпича, с целью оценить влияние солевых растворов на капиллярное поглощение монолитных образцов кирпича по сравнению с водой.Сульфат натрия и хлорид калия были выбранными солями для проведения экспериментов. Первая — это одна из солей, которые вызывают большую деградацию зданий; второй был выбран из-за того, что он очень часто встречается в строительных материалах, особенно в хлориде ионов. Также представлена кинетика сушки, и пять моделей были скорректированы для описания процесса сушки. Наконец, в испытаниях капиллярной абсорбции и высыхания различные соединения, такие как идеальный контакт (только в контакте), гидравлическая непрерывность (с взаимным проникновением обоих материалов) и воздушное пространство (с воздушным слоем между различными материалами), также были испытаны для оценки границы раздела. влияние на процессы переноса влаги.
2. Материалы и методы
В качестве испытательных образцов использовались девять монолитных образцов из красного кирпича с размерами 5 × 5 × 10 см 3 (по три для каждого раствора, включая воду). Все образцы были герметизированы на боковых сторонах эпоксидным покрытием, чтобы избежать испарения через эти стороны и обеспечить однонаправленный поток влаги от нижней части к верхней поверхности образцов. Испытания проводились только для чистой воды и двух насыщенных солевых растворов (KCl и Na 2 SO 4 ).Растворы были насыщены избытком соли, чтобы избежать уменьшения количества ионов в процессе абсорбции.
2.1. Капиллярный коэффициент
Тесты капиллярного поглощения проводились в соответствии с процедурой № II.6 «Коэффициент водопоглощения (капилляр)» по RILEM [15]. Испытаниям предшествовала сушка образцов в печи при температуре около 60 ° C до получения постоянной массы для расчета сухой массы образцов. После этого этапа образцы хранили в испытательной комнате в течение нескольких дней, пока они не достигли гигротермического равновесия.
Mukhopadhyaya et al. [16] подтвердили влияние температуры на коэффициент капиллярного поглощения образцов кирпича при их исследовании с различными пористыми материалами. Чтобы свести к минимуму влияние температуры на наши результаты, испытания проводились в помещении с контролируемой температурой. Значения температуры и относительной влажности (RH) воздуха измерялись каждые десять минут в течение 33 дней с использованием устройства для последовательной записи данных. Полученные средние значения составили 22,8 ° C для температуры и 52 ° C.7% для относительной влажности.
Испытания начались с частичного погружения образцов на глубину 5 мм. После погружения периодически проводили взвешивание, чтобы определить количество воды, абсорбированной во время испытания. В первый день взвешивание всех образцов проводилось через 1, 3, 5, 10, 15, 30 и 60 минут, а затем не реже одного раза в час. Обычно взвешивание проводилось каждые два часа на второй день, каждые три часа на третий день и один раз в день в оставшиеся дни тестирования.Это время еще не претерпело некоторых корректировок для некоторых протестированных комбинаций. Например, для образцов с воздушным пространством между слоями после того, как влажный фронт достиг границы раздела, время между взвешиваниями было увеличено, поскольку перенос влаги на границе раздела происходил в паровой фазе и, следовательно, был намного медленнее.
Количество поглощенной воды на единицу площади во время анализа (кг / м 2 ) рассчитывается по формуле (1), где (кг) — это сухая масса образца, (кг) — масса образца при времени, а (m 2 ) — площадь основания образца:
После определения количества воды, абсорбированной за время до насыщения пористой среды, можно было рассчитать коэффициент капиллярного поглощения. « и максимальный поток влаги через границу раздела.Более ранний соответствует наклону первого линейного участка кривой впитывания, который выражает количество воды, абсорбированной на единицу площади (кг / м 2 ), как функцию корня из времени (s 1/2 ). . Второй соответствует наклону линейной аппроксимации кривой впитывания, которая выражает количество воды, абсорбированной на единицу площади (кг / м 2 ), как функцию времени (с) после достижения границы раздела.
Результаты капиллярного поглощения представлены сорбционной способностью (м / с 0.5 ). Это свойство, которое зависит как от материала, так и от жидкости, выражает тенденцию строительного материала абсорбировать и передавать жидкость за счет капиллярности [6], как показано где — поверхностное натяжение жидкости, — вязкость жидкости. , — собственная сорбционная способность материала. Важно помнить, что соотношение между коэффициентом капиллярного поглощения и сорбционной способностью выражается выражением, где — плотность воды (кг / м 3 ).
2.2.Кинетика сушки
Сушка оценивалась в соответствии с экспериментальной процедурой RILEM [15]. Он заключается в замачивании образцов и последующем их высыхании через верхнюю поверхность в контролируемых условиях окружающей среды. Между тем, потеря воды контролируется периодическим взвешиванием. Результаты выражаются так называемой кривой массовой сушки, которая отображает изменение содержания влаги во времени.
Часто для описания кривых сушки используются довольно простые модели [17, 18], которые могут обеспечить адекватное представление экспериментальных результатов.Одной из наиболее упрощенных моделей является экспоненциальная модель: где — среднее содержание влаги в любой момент времени, — это начальное содержание влаги, — это равновесное содержание влаги, — это константа скорости сушки и — время сушки. Обычно эта модель не обеспечивает точного моделирования кривых сушки многих строительных материалов, недооценивая начало кривой сушки и переоценивая более поздние стадии. Чтобы смягчить эту незначительную точность, модель Пейджа применяется с эмпирической модификацией временного члена путем введения показателя степени:
Эти эмпирические модели выводят прямую зависимость между средним содержанием влаги и временем высыхания.Однако они пренебрегают основами процесса сушки и их параметры не имеют физического смысла.
В этой работе кривые сушки были подогнаны к четырем различным эмпирическим и полуэмпирическим моделям сушки (см. Таблицу 1). Регрессионный анализ этих уравнений проводился с использованием программы STATISTICA. Коэффициент регрессии () был основным критерием выбора наилучшего уравнения для описания кривых сушки ETICS. Производительность полученных новых моделей оценивалась с использованием различных статистических параметров, таких как средняя ошибка смещения (MBE), среднеквадратичная ошибка (RMSE) и хи-квадрат (), в дополнение к коэффициенту регрессии ().Эти параметры можно рассчитать следующим образом:
| |||||||||||||||
Механизмы массопереноса в строительных материалах сложны, и часто моделирование кривых высыхания в период падения скорости выполняется, предполагая, что основной механизм имеет диффузионную природу.В соответствии с этим экспериментальные данные сушки для определения кажущегося коэффициента молекулярной диффузии были интерпретированы с использованием диффузионной модели Фика. В одномерной постановке с диффундирующим веществом, движущимся в направлении, нормальном к слою среды толщиной, уравнение диффузии может быть записано как [19] при следующих граничных условиях:
Аналитическое решение (6) с начальные и граничные условия (7a) — (7c) равны
Интегрируя скорость проникновения водяного пара в единичную площадь поверхности образца (), получают общее количество диффундирующего вещества во времени; тогда соответствующее решение уравнения диффузии (8) может быть записано следующим образом: и для длительного времени сушки (без учета члена более высокого порядка путем установки) оно было упрощено следующим образом:
3.Результаты и обсуждение
3.1. Капиллярный коэффициент
На рис. 1 схематично изображены монолитный образец, поверхность раздела гидравлической целостности, идеальная поверхность контакта и поверхность раздела воздушного пространства.
Кривые капиллярного поглощения, полученные на этих образцах для каждого из трех испытанных растворов, представлены на рисунках 2 и 3. Коэффициенты капиллярного поглощения, определенные по этим кривым, представлены в таблице 2.
| ||||||||||||||||||||||||||||||
Результаты, представленные в этой статье относительно коэффициента капиллярного поглощения, подтверждают гипотезу о том, что присутствие растворимых солей, растворенных в воде, влияет на кинетику смачивания пористых материалов, по крайней мере, кирпичного материала, как это было. пористый материал в исследовании.Коэффициент капиллярного поглощения, определенный для образцов, погруженных в насыщенный раствор сульфата натрия, был намного ниже, чем тот, который был получен для контрольного теста (чистая вода). С другой стороны, хлорид калия, по-видимому, вызывает увеличение этого коэффициента по сравнению с контрольным раствором. Однако разница между коэффициентом капиллярного поглощения раствора сульфата натрия и раствора сравнения выше, чем разница между хлоридом калия и последним.Наши результаты согласуются с результатами, полученными Азеведо [11], который пришел к выводу, что соли с ионом калия (K + ) приводят к уменьшению коэффициента капиллярного поглощения по сравнению с чистой водой, а соли с ионом натрия (Na + ) вызывают снижение коэффициента капиллярного поглощения.
На рисунке 4 можно увидеть кривую капиллярного поглощения образцов красного кирпича как функцию корня из времени после 1 и 2 циклов с чистой водой и насыщенными растворами KCl и Na 2 SO 4 , для каждого типа соединения.Более подробный анализ был проведен на рисунке 5, и полученные результаты показывают, что сравнивая 1-й и 2-й циклы абсорбции, можно сделать вывод, что образцы, погруженные в воду, практически абсорбировали одинаковое количество воды, но когда образцы погружены в растворов солей (Na 2 SO 4 и KCl) прирост массы в процессе абсорбции во 2-м цикле меньше, чем в 1-м.
На рис. 6 показано увеличение массы образцов, испытанных в воде и обоих растворах солей, для трех различных проанализированных соединений.Для обеспечения гидравлической целостности поверхности контакт между слоями осуществлялся с помощью строительного раствора толщиной 3 мм и с взаимным проникновением обоих слоев. На рис. 6 показано замедление процесса смачивания, когда влага достигает границы раздела из-за гигроскопического сопротивления поверхности. Этот результат показывает наличие сопротивления, связанного с максимальным передаваемым потоком (FLUMAX), которое представляет более высокое значение FLUMAX, как показано на рисунке 7. Максимальное передаваемое значение потока является параметром, который легко получить экспериментально и является важным входным параметром для гидротермальных программ. имеется в литературе [20].
В случае идеальной поверхности контакта эксперименты, подробно описанные на Рисунке 6, показывают замедление процесса смачивания, когда влага достигает границы раздела из-за гигроскопического сопротивления границы раздела. Еще раз, этот результат показывает наличие сопротивления, связанного с максимальным передаваемым потоком, но более низкий медленный набор массы образцов указывает на высокое гигро-сопротивление и ожидаемое более низкое значение максимального передаваемого потока, чем полученное в ситуации на границе раздела гидравлической целостности.
Наконец, для образцов с границей раздела с воздушным пространством образцы разделены воздушным пространством примерно на 3 мм, чтобы получить водородную фракцию, которая предотвращает перенос влаги в жидкой фазе. На фиг.6 показано замедление процесса смачивания, когда влага достигает границы раздела из-за гигроскопического сопротивления поверхности раздела; однако это гигроскопическое сопротивление выше, чем сопротивление, наблюдаемое на границе идеального контакта. Это явление наблюдается по чрезвычайно медленному увеличению веса, представленному на рисунке 6, для описанной ситуации, и еще раз показывает наличие сопротивления, связанного с максимальным передаваемым потоком.Ожидается, что это значение будет ниже, чем полученное при идеальном интерфейсе контакта (см. Рисунок 7).
3.2. Кинетика сушки
На рис. 8 показаны изменения влажности во времени в процессе сушки для различных швов и жидких растворов. Общей чертой кривых, показанных на рисунке 8, является их сходство с типичными кривыми сушки, поскольку содержание влаги экспоненциально снижается со временем.
Скорость высыхания непрерывно снижается со временем и снижением влажности.Этот результат показывает, что доминирующим физическим механизмом, определяющим движение влаги в образцах красного кирпича, является вторая стадия сушки. Во время второй стадии процесса сушки диффузия в строительном материале ограничивает скорость испарения.
Для описания кривых сушки использовались пять моделей сушки, и применимость этих моделей представлена в таблицах 3 и 4. Критерием, используемым для выбора моделей, которые лучше описывают процесс сушки, была величина относительной ошибки для каждой из них ( см. Таблицу 4).Наилучшие результаты показали модели Пейдж и логарифмическая.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Результаты, представленные в таблице 3, показывают, что полученная константа сушки больше для образцов красного кирпича с чистой водой, чем с анализируемым солевым раствором. Важно помнить, что с солевыми растворами процесс сушки более сложен, учитывая, что ионы соли остаются в материале, и сложный процесс транспортировки. Другой важный вывод — влияние соединений в процессе сушки, и можно заметить, что монолитные образцы и образцы с идеальным контактом имеют более высокие значения постоянной сушки, чем образцы с гидравлической непрерывностью.На рисунке 8 также показано, что монолитные образцы и образцы с идеальной контактной поверхностью представляют собой аналогичный процесс сушки, чего следует ожидать из-за природы идеального контактного соединения. Образцы с поверхностью раздела воздушного пространства имеют более высокое значение постоянной сушки, что, учитывая самый высокий контакт с воздухом, который они имеют, для удаления воды, кажется ожидаемым и реалистичным результатом.
Наконец, чтобы установить диффузионную модель, эффективный коэффициент диффузии был определен с использованием (9), и были получены экспериментальные кривые сушки образцов красного кирпича.Определение эффективного коэффициента диффузии происходит по графику безразмерного отношения влажности, полученного из экспериментальных данных, нанесенных на полулогарифмическую диаграмму в зависимости от времени. Этот график соответствует первому периоду падения. Наклон этой прямой равен количеству в случае геометрии плиты.
Полученный эффективный коэффициент диффузии () больше для образцов из красного кирпича с чистой водой, чем для образцов с солевыми растворами, а образец с гидравлической границей раздела имеет более низкие значения, как показано в таблице 3.
4. Выводы
В этой работе была представлена обширная экспериментальная кампания по изучению влияния различных циклов поглощения двух различных насыщенных растворов сульфата натрия и хлорида калия на кривые капиллярного поглощения, полученные путем частичного погружения образцов красного кирпича без и с разными стыками. Кинетический процесс сушки также был проанализирован для всех испытанных образцов.
Основными выводами были следующие: (i) Обе соли по-разному влияют на коэффициент капиллярного поглощения.Присутствие сульфата натрия вызывает снижение этого коэффициента по сравнению с тестами, проведенными с чистой водой, в то время как тесты, проведенные с хлоридом калия, показали увеличение коэффициента капиллярного поглощения по сравнению с чистой водой, несмотря на меньшую разницу. (Ii) Все три типы изученных границ раздела показали водное сопротивление во время испытаний капиллярной абсорбции, хотя и с разными уровнями величины. Образцы с воздушным пространством между слоями обладают гораздо большим сопротивлением переносу влаги через их границу раздела по сравнению с образцами с идеальным и гидравлическим контактом из-за того, что влага течет только в паровой фазе, в отличие от двух других, которые также поддерживают перенос жидкой фазы.(iii) Сравнение наших результатов с результатами, полученными де Фрейтасом [12], помогло поддержать теорию автора о том, что максимальный поток влаги через воздушное пространство и идеальные границы контакта (по отдельности) могут быть зафиксированы в близком диапазоне значений для одного и того же материала, поскольку Максимальные значения потока влаги, определенные в этой работе, были очень близки к авторским для аналогичного использованного материала. (iv) Образцы с гидравлической контактной поверхностью дали более неоднородные результаты. Кроме того, водостойкость такой поверхности раздела зависит от нескольких факторов, таких как соотношение вода / цемент и условия отверждения.Несмотря на разницу между характеристиками образцов, сравнение наших результатов и результатов Cunha показывает различное поведение в переносе влаги через границу раздела, несмотря на использование одного и того же цементного материала. (V) Для описания процесса сушки и результатов были скорректированы различные модели кинетики первого порядка. указывают на то, что модели страниц и логарифмические модели позволяют наилучшим образом соответствовать друг другу.
Номенклатура
| : | Площадь | |
| : | Коэффициент капиллярного поглощения | |
| : | Эмпирические коэффициенты моделей | Коэффициент диффузии | кинетический коэффициент |
| : | Толщина | |
| MBE: | Средняя ошибка смещения | |
| : | Сухая масса образца | |
| : | Масса образца 9014 в момент времени 902 902 902 | Количество поглощенной воды на единицу площади |
| MR: | Коэффициент влажности, | |
| : | Количество экспериментальных точек | |
| : | Количество расчетных параметров | |
| RMSE Среднеквадратичная ошибка | ||
| : 9021 0 | Сорбционная способность | |
| : | Время | |
| : | Температура | |
| : | Осевая координата | |
| : | Влагосодержание | |
| : | Исходная влажность | |
| : | Тест хи-квадрат | |
| : | Плотность воды. |
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Авторы выражают признательность Фонду науки и технологий (FCT) за финансовую поддержку (PTDC / ECM-COM / 3080/2012). J. M. P. Q. Delgado благодарит FCT за финансовую поддержку в виде гранта SFRH / BPD / 109310/2015.
Изменение объема при растворении соли в воде
Том
Свойства материи
Изменение объема при растворении соли в воде
Практическая деятельность
для 14-16
Класс практический
Это наводящий на размышления эксперимент с удивительным результатом.
Аппаратура и материалы
- Колба мерная, литровая
- Соль поваренная
Примечания по технике безопасности и охране труда
Прочтите наше стандартное руководство по охране труда и технике безопасности
Когда хлорид натрия растворяется в воде с образованием насыщенного раствора, происходит уменьшение объема на 2,5%. В стакане такого не заметишь. Даже в обычной колбе это было бы еле заметно.Однако, если в химической лаборатории имеется мерная колба, изменение объема будет заметно в узкой горловине. Важно удалить все пузырьки воздуха из растворяемой соли. Поэтому в начале демонстрации его необходимо тщательно намочить.
Растворимость соли не сильно зависит от температуры, поэтому от использования горячей воды мало пользы.
Соль должна быть в виде мелких кристаллов, а не в виде камней или очень мелкого порошка.
Процедура
- Поместите в колбу от 300 до 400 г соли.
- Налейте достаточно воды, чтобы покрыть сухую соль, и перемешайте воду в колбе, чтобы смочить соль и позволить пузырькам воздуха всплыть вверх. (Этой воды будет недостаточно для растворения большего количества соли; студенты все равно будут видеть много кристаллов соли.)
- Как только пузырьки воздуха исчезнут, наполните колбу водой до отметки.
- Четко отметьте уровень воды ручкой OHP или другим маркером. Обратите внимание на то, что большая часть соли все еще присутствует в виде твердого вещества, которое не может раствориться.
- Встряхните колбу, чтобы ускорить растворение, пока не растворится столько соли, сколько будет.
- Укажите на последующее небольшое сокращение. Спросите студентов, почему они думают, что это произошло.
Учебные материалы
Это дает студентам урок о необходимости всегда быть в поисках неожиданных результатов.Это также дает студентам возможность использовать свое воображение, чтобы придумать возможные объяснения. И то, и другое гораздо важнее, чем знать настоящую причину эффекта: атомы натрия и хлора в их кристаллической решетке занимают больше места, чем когда они разделены. Действительно, нет ничего плохого в том, чтобы не дать ответ
сейчас, а вместо этого взять на себя обязательство вернуться к проблеме позже.
Этот эксперимент прошел испытания на безопасность в июне 2004 г.
Соль — это кристалл, который можно выращивать в различных формах. | ВНИМАНИЕ |
| Что Нужно ли мне? | . |
| • о 1/4 стакана поваренной соли | Сделал Ты знаешь? Во всем мире можно найти много разных видов соли, и некоторые повара платят высокую цену за экзотические соли, такие как fleur de sel из Франции или черная лавовая соль с Гавайев. |
| • о 1 стакан воды | |
| • о компании 3 фута хлопковой нити | |
| • а небольшой пластиковый стаканчик или баночка, который не тает при наливании горячей жидкости в него (мы использовали дно бутылки с содовой емкостью 20 унций, но любой контейнер сделаю) | |
| • а кастрюля | |
| • еда окраска (необязательно; она окрашивает кристаллы соли) | |
| • а поднос или тарелка для чашки | |
| • газеты или бумажные полотенца положить по проекту | |
| Что Я делаю? | |
| Наконечник Поделиться |
2. Кому | |
3. | |
4. Уйти | |
5. | |
| Что такое Продолжается? | . |
Когда Точка насыщения разная при разных температурах. В Когда вы готовите партию соленой воды, вы готовите соль, воду и Перенасыщение — нестабильное состояние. Молекулы соли начнутся | |
| Что Еще можно попробовать? | . |
• Вы можете выращивать кристаллы самых разных размеров и форм, подвешивая |

 Насыщенный раствор всегда должен находиться в равновесии с кристаллическим компонентом (осадком). Концентрация этого компонента в растворе называется его растворимостью. Раствор, в котором концентрация этого компонента ниже его растворимости, называется ненасыщенным.
Насыщенный раствор всегда должен находиться в равновесии с кристаллическим компонентом (осадком). Концентрация этого компонента в растворе называется его растворимостью. Раствор, в котором концентрация этого компонента ниже его растворимости, называется ненасыщенным.  Иногда растворимость выражают числом граммов растворенного вещества, приходящихся на 100 г растворителя.
Иногда растворимость выражают числом граммов растворенного вещества, приходящихся на 100 г растворителя. 6.1).
6.1).  Эта масса нитрата калия приходится на 100 – 26,04 = 73,96 г воды в насыщенном растворе. Составляем соотношение:
Эта масса нитрата калия приходится на 100 – 26,04 = 73,96 г воды в насыщенном растворе. Составляем соотношение: При повторной перекристаллизации чистота вещества повышается.
При повторной перекристаллизации чистота вещества повышается. 
 Даже самая чистая на Земле вода озера Байкал содержит соли, которые вымываются из горных пород и почв втекающими в озеро реками. Дождь и вода растаявшего снега – не совершенно чистая вода, а вода, содержащая 10–20 мг растворенных веществ на 1000 г воды. Тем не менее такую воду вполне можно использовать в технических целях, когда требуется дистиллированная вода, например для приготовления раствора серной кислоты для автомобильного аккумулятора.
Даже самая чистая на Земле вода озера Байкал содержит соли, которые вымываются из горных пород и почв втекающими в озеро реками. Дождь и вода растаявшего снега – не совершенно чистая вода, а вода, содержащая 10–20 мг растворенных веществ на 1000 г воды. Тем не менее такую воду вполне можно использовать в технических целях, когда требуется дистиллированная вода, например для приготовления раствора серной кислоты для автомобильного аккумулятора. 
 Максимальная глубина – Объем озера – 23 000 км 3 . Воды Байкала прозрачны до 40 м. В Байкале содержится 1/5 мировых запасов пресной воды.
Максимальная глубина – Объем озера – 23 000 км 3 . Воды Байкала прозрачны до 40 м. В Байкале содержится 1/5 мировых запасов пресной воды. Вода Мертвого моря и грязи побережья обладают высокими лечебными свойствами. Воздух моря насыщен парами брома и йода.
Вода Мертвого моря и грязи побережья обладают высокими лечебными свойствами. Воздух моря насыщен парами брома и йода. Окрестности озера известны тем, что в 1947 г. в пещерах пустынной местности Кумран на западном побережье Мертвого моря юноша кочевого племени бедуинов при поиске сбежавшей козы нашел глиняные сосуды с кожаными свитками древних рукописей, описывающих историческую обстановку (2000 лет назад) возникновения христианства. Эти рукописи названы кумранскими по месту их находки.
Окрестности озера известны тем, что в 1947 г. в пещерах пустынной местности Кумран на западном побережье Мертвого моря юноша кочевого племени бедуинов при поиске сбежавшей козы нашел глиняные сосуды с кожаными свитками древних рукописей, описывающих историческую обстановку (2000 лет назад) возникновения христианства. Эти рукописи названы кумранскими по месту их находки. Ниже приведен химический состав нарзана (г/л) одного из источников Кисловодска:
Ниже приведен химический состав нарзана (г/л) одного из источников Кисловодска:
 Добейтесь растворения избыточной массы вещества в заданном объеме раствора путем изменения внешних условий (как это сделать в конкретном случае?). Приведите приготовленный раствор к стандартным условиям и, в случае кристаллизации избытка растворенного вещества, отфильтруйте. Определите плотность насыщенного раствора по методике, описанной ниже.
Добейтесь растворения избыточной массы вещества в заданном объеме раствора путем изменения внешних условий (как это сделать в конкретном случае?). Приведите приготовленный раствор к стандартным условиям и, в случае кристаллизации избытка растворенного вещества, отфильтруйте. Определите плотность насыщенного раствора по методике, описанной ниже.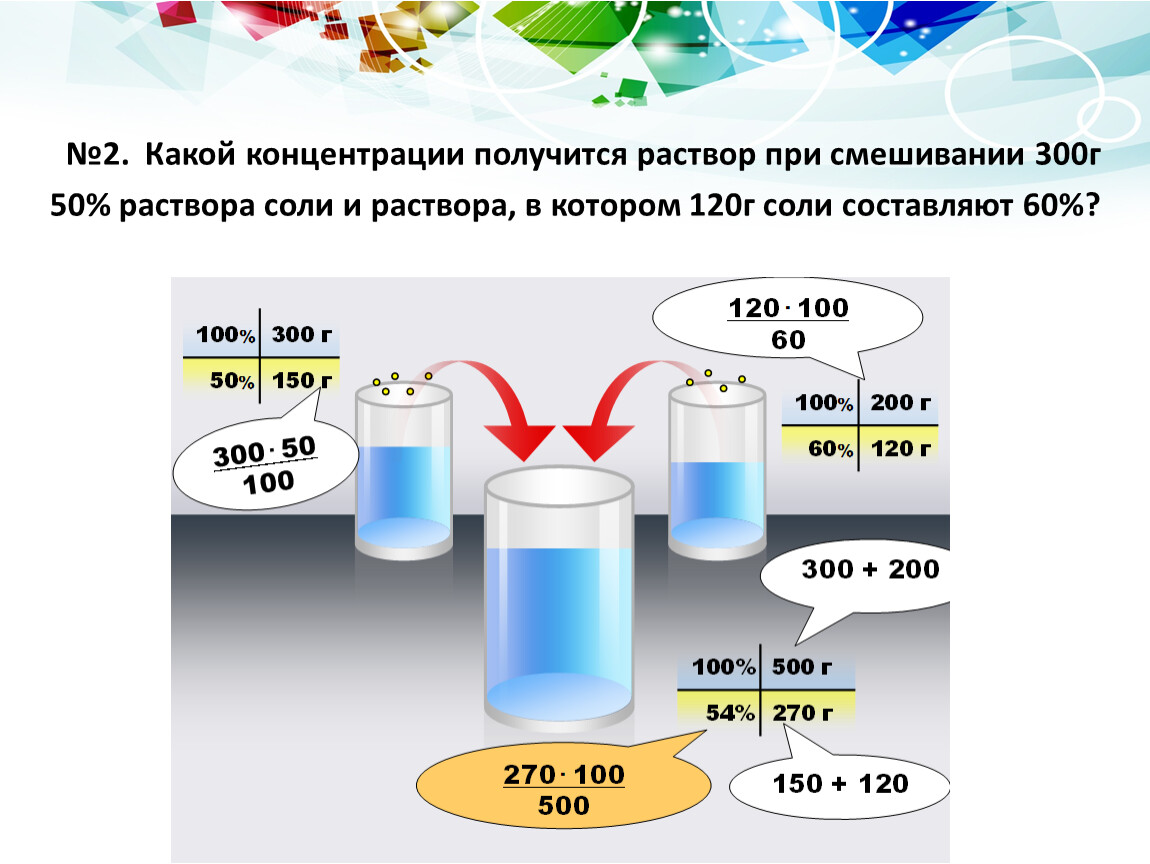 Ареометр отпускается и по нижнему уровню мениска раствора на шкале ареометра производится отсчет плотности. В случае, если ареометр всплывает или уровень раствора не доходит до шкалы, следует использовать ареометр со шкалой, рассчитанной на большую плотность. Если ареометр тонет в растворе или уровень жидкости оказывается выше проградуированной шкалы, воспользуйтесь ареометром, рассчитанным на меньшую плотность.
Ареометр отпускается и по нижнему уровню мениска раствора на шкале ареометра производится отсчет плотности. В случае, если ареометр всплывает или уровень раствора не доходит до шкалы, следует использовать ареометр со шкалой, рассчитанной на большую плотность. Если ареометр тонет в растворе или уровень жидкости оказывается выше проградуированной шкалы, воспользуйтесь ареометром, рассчитанным на меньшую плотность. Отобрать необходимый (рассчитанный) объем раствора с помощью пипетки и перенести в мерную колбу. Довести объем до метки добавлением дистиллированной воды. Правильность приготовления раствора проверить по плотности (См. справочник Ю.Ю.Лурье).
Отобрать необходимый (рассчитанный) объем раствора с помощью пипетки и перенести в мерную колбу. Довести объем до метки добавлением дистиллированной воды. Правильность приготовления раствора проверить по плотности (См. справочник Ю.Ю.Лурье). Охладить раствор до температуры окружающей среды.
Охладить раствор до температуры окружающей среды. В таблице же указаны плотности 1,241 и 1,263, которым соответствуют концентрации 22% и 24%. Следовательно, изменению концентрации на 2% соответствует изменение плотности на величину 1,263-1,241 = 0,022. Наш раствор отличается по плотности от 1,241 на величину равную 0,006 (1,247-1,241). Составляем пропорцию:
В таблице же указаны плотности 1,241 и 1,263, которым соответствуют концентрации 22% и 24%. Следовательно, изменению концентрации на 2% соответствует изменение плотности на величину 1,263-1,241 = 0,022. Наш раствор отличается по плотности от 1,241 на величину равную 0,006 (1,247-1,241). Составляем пропорцию: Раствором кислоты с точно известной концентрацией ополоснуть бюретку. Для заполнения бюретки раствором необходимо использовать воронку. Затем заполнить бюретку раствором кислоты так, чтобы мениск раствора совпадал с нулевым делением бюретки. Носик бюретки должен быть полностью заполнен жидкостью (не должно быть пузырьков воздуха). Тщательно вымытую пипетку на 5 мл ополоснуть анализируемым раствором щелочи, приготовленным в первом опыте. Затем этой пипеткой отобрать 5 мл раствора щелочи в коническую колбу для титрования (последние капли из пипетки удалить, коснувшись кончиком пипетки стенки колбы, но не выдувать!). Прибавить в колбу 2-3 капли индикатора метилового оранжевого. Какую окраску приобретет раствор? Колбу с раствором поставить на лист белой бумаги и расположить под бюреткой так, чтобы конец ее был погружен в колбу приблизительно на 1 см. Рядом поставить колбу с раствором сравнения (в дистиллированную воду прилить 2-3 капли индикатора). В колбу с раствором щелочи левой рукой по капле прибавлять раствор кислоты из бюретки, постоянно перемешивая правой рукой жидкость вращением колбы.
Раствором кислоты с точно известной концентрацией ополоснуть бюретку. Для заполнения бюретки раствором необходимо использовать воронку. Затем заполнить бюретку раствором кислоты так, чтобы мениск раствора совпадал с нулевым делением бюретки. Носик бюретки должен быть полностью заполнен жидкостью (не должно быть пузырьков воздуха). Тщательно вымытую пипетку на 5 мл ополоснуть анализируемым раствором щелочи, приготовленным в первом опыте. Затем этой пипеткой отобрать 5 мл раствора щелочи в коническую колбу для титрования (последние капли из пипетки удалить, коснувшись кончиком пипетки стенки колбы, но не выдувать!). Прибавить в колбу 2-3 капли индикатора метилового оранжевого. Какую окраску приобретет раствор? Колбу с раствором поставить на лист белой бумаги и расположить под бюреткой так, чтобы конец ее был погружен в колбу приблизительно на 1 см. Рядом поставить колбу с раствором сравнения (в дистиллированную воду прилить 2-3 капли индикатора). В колбу с раствором щелочи левой рукой по капле прибавлять раствор кислоты из бюретки, постоянно перемешивая правой рукой жидкость вращением колбы. Колбу из-под бюретки не выносить. Конец реакции определить по мгновенному изменению окраски раствора щелочи. В результате этого опыта устанавливают с точностью до 1 мл количество кислоты, необходимое для нейтрализации щелочи. Титрование повторяют не менее 3 раз. Результат первого опыта считается как ориентировочный и при расчете не учитывается. При последующих титрованиях сначала быстро прибавляют из бюретки в колбу необходимое для нейтрализации количество кислоты за исключением последнего миллилитра, который добавляют в раствор по каплям до тех пор, пока от прибавления одной капли не произойдет изменение окраски раствора.
Колбу из-под бюретки не выносить. Конец реакции определить по мгновенному изменению окраски раствора щелочи. В результате этого опыта устанавливают с точностью до 1 мл количество кислоты, необходимое для нейтрализации щелочи. Титрование повторяют не менее 3 раз. Результат первого опыта считается как ориентировочный и при расчете не учитывается. При последующих титрованиях сначала быстро прибавляют из бюретки в колбу необходимое для нейтрализации количество кислоты за исключением последнего миллилитра, который добавляют в раствор по каплям до тех пор, пока от прибавления одной капли не произойдет изменение окраски раствора. Данные занести в таблицу 3.
Данные занести в таблицу 3. Вычислите массовую долю НСl в растворе кислоты.
Вычислите массовую долю НСl в растворе кислоты.