Питьевая сода теплопроводность: Теплопроводность и электропроводность питьевой соды. Изучение електропроводности водного раствора питевой соды
Содержание
Сода пищевая, Натрий двууглекислый, Бикарбонат натрия
Сода пищевая (сода питьевая, натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия) ГОСТ 2156-76
представляет собой кристаллический порошок тонкого помола, белого цвета, без запаха, солоноватого (мыльного) вкуса, который при попадании на слизистые оболочки вызывает раздражение. Легко растворяется в воде. Является кислой натриевой солью угольной кислоты и натрия. Реагирует с кислотами с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду. При температуре 60° C пищевая сода распадается на карбонат натрия, углекислый газ и воду.
Отличительной особенностью является мягкие щелочные свойства, не оказывающие вредного воздействия на животные и растительные ткани.
Плотность — 2,159 г/см³. Температура кипения — 851° C, температура плавления — 270° C.
Химическая формула: NaHCO3. Сертификат
В природе сода встречается в твердом виде в небольших залежах в составе минерала трона, в виде раствора — в воде некоторых содовых озер и щелочных минеральных источников и в золе некоторых растений.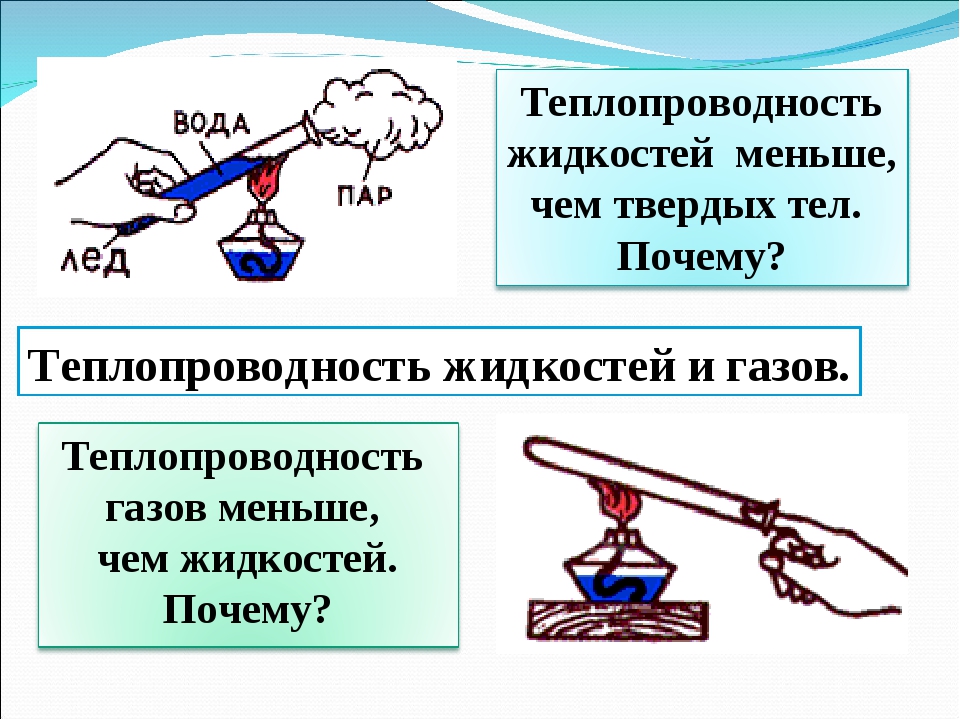 В промышленности пищевую соду получают как промежуточный продукт при производстве кальцинированной соды аммиачным способом (т.н. способом Сольве).
В промышленности пищевую соду получают как промежуточный продукт при производстве кальцинированной соды аммиачным способом (т.н. способом Сольве).
Применение пищевой соды.
Пищевая сода широко применяется в различных отраслях промышленности, народного хозяйства и в быту. Используется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии и др.
В пищевой промышленности она зарегистрирована как пищевая добавка E500. Основное применение — кулинария, хлебопечение, производство кондитерских изделий, где он применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке, самостоятельно или в составе комплексных разрыхлителей и в готовых смесях для выпечки. Также применяется при производстве газированных напитков.
В медицине раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке.
В химической промышленности используется для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей. Также входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Также входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
В легкой промышленности гидрокарбонат натрия применяется в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
В быту используется как великолепное средство для чистки, мытья и удаления пятен и накипи. Пищевая сода прекрасно удаляет неприятные запахи, освежает и очищает ковры, удаляет затхлый запах старых книг. В лечебных целях пищевую соду используют при ожогах, в том числе солнечных. Она — скорая помощь и при пчелином или осином укусе.
Подробно: История, технологии производства, свойства и применение пищевой соды.
Физико-химические показатели* пищевой соды ГОСТ 2156-76:
| Наименование показателя | Норма для сорта | ||
| Первый | Второй | ||
| Внешний вид | Кристаллический порошок белого цвета, без запаха | ||
| Массовая доля двууглекислого натрия (NaHCO3), %, не менее** | 99,5 | 99,0 | |
| Массовая доля углекислого натрия (Na2CO3), %, не более** | 0,4 | 0,7 | |
| Массовая доля хлоридов в пересчете на NaCl, %, не более** | 0,02 | 0,04 | |
| Массовая доля мышьяка (As), %, не более | Выдерживает испытание | ||
| Массовая доля не растворимых в воде веществ, %, не более | Выдерживает испытание | ||
| Массовая доля железа (Fe2+), %, не более** | 0,001 | 0,005 | |
| Массовая доля кальция (Ca2+), %, не более | 0,04 | 0,05 | |
| Массовая доля сульфатов в пересчете на SO42-, %, не более | 0,02 | 0,02 | |
| Массовая доля влаги, %, не более | 0,1 | 0,2 | |
Требования безопасности пищевой соды.
Сода пищевая не токсична, пожаро- и взрывобезопасна, по степени воздействия на организм относится к веществам 3-го класса опасности. Предельно допустимая концентрация двууглекислого натрия в воздухе рабочей зоны составляет 5 мг/м³.
| Степень токсичности | — |
| Основные свойства и виды опасности | |
| Основные свойства | Мелкокристаллический порошок белого цвета, без запаха. |
| Взрыво- и пожароопасность | Пожаро- и взрывобезопасен. Негорюч. При нагревании может разлагаться с образованием токсичных газов. Емкости могут взрываться при нагревании. |
| Опасность для человека | Сода пищевая опасна при попадании на кожу и в глаза. При попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей. При пожаре возможны ожоги. |
| Средства индивидуальной защиты | Защитный общевойсковой костюм Л-1 или Л-2 в комплекте с промышленным противогазом с патронами А, В. Маслобензостойкие перчатки, специальная обувь. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20. Спецодежда, предохранительные приспособления. Маслобензостойкие перчатки, специальная обувь. При возгорании — огнезащитный костюм в комплекте с самоспасателем СПИ-20. Спецодежда, предохранительные приспособления. |
| Необходимые действия в аварийных ситуациях | |
| Общего характера | Отвести вагон в безопасное место. Изолировать опасную зону в радиусе не менее 100 м. Откорректировать указанное расстояние по результатам химразведки. Удалить посторонних. Соблюдать меры пожарной безопасности. Не курить. Пострадавшим оказать первую помощь. |
| При утечке, разливе и россыпи | Сообщить в ЦСЭН. Не прикасаться к пролитому или просыпанному веществу. Не допускать попадания вещества в водоемы, подвалы, канализацию. |
| При пожаре | В зону аварии входить в защитной одежде и дыхательном аппарате. Тушить тонкораспыленной водой, воздушно-механической пеной с максимального расстояния. |
| Нейтрализация | Засыпать песком или другим инертным материалом. Выжечь территорию (отдельные очаги) при угрозе попадания в грунтовые воды. Вызвать специалистов для нейтрализации. Выжечь территорию (отдельные очаги) при угрозе попадания в грунтовые воды. Вызвать специалистов для нейтрализации. |
| Меры первой помощи | Вызвать скорую помощь. Свежий воздух, покой, тепло, чистая одежда. Глаза и слизистые промывать водой не менее 15 минут. |
Упаковка, транспортировка и хранение.
Пищевую соду упаковывают в четырехслойные или пятислойные бумажные мешки массой до 50 кг или в специализированные контейнеры разового использования типа МКР-1,0 с полиэтиленовым вкладышем, массой не более 1 тонны. Двууглекислый натрий (натрий бикарбонат), предназначенный для розничной торговли, упаковывают в потребительскую тару — картонные пачки массой 500 и 1000 г, полиэтиленовые пакеты массой 500 г.
Соду пищевую транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах в соответствии с правилами перевозки грузов, действующими на транспорте данного вида. Допускается транспортирование двууглекислого натрия автомобильным транспортом навалом с использованием специализированного транспорта (типа муковоза) или в специально изготовленных емкостях из нержавеющей стали. Специализированные мягкие контейнеры транспортируют по железной дороге открытым подвижным составом повагонными отправками без перевалок, с погрузкой и выгрузкой на подъездных путях грузоотправителя (грузополучателя).
Специализированные мягкие контейнеры транспортируют по железной дороге открытым подвижным составом повагонными отправками без перевалок, с погрузкой и выгрузкой на подъездных путях грузоотправителя (грузополучателя).
Соду пищевую хранят в закрытых складских помещениях. Заполненные специализированные мягкие контейнеры и транспортные пакеты хранят как в крытых складских помещениях, так и на открытых площадках, в 2-3 яруса по высоте.
Гарантийный срок хранения продукта — 12 месяцев со дня изготовления.
ООО “Компани “Плазма”® осуществляет поставки соды пищевой в мешках и в пачках со склада в Харькове в сроки и, на выгодных для Вас условиях.
Кальцинированная (бельевая) сода, что это? Как пользоваться?. Домоводство. Хобби. Общественная жизнь клуба. «Самита клуб»
Кальцинированная сода (Na2CO3) имеет несколько названий: карбонат натрия, углекислый натрий, бельевая сода, натриевая соль угольной кислоты – всё это названия одного и того же вещества. Просьба не путать с пищевой содой и каустической, все 3 вещества являются щелочами, но отличаются по своей силе и свойствам.
- Пищевая сода имеет практически нейтральную реакцию (pH-8.1) её используют для приготовления пищи и для других бытовых целей.
- Кальцинированная сода имеет более щелочную реакцию (pH-11) её не применяют в пищевой промышленности, только для бытовых и промышленных нужд
- И наконец, каустик, он же едкий натр – это самая сильная из 3 щелочей (pH-13), она с лёгкостью растворяет жир, бумагу, кожу, и другую органику, при попадании на кожу и слизистые вызывает серьёзные химические ожоги, для «домашних» целей его используют с особой осторожностью.
Выглядит карбонат натрия как белый порошок. Приобрести его можно в отделах бытовой химии и хозяйственных магазинах.
Меры предосторожности
- Это вещество обладает сильным обезвоживающим и жирорастворяющим свойством, в концентрированно
м виде может вызвать щелочной ожог, попадая в ранки – жжёт и щиплет. Кроме того сильно сушит кожу рук, поэтому во время работы с карбонатом натрия надевайте резиновые перчатки. 
- Храните пачку вдали от пищевых продуктов.
- Бельевую соду не используют в кулинарии и смягчения воды для готовки.
- В сыром помещении порошок вбирает в себя влагу и меняет свойства, а на открытом воздухе слёживается и комкуется, поэтому храните пачку в сухом месте в герметичной таре.
- Следите, чтобы коробка находилась в недосягаемом для маленьких детей и домашних животных месте, иначе может случиться беда. Порошок соды довольно лёгкий и разлетается в разные стороны, попадая в глаза, носоглотку и лёгкие. Если вдруг такое произошло нужно сразу же смыть порошок, при проглатывании дать пострадавшему выпить стакан воды и срочно ехать в поликлинику.
- Чем горячее раствор соды, тем активнее вещество и если вы спокойно стирали с содой в прохладной воде, то та же концентрация при более высокой температуре способна вызвать раздражение кожи или даже химический ожог.
- Карбонат натрия не может вызвать пожар или взрыв, но по воздействию на организм его относят к 3 классу опасности.

- Соединяясь с водой, вещество становится химически более активным, поэтому не рекомендуется использовать кальцинированную соду во влажных помещениях.
В холодной воде образует хлопья, поэтому лучше использовать тёплую.
Применение кальцинированной соды в быту
С помощью карбоната натрия можно:
- Удалить накипь из чайника.
- Замочить, постирать, выварить и отбелить бельё, удалить пятна
- Приготовить гель для стирки
- Очистить духовку от застарелого жира, помыть газовую плиту, раковину, кафель
- Помыть посуду
- Использовать вместо CALGON
- Прочистить засорившиеся трубы
- Смягчить воду
- Помыть пол
- Избавиться от плесени в стиральной машине
- Снять старую краску
- Обеззаразить помещение. Кальцинированная сода широко применяется для дезинфекции на предприятиях общепита, в санаториях и поликлиниках, а так же в сельском хозяйстве.
- Садоводы используют её для борьбы с сорняками, вредителями и заболеваниями растений.

Замачивание белья
Замачивание и отбеливание 2 в 1. Положите белое бельё на ночь в тазик с тёплой водой с добавлением бельевой соды (3 ст. л. на ведро воды), перед замачиванием натрите ткань хозяйственным мылом, «Антипятином» или «DURU», если нет времени, но есть готовая мыльная стружка, то можно просто добавить её в воду. Наутро бельё будет выглядеть таким же серым, как и раньше, просто постирайте его в машинке, выбрав подходящую программу, и когда закончится стирка, вы достанете белоснежные вещи.
Можно ли использовать кальцинированную соду для цветного белья? Да можно, но не более 3-5 столовых ложек на 10 литров воды. Вода для стирки цветного не должна быть слишком горячей 30-40°С в самый раз. Вываривать цветное бельё вообще не рекомендуют тем более с бельевой содой.
Ручная стирка
Карбонат натрия незаменимый помощник, когда речь идёт о стирке рабочей одежды, ему под силу отстирать пятна бензина, мазута, машинного масла, парафина. Работникам общепита, чьи халаты и фартуки покрываются ежедневно пятнами заварного крема, жиром и соусами стоит держать пачку бельевой соды рядом со стиральной машиной, своевременное использование этого средства позволит сэкономить немало сил и нервов, не говоря уже о средствах, ведь кальцинированная сода намного дешевле промышленных пятновыводителей
Карбонат натрия отлично подходит для стирки и отбеливания тканей из растительного сырья: хлопок и лён. Как раз домашний текстиль, который пачкается сильнее всего: кухонные полотенца, хлопковые и льняные скатерти, постельное бельё. А вот шерстяные и шёлковые вещи не любят щелочную среду и от этого становятся жёсткими, хрупкими и быстро портятся. Что касается синтетики, то в зависимости от состава ткани эффект может быть непредсказуемым. Не стоит рисковать, ведь синтетические вещи хорошо отстирываются и обычным стиральным порошком.
Внимание! Категорически запрещается стирать кальцинированной содой прорезиненные ткани, дерматин, материалы с разными пропитками или мембранной поверхностью.
Машинная стирка
В состав современных бесфосфатных порошков входит карбонат натрия, он не вызывает аллергии, относительно безопасен для окружающей среды и полностью разлагается. Зная это, мы можем значительно увеличить эффективность даже недорого стирального порошка. Насыпьте порошок как обычно, а в барабан добавьте 3 ст. л. кальцинированной соды (если у вас сильно жёсткая вода или вещи сильно грязные, то количество можно увеличить до 5 ложек). Выбирайте температурный режим от 50 до 100°С и помните о том, что чем выше температура воды, тем активнее щёлочь будет удалять загрязнения.
л. кальцинированной соды (если у вас сильно жёсткая вода или вещи сильно грязные, то количество можно увеличить до 5 ложек). Выбирайте температурный режим от 50 до 100°С и помните о том, что чем выше температура воды, тем активнее щёлочь будет удалять загрязнения.
Кипячение
Вываривание используют в самых сложных случаях, для отбеливания, удаления застарелых пятен и дезинфекции белья. Чаще всего кипячение заменяют стиркой в машине-автомат на высокой температуре, но если у вас машинки нет, то придётся по старинке воспользоваться вываркой и деревянными щипцами.
Кроме состава важную роль играет посуда, в которой вываривают бельё, для этой цели подойдёт большая эмалированная кастрюля или выварка из оцинкованной стали. Категорически нельзя вываривать бельё в медных или алюминиевых тазах или эмалированных ёмкостях со сколами, если пренебречь этими правилами, то бельё может покрыться уродливыми пятнами и ржавыми подтёками. Дно ёмкости застилают ненужной белой тканью.
Вываривание будет ещё эффективнее, если за час до этого натереть влажное бельё хозяйственным мылом. Есть несколько составов для кипячения, каждый из них эффективно справляется с желтизной и пятнами, выбирайте исходя из наличия ингредиентов и свободного времени.
Есть несколько составов для кипячения, каждый из них эффективно справляется с желтизной и пятнами, выбирайте исходя из наличия ингредиентов и свободного времени.
Состав № 1: Ёмкость ставят на огонь и добавляют на 10 литров воды полкило кальцинированной соды и 500 мл. «Белизны» или другого хлорного отбеливателя. Бельё кипятят в течение часа. Это очень эффективное средство, однако, оно не подходит для людей склонных к аллергическим реакциям. Такое вываривание не рекомендуют часто проводить, поскольку хлорка постепенно разрушает волокна ткани и после 3-4 раза на белье могут появиться дырочки.
Не вынимайте горячее бельё, велик риск обжечься, подождите, пока немного остынет. Так же не нужно пытаться снять полную выварку, вынимайте вещи деревянными щипцами, складывайте в миску и несите в ванную полоскать. А выварка без белья не такая уж тяжёлая, к тому же успеет остыть, пока вы полощите бельё.
Состав № 2: Такой состав подойдёт для аллергиков, так же в нём можно кипятить детские вещи. На 10 литров воды нужно 250 грамм мыльной стружки и столько же бельевой соды. Все делаем так же, как описано выше, но кипятим бельё около 2 часов.
На 10 литров воды нужно 250 грамм мыльной стружки и столько же бельевой соды. Все делаем так же, как описано выше, но кипятим бельё около 2 часов.
Состав № 3: Те же ингредиенты что и для второго состава, но дополнительно добавляют по 2 столовых ложки нашатыря и перекиси водорода, благодаря этому время кипячения сокращается до 40 мин.
Внимание! Цветное бельё вываривать нельзя – оно полиняет, так же не стоит вываривать искусственные ткани, шёлковые и шерстяные вещи.
Рецепт «Домашнего» геля для стирки
Этот гель можно хранить в закрытой банке и использовать для ручной и машинной стирки, а так же удаления пятен. Он не вызывает аллергии и подходит для детских вещей. Его можно готовить с бурой и без неё, в первом случае средство будет обладать выраженным антибактериальны
Это средство подходит только для белого белья, чтобы получить «домашний гель Color» вместо кальцинированной соды используйте пищевую.
Для приготовления нам понадобится кастрюля, которую вы не используете для готовки, ложка, вода, кальцинированная сода, хозяйственное мыло 72% (можно использовать «Детское», «Ушастый нянь», «Антипятин», «Дегтярное» или «Антибактериально
Приготовление:
- Налейте в кастрюлю пол литра воды и добавьте 150 гр. тёртого мыла, нагревайте, непрерывно помешивая, чтобы мыло полностью растворилось, следите, чтобы смесь не закипела.
- Добавьте 150 гр. кальцинированной соды и столько же порошковой буры (тетраборат натрия).
- Добавьте ещё 2 литра воды и нагревайте, постоянно помешивая, важно, чтобы все компоненты растворились полностью, так гель не будет оставлять на одежде белёсых следов.
- Разлейте остывшую жидкость в подходящие баночки и поставьте в прохладное место, через сутки гель загустеет, и его можно будет использовать.
- Достаточно всего полстакана средства, его кладут прямо в барабан стиральной машины или используют для ручной стирки.

Смягчение воды
Чтобы смягчить воду для стирки, кстати, такую воду можно наливать в резервуар утюга вместо дистиллированной и тогда вам значительно реже придётся чистить утюг от накипи. Растворяют в 10 л. воды 2-3 ст.л. кальцинированной соды и хорошо перемешивают, через некоторое время на дне появляется белый осадок – это «связанные» соли кальция и кальция и магния. Чистую воду используют для бытовых целей, а осадок сливают в канализацию.
Внимание: воду смягчённую таким способом нельзя пить или готовить на ней пищу. Чтобы получить воду для купания и питья кальцинированную соду заменяют обычной пищевой, пропорции те же.
Кальцинированная сода вместо CALGON
Нужен ли на самом деле CALGON или опасность накипи – это удачная идея маркетологов? И, да и нет. Дело в том, что жёсткая вода действительно способна вывести машинку из строя, но это только часть правды.
Дело в том, что накипь образуется во время стирки на высокой температуре, от 60°С, так что если вы стираете на 40 то CALGON вам не нужен. К тому же, в состав современных стиральных порошков входят компоненты смягчающие воду. Ведь каждому производителю известно то, что порошки плохо отстирывают в «жёсткой» воде, а конкуренция вынуждает заботиться о качестве своего товара.
К тому же, в состав современных стиральных порошков входят компоненты смягчающие воду. Ведь каждому производителю известно то, что порошки плохо отстирывают в «жёсткой» воде, а конкуренция вынуждает заботиться о качестве своего товара.
Так ли хороша мягкая вода? Бельё значительно лучше отстирывается в мягкой воде, сокращается расход моющих средств. ТЭН стиральной машины быстрее нагревается, когда на нём нет слоя накипи, что позволяет экономить электроэнергию. Но с другой стороны слишком «мягкая» вода приводит к коррозии металлических частей машинки и постепенно разрушает канализационные трубы. К тому же прополоскать бельё в мягкой воде очень сложно, образуется слишком много пены. Поэтому смягчая воду нужно соблюдать точную дозировку средств.
Что же касается непосредственно CALGONа, давайте взглянём на состав продукта и проверим хотя бы с помощью Википедии, что там за ингредиенты. Состав: Na2CO3 – стиральная сода и Na3PO4 – фосфат натрия.
Открываем Википедию и читаем: Na2CO3 – карбонат натрия, он же кальцинированная сода. Na3PO4 – фосфат натрия, это вещество входит в состав большинства стиральных порошков, но во многих европейских странах оно запрещено, так как вызывает повышенную эвтрофикацию водоёмов. Выражаясь простым языком: этот процесс характеризуется всплеском жизненной активности водорослей, планктона, микроорганизмов (в том числе и болезнетворных) которые выделяют токсичные вещества, от этого гибнет рыба, травятся животные и люди. Как это отражается на вашей машинке? Плесень, микробы и запах.
Na3PO4 – фосфат натрия, это вещество входит в состав большинства стиральных порошков, но во многих европейских странах оно запрещено, так как вызывает повышенную эвтрофикацию водоёмов. Выражаясь простым языком: этот процесс характеризуется всплеском жизненной активности водорослей, планктона, микроорганизмов (в том числе и болезнетворных) которые выделяют токсичные вещества, от этого гибнет рыба, травятся животные и люди. Как это отражается на вашей машинке? Плесень, микробы и запах.
Имея эту информацию, вы можете решить для себя сами, нужен вам CALGON или нет, а для смягчения воды достаточно добавить в барабан 3-5 столовых ложек кальцинированной соды, так вы сможете сэкономить и не навредить окружающей среде. С помощью карбоната натрия вы можете избавиться от плесени в стиральной машине, он так же уничтожает микробы, водоросли, скользкий налёт на внутренней поверхности машинки и неприятные запахи. Именно поэтому, его активно используют в садоводстве и для дезинфекции помещений.
Кальцинированная сода на кухне
Очистка сковородок от нагара
Мы расскажем о том, как с помощью кальцинированной соды очистить столовые приборы, эмалированную и керамическую посуду от пригоревшего жира, желтизны и накипи.
Этот способ использовали ещё наши бабушки, когда в магазинах не было такого изобилия моющих и чистящих средств. Кальцинированная сода благодаря своим жирорастворяющим свойствам справляется с застарелым жиром не хуже, а иногда даже лучше современной бытовой химии.
Для очистки понадобится большая металлическая кастрюля, таз или выварка. Складываем в ёмкость посуду, которую нужно очистить, наливаем воду, так, чтобы наши кастрюли и сковородки полностью покрыла вода, и включаем газ. Добавляем пачку кальцинированной соды и 2-3 пузырька силикатного клея, натёртый кусок хозяйственного мыла (не обязательно). Так же в таз можно сложить самые грязные ложки, вилки, половники и прочие столовые приборы.
Время засекают, как только закипит вода. В зависимости от сложности загрязнения кипятят от 20 минут до 3 часов. Утварь извлекают по несколько штук и моют обычной губкой для посуды, даже самые сильные загрязнения смываются без усилий.
Чистка алюминиевой посуды и чугунных сковородок
Производители кальцинированной соды не рекомендуют использовать её для очистки алюминиевой посуды, но многие хозяйки так поступают и хвастают результатом. Мы не поленились узнать, почему именно этого нельзя делать. Оказалось, что сильные кислоты и щёлочи постепенно разрушают алюминий, поэтому в таких кастрюлях не нужно держать крепкие солёные растворы, маринады, кислое молоко, блюда из картофеля и томатов. Как же их чистить? Добавьте в горячую воду обычную пищевую соду (слабая щёлочь не навредит) и немного нашатыря, помойте этим раствором посуду, сполосните проточной водой и вытрите насухо. Тёмные пятна можно удалить, ваткой, смоченной в столовом уксусе.
Что же касается чугунных сковородок, тут всё не так просто, их тоже можно выварить с содой и клеем и получить сверкающую поверхность, но вместе с нагаром сходит и защитный слой. А без него зажарка, блинчики, сырники всё начинает прилипать к сковороде и даже может появиться ржавчина. Восстановить антипригарный слой на чугунной сковородке сложно, но можно, читайте об этом в одной из наших прошлых статей.
Мытьё посуды
Карбонат натрия справляется с жиром не хуже «Fairy», так же легко удаляет нагар, остатки накипи отбеливает пожелтевшую эмаль. Для мытья посуды используют раствор (на литр воды 3 ст. л), не забудьте хорошо пополоскать посуду под проточной водой.
Можно самостоятельно изготовить порошок для стиральной машины, на 1 мытьё нужно 2 чайные ложки порошковой буры (боракса) и столько же карбоната натрия.
Очистка духовки и газовой плиты
Нам понадобится кальцинированная сода 3 ст. л, силикатный клей 1 ст. л (продаётся в хозяйственных магазинах как «жидкое стекло» или в канцелярии, не путайте с клеем ПВА), половина ложки стирального порошка, и стакан воды. Смешиваем все ингредиенты и смазываем получившимся средством варочную поверхность и решётки. Через некоторое время загрязнение размягчится, и вы его легко смоете влажной губкой. В самых сложных случаях смесь наносят вторично, немного увеличивая время воздействия. Этим же составом можно отмыть духовку и противни.
Эта смесь довольно долго может храниться в банке, перед применением нужно перемешать и, если нужно, добавить воды. Можно сделать один раз и всегда иметь под рукой эффективное и не дорогое моющее средство.
Чистка кафеля и сантехники
Легко очистить ванну, унитаз или раковину нам помогут: кальцинированная и пищевая сода, уксус и отбеливатель. Вся процедура занимает полчаса, непосредственно работы на несколько минут, остальное время нужно, чтобы сода успела разъесть загрязнения. Это средство эффективно растворяет мыльные отложения, кожное сало, известковый налёт, мочевой камень (в унитазе) удаляет следы ржавчины вокруг слива и кранов.
Нам понадобится:
- Кальцинированная и пищевая сода по 3 ст. л.
- Треть стакана жидкого отбеливателя и столько же столового уксуса.
- Губка и пульверизатор.
Смешайте пищевую и кальцинированную соду, ополосните ванну, унитаз или раковину водой, влажную губку окунайте в получившийся порошок и наносите на поверхность, можно слегка потереть. Оставьте средство, чтобы сода проникла в грязь и начала её разрушать.
Через полчаса нанесите поверх соды смесь отбеливателя и уксуса, для этого удобно использовать пульверизатор. Не пугайтесь, если средство начнёт шипеть и пениться – это нормально, так и должно быть. Когда реакция завершится, ополосните сантехнику водой из душевой лейки, если остались небольшие пятнышки грязи – потрите их жёсткой стороной посудной губки и они легко смоются.
Для мытья кафеля используют раствор соды (на литр воды 2-3 ст. л.), остатки средства смывают чистой водой.
Засорилась канализационная труба?
Обычно забиваются трубы из-за того, что в слив попадают волосы, кусочки пищи и жир, образуется плотная пробка, мешающая оттоку воды, в застоявшейся воде активно размножаются бактерии и появляется характерный затхлый запах. Засор устранить не сложно, если знать как:
- Нужно вскипятить 3 литра воды и растворить в ней полстакана карбоната натрия.
- Получившуюся смесь вылить в слив (кальцинированна
я сода прекрасно растворяет жир, остатки мыла и другие органические вещества). - Через 30-40 минут открыть кран – проточная вода смоет остатки пробки и средства.
Помыть пол
Для этого 3 ст. л. карбоната натрия разводят в ведре с горячей водой. Мыть пол этим составом нужно в перчатках, после того как протёрли пол с содой, нужно помыть ещё раз чистой водой, чтобы смыть остатки средства. Этим составом можно мыть: кафельную плитку, пол из натурального камня, линолеум.
Нельзя, ни в коем случае, мыть кальцинированной содой деревянный или крашеный пол, лакированный паркет, плитку из стекловолокна, ламинат.
Как снять старую краску с помощью кальцинированной соды?
Для того, чтобы очистить поверхность от старой краски используют такой рецепт:
- Килограмм соды растворите в 4,5 л. воды и нагрейте до 60 градусов (пищевую посуду использовать для этой цели нельзя)
- Ёмкость должна быть наполнена не более чем на треть, потому что во время нагревания раствор пенится. Понемногу добавляйте гашёную известь, смешанную с водой.
- Работают с составом в резиновых перчатках, очках и респираторе.
- Наносят «смывку» на окрашенную поверхность кистью, и когда краска начнёт пузыриться, её соскребают плоским шпателем.
- Средство поможет быстро удалить старую краску с любой поверхности. После того как работа окончена остатки смывают водой или растворителем.
Антисептические свойства
Сода уничтожает болезнетворные микроорганизмы, плесень, бактерии и микроскопические водоросли, если вы используете её для стирки в машине-автомат, то грибок в ней не заведётся и затхлого запаха не будет.
Если плесень появилась раньше, то нужно помыть все доступные детали машинки гелем для стирки на основе бельевой соды, рецепт которого можно прочесть выше, не забудьте отогнуть резиновый уплотнитель на дверце и хорошо вымыть под ним, а так же прогнать машинку вхолостую на максимальной температуре со стаканом этого же геля. Бура в сочетании с кальцинированной содой весьма эффективна против плесени. Это средство пригодится и для того, чтобы отмыть от плесени кафельную плитку.
Здесь можно прочесть о том, как избавиться от плесени на стенах, не сдирая обоев.
Кальцинированную соду используют для дезинфекции на предприятиях, где велик риск заражения работников инфекционными заболеваниями, например в больницах, на предприятиях общепита, в кожевенной промышленности, ветеринарии и сельском хозяйстве. Горячими растворами карбоната натрия обрабатывают поверхности, дезинфицируют прилавки, складские помещения, сыроварни, кипятят инструмент и спец.одежду. Чем горячее вода, тем большими бактерицидными свойствами обладает раствор.
- 80 градусный 2-3% раствор кальцинированной соды убивает вирус ящура в течение часа. Со стрептококками он расправляется за 10 мин., а с кишечной палочкой за 5 мин.
Работая с горячими растворами очень важно соблюдать все меры безопасности, работать в резиновых перчатках и защитных очках.
Что нельзя чистить кальцинированной содой
- Как уже говорилось раньше нельзя стирать бельевой содой шёлк, шерсть, кожаные вещи, ткани с пропиткой, мембранной поверхностью, дерматин и замшу.
- Не нужно чистить щёлочью алюминиевую посуду, воздержитесь и от того, чтобы помыть внутри чугунную сковороду. Холодильник лучше помыть раствором уксуса или пищевой содой, сильная щёлочь может навредить пластиковой поверхности и растворить краску.
- Щёлочь способна испортить деревянную поверхность, лакированный паркет, полировку мебели, ламинат.
- Не нужно мыть щёлочью окрашенные поверхности, краска после такой чистки может слущиться.
- Так же не рекомендуют подвергать воздействию щелочей кирпичную кладку или плитку из стекловолокна.
- В современном мире появилось множество новых материалов, различного рода пластики, ламинированные покрытия и т.д. Мыть их или нет кальцинированной содой вопрос спорный, и зависит от типа материала. Например: линолеум можно мыть, а ламинат нет! Виниловые обои в нашем опыте выдержали воздействие концентрированно
й щелочной пасты, но что с ними будет через полгода после такой чистки, никто не знает. Поэтому не стоит рисковать и мыть кальцинированной содой пластиковые и резиновые изделия, окна из ПВХ, акриловые ванны, дверцы душевых кабинок из триплекса, мебельную обивку из заменителей кожи. - Чем помыть натяжные потолки мы писали раньше, сейчас лишь скажем о том, что щёлочью их мыть НЕЛЬЗЯ!
Опыты
Авторы статьи решили проверить, так ли хороша кальцинированная сода, как её описывают. У нас было 4 разных поверхности, на которых мы тестировали карбонат натрия.
Опыт № 1 Виниловые обои возле электрической плиты, заляпанные толстым слоем застарелого жира. Для борьбы с этим безобразием была использована смесь кальцинированной соды, средства для мытья посуды «Fairy» и немного воды. Что касается самого загрязнения, то имея некоторый опыт, несложно было догадаться, что отмыть этот жир будет очень трудно.
Мы нанесли средство на загрязнение и оставили. Через 15 минут потёрли губкой для посуды, и 70% жира довольно легко удалилось, цвет обоев не пострадал, фактура тоже и было решено нанести пасту ещё раз. После 15-20 мин. воздействия удалось отмыть ещё немного. Средство наносили трижды, и в результате вместо квадратного метра коричневых жирных потёков остался 20 сантиметровый пожелтевший от температуры участок, слегка заляпанный капельками жира, которые не отмылись. Остальное пространство сияло чистотой.
В целом результатом остались довольны, обои отчистили с минимальными усилиями, сомневаюсь, что другие средства справились бы с этой задачей лучше.
Опыт № 2 Мыли окрашенную светлой краской дверь раствором карбоната натрия и «Белизны» с добавлением воды. Нанесли средство, и краска мгновенно пожелтела, состав тут же смыли, но метаморфозы на этом не закончились. Дверь, конечно, стала чистой, но жёлтой, а там где протирали тряпкой, становилась почему-то голубой. Оказалось, что дверь была покрыта несколькими слоями краски, предположительно на нитро основе и сода разъела верхний слой этой краски, она потом ещё несколько минут отлущивалась небольшими кусочками.
Из этого мы сделали вывод, что если нужно снять нитро-краску, то можно вместо вонючих растворителей использовать простую смесь карбоната натрия и хлорки.
Опыт № 3 Электропечка, покрытая многолетним подгоревшим жиром. Пожалуй, это была самая сложная задача. Использовали карбонат натрия, смешанный с хлоркой и со средством для мытья посуды. Процесс проходил в несколько этапов и занял около 3-х часов. Средство наносилось на 20-30 мин. после чего поверхность активно тёрли абразивной стороной губки для мытья посуды и наносили новую порцию смеси. С каждым разом удавалось смыть немного жира.
В конце концов, плита была почти отмыта, но как оказалось, под слоем жира эмаль давно разрушилась, и жир частично выполнял, вместо неё, защитные функции. Чистая, но ободранная плита стала выглядеть лучше, но в местах, где не было эмали, начала биться током.
Опыт № 4 Окрашенная белой масляной краской стена, около которой стояла газовая плита. Средство на основе соды и жидкости для мытья посуды наносили 4 раза с интервалом 15-20 мин. тёрли обратной стороной губки, в результате стена заблестела идеальной чистотой. Остался небольшой жёлтый участок, который пострадал в результате непосредственной близости конфорки.
В этот раз кальцинированная сода справилась идеально. Краску не разъело, только в некоторых местах начал проглядывать нижний слой.
Средство нам понравилось, оно легко отмывает жир и грязь, конечно, пришлось немного потрудиться над запущенными поверхностями, на которых мы тестировали, но такие загрязнения встречаются довольно редко. Не многие современные средства способны отмыть такие многолетние наслоения с первого раза, а те, что могут чаще всего, токсичны или имеют очень резкий запах. Подкупает и дешевизна компонентов нашей смеси. Суммируя все плюсы, было решено покупать кальцинированную соду для бытовых нужд.
Бикарбонат натрия – это мягкая щёлочь, которая хорошо разрыхляет «соли» отложившиеся внутри чайника. Она значительно дешевле промышленных средств и не вредит здоровью. Для усиления эффекта в раствор иногда добавляют соль, уксус или лимонную кислоту. Бывает, что вместо обычной используют кальцинированную соду, с налётом она справляется лучше, но вот безопасной её никак не назовёшь. Как очистить чайник от накипи содой? Мы подскажем вам несколько эффективных рецептов.
Откуда берётся накипь?
Причина появления накипи – соли кальция и магния. Во время кипячения воды, соли выпадают в осадок и образуют твёрдые наросты на внутренней поверхности посуды, котлов, стиральных машин. Вы наверняка слышали о том, что вода бывает «жёсткой» и «мягкой». Это зависит от количества солей, растворённых в ней, чем больше – тем «жёстче». Когда накипью «обрастает» внутренность чайника, то заметно ухудшается вкус напитков, в чашках появляются белые хлопья, вода имеет специфический запах. Это говорит о том, что вам давно пора почистить чайник.
Что плохого в накипи?
Под слоем известкового налёта появляется ржавчина и постепенно разрушает эмаль. Если долго не очищать накипь, то после чистки вы с удивлением обнаружите, что эмали совсем не осталось, а вместо неё только покорёженный заржавевший металл. Теперь посудину можно лишь выбросить или использовать как ёмкость для чистки столовых приборов, чай из такой воды будет со вкусом ржавчины и кусочками отколовшегося металла.
Ничуть не лучше накипь влияет на электрочайник. На донце и стенках остаётся уродливый бурый налёт, но самая большая опасность кроется в том, что соли оседают на ТЭНе и быстро выводят его из строя, кроме всего прочего накипь уменьшает теплопроводность
И самое главное: вода с известковыми хлопьями не может принести пользы нашему организму и здоровью наших близких. Поэтому, дорогие хозяйки, не забывайте время от времени чистить чайник.
Полезные советы:
- Не кипятите одну и ту же воду дважды.
- Накипи станет меньше, если вы не будете оставлять воду в чайнике. К примеру, остывшую питьевую воду можно сразу перелить в стеклянный графин.
- Очищайте чайник вовремя, как только появился белёсый налёт или хотя бы раз в 1-2 недели.
- Так же процесс кальцинирования можно замедлить, если использовать «мягкую» воду например фильтрованную или бутилированную.
- После каждого использования ополаскивайте чайник проточной водой.
Как узнать «жёсткость» бутилированной воды?
Лучше всего использовать «мягкую» или «умеренно жёсткую» воду, кстати, именно она нужна для того, чтобы чай открыл весь свой неповторимый вкус и аромат. Внимательно осмотрите бутыль, на этикетке производитель указывает «жёсткость». Воспользуйтесь таблицей, чтобы выбрать подходящую воду.
Самая мягкая | до 1,5 мг-экв/л |
Мягкая | 1,5–3,0 мг-экв/л |
Умеренно жёсткая | 3,0–6,0 мг-экв/л |
Жёсткая | 6,0–9,0 мг-экв/л |
Самая жёсткая | 9,0 мг-экв/л и выше |
Чем сода лучше «Антинакипина»?
Речь идёт не только о средстве с названием «Антинакипин», но и обо всех аналогах отечественного и импортного производства. В состав обычно входят довольно безобидные органические кислоты (лимонная, адипиновая, сульфаминовая и др.), но иногда и достаточно едкие вещества, а в китайских аналогах может быть вообще всё что угодно.
Инструкция и состав, написанные не на русском языке или их отсутствие должно вас насторожить. Если в составе сказано: «натуральные органические кислоты и вспомогательные вещества» — это значит ничего не сказано! Производитель скрывает от вас состав средства. Должны быть указаны конкретные действующие вещества. Лучше не пользоваться такими подозрительными средствами, а выбрать для очистки что-нибудь более безопасное, например соду или уксус. Ведь воду из чайника вы пьёте сами и поите ею своих детей.
После такой чистки посуда из нержавеющей стали может неожиданно покрыться чёрными пятнами, удалять которые занятие не из приятных. Электрические чайники тоже чистить «Антинакипином» рискованно. Были случаи, когда трилон, входящий в состав средства, разъедал никелированное покрытие нагревательного диска, и чайники приходилось выбрасывать.
Совет: если вы решили воспользоваться «Антинакипином» внимательно изучите инструкцию и соблюдайте дозировки.
Чем хороша сода?
Бикарбонат натрия (пищевая сода) — белый кристаллический порошок, слабая щёлочь, используется в кулинарии, хлебопечении. Как универсальное средство широко применяется в быту, ею легко очистить духовку от жира, отбелить бельё, почистить ванну. Главный плюс средства – его безопасность. Не страшно, если коробка с пищевой содой попадёт в руки к маленькому ребёнку. Во время кипячения она не выделяет едких паров и полностью разлагается при температуре 60 градусов.
Бикарбонат натрия разрыхляет известковый налёт, дезинфицирует поверхность и удаляет запахи, с помощью блюдца с содой можно избавиться от неприятного запаха в холодильнике, не верите? А зря.
Ею чистят эмалированные, стальные, стеклянные, керамические и электрические чайники. Испортить посуду содой невозможно. Радует и то, что после чистки на стенках посуды не остаются вредные для здоровья людей вещества.
Чистим содой, «бабушкины» рецепты
Сода
Этот метод годится для электрических и для обычных стальных, эмалированных и заварочных чайников. Наполните ёмкость водой на 2/3 и добавьте 3 столовые ложки пищевой соды. Прокипятите 20 мин. и оставьте на час. Если слой накипи небольшой, то этой процедуры вполне достаточно, чтобы чайник заблестел как новенький.
Однако для толстого слоя накипи этот способ не подойдёт. Сода, конечно, хороший разрыхлитель, недаром, её используют пекари, но вот известковый налёт полностью убрать она не в силах, хотя и делает его более пористым и рыхлым. Размягчённый налёт можно поскоблить металлической сеткой. Соду часто смешивают с другими компонентами: солью или кислотами (лимон, уксус, лимонная кислота), они усиливают её действие.
Сода с солью
Как очистить чайник от накипи с помощью соды и поваренной соли? Налейте полный чайник воды и добавьте 2 столовые ложки соды и ложку соли, хорошо размешайте и поставьте на огонь. Закипевшую воду сливать не нужно, дайте ей постоять 10-15 минут, чтобы состав успел растворить твёрдую корку накипи.
Помойте внутреннюю поверхность чайника под краном, и удалите остатки налёта губкой для посуды. Хорошо прополощите и налейте свежей воды, прокипятите несколько минут и вылейте, повторите ещё раз, чтобы наверняка смыть остатки накипи.
Такой «домашний» метод довольно эффективен, удавалось отмыть с его помощью очень толстые слои накипи, если случай слишком запущенный, то процесс повторяют заново или используют тройную очистку, о которой речь пойдёт ниже.
Сода и лимонная кислота
Этот простой способ годится для обычных и электрических чайников. Налейте воду и включите чайник, предварительно добавив на каждый литр по 2 чайные ложки соды и лимонной кислоты. Позвольте воде покипеть минут 15 и выключите. Пока вода остывает лимонная кислота, и сода будут разрушать слой известкового налёта.
Примерно через час слейте воду и повторите весь процесс заново. Этот метод даёт хорошие результаты даже в случае, когда другие средства бессильны. Ополосните внутреннюю поверхность чайника водой, если остались небольшие островки накипи – потрите их губкой. Прокипятите чистую воду и слейте, чтобы удалить остатки кислоты и щёлочи. Если у вас электрочайник, осмотрите его внимательно, вся ли накипь сошла с нагревательного элемента? Выньте и прополощите сеточку, поставьте на место и можно пользоваться прибором как обычно.
Тройная очистка
Для работы нам понадобится лимонная кислота, сода и столовый уксус. Суть метода состоит в том, что на слой накипи попеременно воздействуют тремя разными растворами, что делает эту чистку максимально эффективной даже в самых тяжёлых случаях. Итак, начнём:
- Наполните чайник водой и добавьте в неё соду из расчёта 1 ст. л. на литр. Раствор кипятят один час и выливают.
- Приготовьте раствор лимонной кислоты, пропорции и время воздействия такое же, как у соды.
- Для третьего кипячения используют столовый уксус (100 гр. на литр воды), когда раствор прокипит час, е
Насосы для гидроксида натрия (раствора), насосы для соды каустической
Примеры наших насосов для гидроксида натрия
Вариант-1
Технические данные насоса
Характеристика рабочей среды
Материальное исполнение
Электродвигатель
Электродвигатель выполнен для работы при температуре окружающей среды от -20 до +40°С.
Объём поставки
Насос укомплектован электродвигателем, для уплотнения – безнапорной буферной емкостью.
Вариант-2
Технические данные насоса
Характеристика рабочей среды
Материальное исполнение
Электродвигатель
Электродвигатель выполнен для работы при температуре окружающей среды от -20 до +40°С.
Объём поставки
Насос укомплектован электродвигателем, для уплотнения – безнапорной буферной емкостью.
Вариант-3
Технические данные насоса
Тип горизонтальный центробежный насос
Характеристика рабочей среды
Материальное исполнение
Электродвигатель
Электродвигатель выполнен для работы при температуре окружающей среды от -20 до +40°С.
Объём поставки
Насос укомплектован электродвигателем, для уплотнения – безнапорной буферной емкостью.
Вариант-4
Технические данные насоса
Характеристика рабочей среды
Материальное исполнение
Подшипники
Смазка маслом подшипников происходит с помощью лубрикатора постоянной смазки.
Электродвигатель
Объём поставки
Насос укомплектован электродвигателем, рамой основанием, муфтой с защитным кожухом, ответными фланцами (в т.ч. крепеж и прокладки), системой циркуляции по API – план 10 с системой охлаждающей жидкости, с креплениями и трубопроводом.
Вариант-5
Технические данные насоса
Характеристика рабочей среды
Материальное исполнение
Подшипники
Смазка маслом подшипников происходит с помощью лубрикатора постоянной смазки.
Электродвигатель
Объём поставки
Насос укомплектован электродвигателем, рамой основанием, муфтой с защитным кожухом, ответными фланцами (в т.ч. крепеж и прокладки), системой циркуляции по API – план 10 с системой охлаждающей жидкости, с креплениями и трубопроводом.
Вариант-6
Технические данные насоса
Характеристика рабочей среды
Материальное исполнение
Подшипники
Смазка маслом подшипников происходит с помощью лубрикатора постоянной смазки.
Электродвигатель
Объём поставки
Насос укомплектован электродвигателем, рамой основанием, муфтой с защитным кожухом, ответными фланцами (в т.ч. крепеж и прокладки), системой циркуляции по API – план 10 с системой охлаждающей жидкости, с креплениями и трубопроводом.
Эмалированная посуда. Рекомендации по уходу.
Стальная эмалированная посуда, как правило, относительно недорога, проста в уходе и функциональна в использовании. Однако и у нее есть свои слабые места, знание о которых может помочь избежать неприятностей при готовке и продлить жизнь эмалированным кастрюлям.
Эмаль – это стекловидное покрытие, гигиеничное и инертное к большинству агрессивных сред (кислотам и щелочам), содержащихся в продуктах. Но эмаль, как и стекло, боится механических повреждений. При сильных ударах эмаль разрушается и откалывается. Пользоваться эмалированной посудой со сколами категорически нельзя. Перед эмалированием сталь проходит многоступенчатую обработку различными химическими веществами, в том числе и токсичными, и все они будут поступать в пищу через поврежденные участки.
Также нельзя допускать нагревания эмалированной посуды без жидкостей. Перегревание вызывает разрушение эмалированного слоя, и пользоваться такой посудой тоже нельзя. Особенно внимательно нужно относиться к эмалированным чайникам – именно их чаще всего мы забываем на включенной плите.
Эмалированную посуду с жидкостью нельзя оставлять на морозе или в морозилке. Расширение, которому подвергается замерзшая вода, разрушит эмаль. Эмалированная посуда не любит стальные кухонные инструменты и мытье металлическими мочалками и абразивами – лучше использовать деревянные или пластиковые инструменты и мягкие губки с жидкими моющими средствами.
При кипячении воды на стенках эмалированной посуды имеет обыкновение образовываться накипь. Накипь увеличивает время нагревания посуды, и ее необходимо периодически удалять. Лучше всего использовать специальные средства для удаления накипи, подходящие к эмалированной посуде. Также можно пользоваться и народным методом: вскипятить воду, добавить в нее питьевую соду из расчета 2 ст. ложки на 1 л воды и прокипятить раствор в течение 20—25 минут. После этого удалить накипь с помощью губки. Крепкие растворы уксуса в чистке эмалированной посуды лучше не использовать – они могут повредить эмаль.
Эмалированная сталь имеет низкую теплопроводность, поэтому в ней лучше не кипятить молоко, которое будет пригорать к дну кастрюли. Чтобы этого избежать, нужно молоко постоянно мешать, а если оно все так пригорело, то в кастрюлю необходимо налить раствор воды и моющего средства, оставить его на какое-то время (чем сильнее пригорело, тем дольше времени потребуется) и затем вымыть посуду обычной губкой. Этот же метод можно использовать и для удаления других остатков пригоревшей пищи.
При варке овощей (например, свеклы) или вина (при приготовлении глинтвейна) внутренняя поверхность посуды может окраситься. Для удаления налета можно использовать огуречный рассол или прокипятить в посуде кожицу кислых яблок.
Не рекомендуется использовать кастрюли из эмалированной стали больших размеров на маленьких конфорках без рассекателей пламени. В этом случае из-за перепада температур эмаль может потрескаться. Также нельзя горячую посуду ставить под холодный кран – это тоже ведет к разрушению эмали.
© posudka.ru
Читать по теме:
Как почистить эмалированную кастрюлю
Хрусталь — модная классика
Хрусталь – вечная нестареющая классика, украшающая любую квартиру переливами своего блеска и в будни, и в праздники. Мода на хрусталь не проходит уже долгие годы.
Хрусталь — это один из показателей уровня жизни, а также предмет роскоши и пристального внимания коллекционеров.
Что такое хрусталь
Название свое хрусталь получил по аналогии с горным хрусталем, название которого, в свою очередь, образовано от греческого слова «кристаллос», что переводится как «лед». Вероятно, именно чистота и прозрачность этого минерала навеяла грекам ассоциации со льдом.
Создание хрусталя практиковали еще в древнем Египте и Месопотамии на заре стеклоделия.
Однако в современном его виде хрусталь был получен лишь в 1676 году английским мастером Джорджем Рейвенскрофтом. Он добавил в обычное стекло оксид свинца. Целью эксперимента было придание стеклу повышенной прочности. В результате химик получил нечто большее, готовый материал был необычайно прозрачен, а радужный блеск на его гранях завораживал. Неудивительно, что первоначально хрусталь был доступен только знати. Постепенно процесс производства упрощался, и обычные граждане смогли себе позволить украсить свой дом сверкающими изделиями, хотя и по сей день набор хрустальных фужеров негласно свидетельствует о хорошем достатке его владельца.
Основное отличие хрусталя от обычного стекла — это содержание оксида свинца (PbO). Добавление оксида свинца увеличивает преломление и дисперсию света в хрустале.
Неманский хрусталь варится с содержанием оксида свинца строго равным 24% (мировой стандарт). Эта добавка обеспечивает, выражаясь языком ювелиров, «игру света», а также повышает пластичность материала — все это дает возможность подвергать хрусталь огранке и резьбе. Такие процедуры позволяют хрусталю, как и драгоценным камням, более полно проявить свою красоту.
Сейчас производители заменяют свинец на барий, калий и кальций, титан. Однако настоящим хрусталем может называться только то стекло, которое содержит не менее 24% свинца. От этого зависит игра света на гранях изделия, его солидный вес, прозрачность и, как говорят знатоки, «голос». При соприкосновении бокалы создают мелодичный перезвон, а звук от легкого удара по поверхности может длиться около четырех секунд.
При покупке хрусталя или хрустального стекла следует научиться «опознавать» надписи на упаковке: слово «кристалин» (Crystalline) говорит о содержании 1—15% оксида свинца, «хрусталь» (Crystal) — 16—23%, «свинцовый хрусталь» (Full Lead Crystal) — от 24 до 30%.
Конечно, рядового потребителя, не обремененного багажом знаний по химии, но где-то что-то слышавшего о тяжелых металлах, упоминание о свинце может просто напугать. Авторитетные специалисты заявляют, что оксид свинца, входящий в состав настоящего хрусталя, это неактивный свинец и в связанном состоянии, никак не способный повлиять на здоровье человека.
В чем отличие хрусталя от стекла
Хрусталь и стекло — два материала, которые изготавливаются по совершенно разным технологиям и из отличающихся материалов. Именно эти два фактора обуславливают наличие между ними различий, в том числе и в ценовых категориях.
Во-первых, у стекла и хрусталя разная теплопроводность. Стекло на ощупь более теплое и быстро нагревается в руках, хрусталь же охлаждает кожу.
Во-вторых, хрусталь намного прочнее. Его можно разбить, но это сделать сложнее. При разбивании стекло разлетается крупными кусками, хрусталь же разбивается на мелкие осколки. На стекле со временем появляются царапины, трещины, потускнения. С хрусталем этого не происходит.
Кроме того, если смотреть на какой-либо предмет через стекло, изображение будет слегка увеличиваться. Хрусталь же даст раздваивание предмета без увеличения.
Наконец, хрусталь в отличие от стекла имеет характерный звук. Когда соприкасаются два хрустальных изделия, раздается нарастающий, долго звучащий гул. Стекло же издает лишь глухой стук.
Именно все вышеперечисленные факторы делают хрусталь дорогостоящим предметом коллекционирования. При изготовлении хрустальных изделий их всегда украшают гравировкой, тщательно полируют и используют в их украшении золото и матирование.
Каждому напитку — свой бокал
«Без достойной посуды вино теряет половину своей прелести. Пить бургундское из бокала для ликерных вин – то же самое, что слушать симфонический оркестр, заткнув уши!»
Фридрих Зигель ,известный винный критик.
Большинство людей в процессе сервировки праздничного стола сталкивались с такой проблемой, как выбор «правильного» бокала для того или иного сорта вина. И это не удивительно, ведь многие склонны недооценивать важность правильного подбора бокалов и тем самым лишают себя значительной доли удовольствия. Бокалы – одна из самых значительных составляющих в культуре потребления алкогольных напитков. Хороший коньяк и вино нуждаются в правильно подобранном бокале – подобно тому, как каждый, даже самый дорогой бриллиант нуждается в хорошей огранке. Бокал – это своего рода призма, преломляясь сквозь которую, напиток предстаёт перед нами таким, каким задумал его винодел.
Бокалы, фужеры и рюмки для вина
В ресторанах рюмки и бокалы выбирают не только по объему, но и по форме. Ведь вино является благороднейшим напитком, аромат которого во всей полноте раскрывается только в бокале нужной формы.
По форме чаши различают яблокообразные, тюльпанообразные, прямые и выпуклые (развернутые) бокалы.
Яблоко- и тюльпанообразной формы предпочтительны для подачи густых, экстрактивных, выдержанных вин со сложным букетом. Прямые и выпуклые (развернутые) бокалы используются для подачи молодых белых и розовых вин, букет которых менее интенсивный.
Для подачи вермутов и других крепленых и десертных вин, которые хорошо использовать в качестве аперитивов, предпочтительными являются небольшие прямые рюмки с чашечками желудевой формы вместимостью 75 — 90 мл.
Бокалы для белых вин должны иметь небольшую чашу и достаточно высокий черенок ножки, так как белые вина пьют охлажденными. Небольшая вместимость бокала (100 мл) приводит к тому, что вино быстрее выпивается и не нагревается в бокале. Для белых вин предпочтительны бокалы прямой и чуть вытянутой формы. Для выдержанных белых вин можно использовать бокалы тюльпанообразной формы небольшой вместимости.
Размеры бокалов для розовых вин аналогичны размерам бокалов для белых вин, так как розовое вино пьется тоже в охлажденном виде. Розовые вина обычно молодые, свежие, искристые, поэтому края бокалов должны быть развернуты.
Бокалы для красных вин имеют, как правило, яблоко- или тюльпанообразную форму. Для наилучшего восприятия аромата красных вин эти бокалы часто имеют большую вместимость (200— 300 мл) и заполняются примерно до половины. Высота бокала для красного вина может быть ниже высоты бокала для белого вина при гораздо большей вместимости. Красные вина пьют при комнатной температуре, поэтому высота ножки бокала не имеет большого значения.
Декантер
Декантер — это стеклянный или хрустальный сосуд, в который вино наливают перед подачей на стол. Во время декантации происходит процесс аэрации, то есть вина насыщаются кислородом, сглаживаются резкие тона, вкус становится более благородным и насыщенным.
Переливают вино аккуратно, по стенке сосуда, пока в бутылке не останется около двух-трёх столовых ложек напитка. Этим вы отделите вино от осадка, который неизбежно бывает в выдержанных винах, и, довольно часто, в молодых.
Декантируйте вина! Это гораздо правильнее, чем подавать вино на стол прямо в бутылке, как с вкусовой точки зрения, так и с точки зрения эстетичности!
Бокалы для шампанского
Для шампанского существует два вида бокалов, которые совсем не похожи друг на друга: flute и coupe de champagne в форме чаши, или креманка. Flute (в переводе с английского «флейта») – высокий и тонкий бокал на длинной ножке. Его объем – около 180 мл. Узкое горло и высота помогают раскрыть сложный вкус напитка. Из бокалов такой формы следует пить легкое свежее шампанское, сухое или брют.
На первый план в этом случае выходит приятное покалывание от пузырьков. В любом случае шампанское разливают в бокалы на длинной ножке. Это делается специально для того, чтобы рука не касалась чаши и не согревала ее – шампанское пьют охлажденным. Такой бокал дает возможность увидеть игру пузырьков и при этом из-за узкого горлышка не дает пенистой шапке исчезать слишком быстро. Бокалы наполняют шампанским не более чем наполовину, чтобы вкус и аромат напитка полностью раскрылись.
Рюмка «Маргарита»
Рюмка «Маргарита» имеет форму креманки. Помимо коктейля Маргарита и его разновидностей, в этом рюмке можно подавать коктейль Дайкири, а также другие слабоалкогольные тропические коктейли.
Бокал для мартини
Бокал для мартини и коктейлей можно узнать с первого взгляда: он треугольной формы и имеет длинную тонкую ножку. Объем – 180-200 мл. Кроме мартини, в нем также подают коктейли, в которые не требуется добавлять лед.
Коктейльный бокал мартини. Сосуд (martini glass, cocktail glass) предназначен для охлажденных напитков, безо льда. Еще его называют бокал для коктейля, название которого — «Мартини». Данный напиток подают именно в этом сосуде. Предназначен он для охлажденных коктейлей среднего объема. Лед совершенно недопустим для такой формы. Также не используют бокал для напитков в чистом виде. Несмотря на название, даже для вермута «Мартини» он недопустим. Визуально сосуд легко отличить. Стенки бокала образуют широчайшую воронку. Бокал от самого основания начинает стремительно расширяться. Ему не свойственны плавные переходы, отличающие другие виды. Визуально он напоминает треугольник. Изделие имеет тонкую ножку. Это единственный бокал, позволяющий пьющему из него человеку не ощущать температуру содержимого пальцами и, соответственно, не согревать его.
Хайбол
Хайбол (highball) — один из самых распространенных стаканов на сегодняшний день. Он имеет цилиндрическую форму, а объем хайболов составляет обычно 240-350 мл.
Предназначен стакан как и для без-, так и для алкогольных коктейлей. Помимо этого подходит такой стакан для большего числа прохладительных напитков, поэтому он универсален и является незаменимым, наверное, в каждом баре.
Напитки типа «лонгдринк» со льдом и добавлением газировки очень удобно пить именно из хайболов. Часто в кафе и барах в стакане «highball» можно увидеть сок, минеральную воду или содовую
Рюмка
В зависимости от употребляемого напитка, рюмки делят на несколько видов:
Рюмка водочная. Применяется для употребления горькой настойки, наливки или водки. Вместимость водочной рюмки не превышает 50 мл.
Рюмка мадерная. Используется для употребления крепленого (мадера, херес) или десертного (мускат, кагор) вина. Вместимость рюмки, как правило, не превышает 75мл.
Рюмка лафитная. Ее используют для употребления красного, столового вина. Ее вместимость колеблется от 100 до 125 мл.
Рюмка коньячная. Из нее пьют коньяк. Ее вместимость колеблется от 75 до 250 мл.
Рюмка рейнвейная. Ее используют для употребления сухого или полусухого вина. Выпускается на красивой, высокой ножке. Ее вместимость составляет от 100 до 150 мл.
Рюмка ликерная. Используется для употребления ликера. Выпускается на высокой ножке. Вместимость от 25 до 30 мл. Рюмка коктейльная. Используется для употребления коктейлей. Выпускается, как правило, на низкой ножке. Ее вместимость колеблется от 125 до 150 мл.
Коньячный бокал (емкость 240-360 мл.)
Шарообразный бокал на низкой ножке с чашей, по форме напоминающей тюльпан или яблоко, используется для подачи коньяка или бренди. Бокал такой формы идеально ложится в ладонь, что позволяет согревать напиток теплом своих рук, так как только в этом случае коньяк раскроет полностью свой сложный насыщенный аромат, и вы сможете насладиться его мягким гармоничным вкусом.
Правила ухода за изделиями из хрусталя
Как ухаживать за хрустальными изделиями, чтобы сохранить их качества и блеск на долгие годы?
Чистка хрусталя и хрустальных изделий не сложный процесс, но при этом необходимо помнить о некоторых правилах.
- Если посуда из хрусталя не загрязнена слишком сильно, её можно мыть обычным средством для мытья посуды, которое не содержит крупных гранул, и протирать мягкой тряпкой (без ворса)
- Чтобы хрустальная посуда блестела и искрилась, ее нужно ополаскивать в холодной воде, добавив туда уксус (1 ст. ложка на 1 л. воды). Или протереть мягкой тряпочкой, смоченной в спирте или водке. Можно протереть хрусталь кусочком вельвета или бархата.
- При мытье хрусталя запрещается использовать чересчур горячую воду. Она способствует помутнению и образованию трещин.
- Отчистить многочисленные бороздки на резном хрустале поможет мягкая зубная щетка, смоченная в мыльном растворе или в лимонном соке.
- Хрусталь с рисунком из позолоты моют в чистой теплой воде, ополаскивают в растворе уксуса и натирают до блеска хлопчатобумажной или льняной тряпочкой. Применение моющих средств, в данном случае нежелательно, может стереться позолота или рисунок.
- Налёт от цветов внутри хрустальной вазы можно отмыть раствором из крупной соли и уксуса. Эта смесь уберёт мутные разводы внутри сосуда и придаст блеск внешней стороне.
- Для того чтобы отмыть винный осадок, в графин надо налить мыльную воду, добавить туда питьевую соду и оставить на некоторое время. Затем графин тщательно вымыть, резко встряхивая, грязную воду вылить и промыть графин тёплой водой с уксусом.
Виды бокалов и их применение
Бокал для десертных вин или «мадерная» рюмка
Объем – 75-100 мл
Подают для десертных вин, мадеры, портвейна и хереса. Такую рюмку не доливают до края на 0,5-1,0 см.
Коньячный бокал – снифтер
Объем бокала: 250-875 мл
Форма снифтера (от англ. слова «нюхать») разработана специально для раскрытия всех оттенков аромата коньяка. Чаша бокала идеально располагается в ладони, тепло которой полностью раскрывает сложный аромат напитка.
Бокал наполняется до высоты, равной самой широкой части бокала. В снифтерах подаются: бренди, коньяк, кальвадос и арманьяк.
Стакан для виски
Объем – 300 мл
Емкость для виски, как правило, прямой широкий стакан с толстым дном, шести- или восьмиугольной формы. Наполняется такой стакан на 1/3, остальной объем заполняется льдом или содовой. Можно также пить и чистый виски.
Рюмка для водки или стопка
Объем – 50 мл
Подается с водкой, горькими наливками и настойками. Стопка – это рюмка прямого сечения без ножки. Наполняется, не достигая краев на 0,5 см.
Ликерная рюмка
Объем – 25-30 мл
Такая рюмка изготовлена, чаще всего, из цветного стекла и имеет высокую ножку. Из нее пьют исключительно ликеры.
Бокалы для пива
Объем – 300-500 мл
Стеклянная емкость для пива отличается от стаканов для безалкогольных напитков своей формой. Емкость для пива напоминает продолговатый бочонок с узким горлом или похожа на изящный бокал тюльпановидной формы.
Сода химически чистая — Справочник химика 21
Концентрированный раствор едкого натра готовят растворением 50 г химически чистого NaOH, предварительно очищенного от налета соды обмыванием дистиллированной водой. Едкий натр вначале растворяют в небольшом количестве дистиллированной воды в стакане, затем переливают в мерную колбу на 100 мл и доливают до метки. Мутный раствор очищают декантацией или фильтрованием. [c.534]
Какую навеску химически чистой соды нужно взять для определения точной концентрации 0,1 М раствора соляной кислоты при H n0jy330BaHHH полумикробюретки вместимостью 5 мл и ценой деления 0,01 мл Можно лц.при этом использовать метод отдельных навесок, если допустимая относительная погрешность анализа не выше 0,3 % [c.65]
Содо-бикарбонатные и бикарбонатные растворы приготовляли из химически чистой соды и бикарбоната натрия. [c.128]
Согласно Комплексной программе химизации предусмотрено применение в основных технологических процессах катализаторов нового поколения с повышенной активностью, селективностью, надежностью и сроком службы. Широкое использование в различных отраслях народного хозяйства найдут мембранные процессы при разделении жидких и газовых смесей, производстве особо чистых веществ, фотоматериалов, хлора, каустической соды, химических добавок, очистке сточных вод и извлечения из них ценных компонентов. [c.184]
Хроматографическую окись алюминия можно также получать из обычной окиси алюминия следующим образом. К 100 г химически чистой окиси алюминия прибавляют тройное количество жесткой водопроводной воды, перемешивают избыток воды декантируют. Оставшуюся на дне сосуда массу сначала высушивают, а затем в металлическом тигле прокаливают в течение двух часов на сильном пламени газовой горелки. Жесткую воду в принципе можно заменить 0,01 н. раствором бикарбоната натрия (соды). [c.203]
Какую требуется взять навеску химически чистой соды, чтобы на титрование ее до СО2 шло 20—30 мл 0,2 н. раствора НС1 [c.104]
Из растворов щелочей в лабораторной практике чаще всего применяют растворы едкого натра и едкого калия, й продаже они имеются в виде технических, чистых (ч.), чистых для анализа (ч. д. а.) и химически чистых (х. ч.) препаратов. Технический едкий натр часто называют каустической содой. Каустическая сода содержит кроме NaOH заметные количества хлорида натрия, силиката натрия, карбоната натрия и другие примеси. [c.23]
При электролизе с ртутным катодом получают очень чистую каустическую соду. Если на разложение амальгамы натрия направлять дистиллят или очищенную на ионообменных смолах воду, то можно получить химически чистую каустическую соду. [c.264]
Сода кальцинированная (карбонат натрия, или углекислый натрий). Применяется для мойки аппаратуры и подщелачивания среды. В микробиологическом производстве используется синтетическая сода (ГОСТ 5100—64), содержащая 96,8%, химически чистого вещества. [c.84]
В химической промышленности электролиз применяется для получения хлора и каустической соды, хлоратов и перхлоратов, органических соединений, химически чистых водорода и кислорода и других продуктов. [c.120]
Ход работы. Приготовление стандартного раствора сульфата титана. 0,2 г химически чистой двуокиси титана отвешивают на аналитических весах в предварительно взвешенном платиновом тигле. К навеске добавляют 5—6 г бисульфата калия или смеси буры с содой и сплавляют в муфельной печи при температуре 700—800° С. Сплав выщелачивают 5—10%-ным раствором серной кислоты и выливают в мерную колбу объемом 1000 мл. Тигель ополаскивают водой, которую выливают в мерную колбу. Раствор в мерной колбе доводят прибавлением дистиллированной воды до метки. Титр полученного стандартного раствора сульфата титана определяют весовым методом. Для этого из колбы отбирают 100 мл раствора, разбавляют водой до 150 мл и нагревают до температуры 60—70° С. К раствору добавляют аммиак до щелочной реакции по метил-красному. Образовавшийся осадок гидроокиси титана отфильтровывают, промывают, подсушивают, переносят вместе с фильтром во взвешенный тигель, озоляют и прокаливают до постоянного веса. Титр стандартного раствора вычисляют по формуле [c.37]
Раствор соды готовится из навески, высушенной при 180° С, 50 г химически чистой соды и дистиллированной воды объем доводится до 1 л. [c.231]
С потреблением соды. Но для этого способа необходим химически чистый сернокислый алюминий, являющийся весьма дефицитным продуктом. При углекислом же способе можно пользоваться алюмо-калиевыми квасцами — продуктом значительно более доступным. [c.429]
Децимолярный раствор соды приготовляют растворением и разведением до литра 10,60 г безводного химически чистого углекислого натрия. [c.221]
Получение химически чистого карбоната натрия (безводная сода) [c.250]
На технохимических весах в бюксе или на часовом стекле отвешивают 1,25—1,30 г тиосульфата натрия. Навеску высыпают через воронку в мерную колбу емкостью 250 мл, прибавляют свежепрокипяченной и охлажденной воды около половины объема колбы и растворяют навеску, затем добавляют около 0,25 г химически чистой соды для устойчивости титра раствора тиосульфата натрия, после этого доливают в колбу до метки свежепрокипяченной и охлажденной воды, закрывают колбу пробкой и дают отстояться раствору 10—12 суток в темном месте, чтобы установилась его концентрация. [c.277]
Так, для определения титра приготовленного раствора серной кислоты отвешивают в колбу навеску химически чистой соды и титруют ее приготовленным раствором кислоты [c.112]
В тигель (или чашку) меркой всыпают химически чистую безводную соду в тройном количестве по отношению к ожидаемому весу сухого остатка. Затем тигель (чашку) сушат при 160° до постоянного веса. Во взвешенный с содой тигель (чашку) вливают 5—10 лл воды, и массу размешивают палочкой. После этого из весовой пипетки (см. выше) в тигель (чашку) вливают необходимое количество анализируемой рапы, и содержимое вновь размешивают. Затем испаряют воду осторожным нагреванием сперва на водяной бане или негорячей плите, а потом — в сушильном шкафу, и высушивают массу досуха при 160° до постоянного веса. Температуру сушильного шкафа следует поднимать постепенно, сперва до 100°, затем до 115° и через 1—2 часа до 160°, Привес по сравнению с весом тигля (чашки) с содой является весом сухого остатка для данной навески. [c.34]
Изучено влияние сероуглерода, аммиака, ионов трехвалентного железа, щелочи (КОН) и соды (МзаСОз).Указанные соединения вводили в сырьевую смесь, аммиак в виде 10%-ной аммиачной воды, / е +в виде РеС/д-бНаО, сероуглерод, КОН —химически чистые. Состав гидрогенизата определяли методом газожидкостной хроматографии на хроматографе У Х-2 с детектором по теплопроводности. В качестве насадки использовался тефлон , обработанный 15%-ным раствором силиконового эластомера марки СКТЭ. [c.127]
Карбонаты и гидрокарбонаты. Наиболее важными в техническом отношении карбонатами являются сода Ыа СОд, питьевая сода NaH 02, поташ К2СО3, известняк СаСОд й некоторые другие. Обыкновенно содой называют технический продукт, содержащий от 96 до 99% НзаСОд. Название сода иногда употребляют также и по отношению к химически чистому соединению Na2 Oз. [c.471]
Водка Московская особая . Для приготовления этой водки используют пищевую соду и уксусную кислоту. Пищевую соду в виде концентрированного раствора ее в сортировке вносят непосредственно в основную порциию сортировки для придания ей мягкости, а также используют с уксусной кислотой для получения уксуснокислого натрия (СНзСООМа). В каждом конкретном случае массу соды, которую необходимо внести в сортировку, определяют путем титрования исходной сортировки в лаборатории и выполнения расчетов по формуле М = (0,084 г/мл) (А2 — Ai), где М — масса химически чистого NaH Oa, которую необходимо внести в каждый 1 дал сортировки для обеспечения необходимой щелочности А2 — требуемая щелочность сортировки, выраженная в мл 0,1 н раствора H L на 100 мл сортировки А — начальная щелочность сортировки, в мл 0,1 н раствора НС1 на 100 мл сортировки. [c.265]
Если раствор несмотря на все эти операции все еще 01срашен, К нему прил ивают слой чистейшего эфира, который при отгонке не долисен оставлять ни малейшего остатка. Алкалоид осаждают раствором химически чистой соды, взбалтывают с эфиром и отделяют водный слой от эфирного раствора. Из последнего эзерин снова извлекают 10%-ной уксусной кислотой и обесцвечивают уксуснокислый водный раствор, а[c.442]
Платиновые тигли можно очищать сплавлением с K2S2O7 (это делается в том случае, если загрязнения не удаляются просто длительным кипячением с химически чистой концентрированной соляной кислотой или с раствором азотной кислоты). Тигель наполняют K2S2O7, нагревают до слабого красного каления, но не до появления твердого K2SO4. Затем расплав быстро выливают в сухой песок, а приставший остаток растворяют кипящей водой. Значительно эффективнее очищающее действие расплавленной смеси соды и буры (3 4- 1). [c.50]
Для отделения указанных примесей производится ряд вспомогательных операций, позволяющих в результате всего сложного процесса получить соду с содержанием химически чистой угленатриевой соли до 97 Д. [c.68]
После отстаивания и удаления глиНистых частиц и других нерастворимых примесей при охлаждении раствора выпадает кристаллический осадок КС1. Полученная соль содержит после обезвоживания центрифугированием и сушкой 56,9—61,9% KgO и выше (в химически чистом продукте 63,16%). Оставшийся после выпадения хлористого калия маточный раствор, насыщенный Na l, подогревают и вновь используют для обработки новой порции сильвинита. Отход производства содержит до 95% Na l и служит материалом для получения Соды, технической и поваренной соли. [c.292]
Титр рабочего раствора НС1 обычно устанавливают (см. 58), пользуясь в качестве исходного вещества тетраборатом натрия (бурой) или карбонатом натрия (содой). Наиболее удобна бура, так как она путем перекристаллизации при 60 °С легко получается химически чистой, точно соответствующей формуле NajBjO-IOh3O. Бура удовлетворяет также и другим требованиям, предъявляемым к исходным веществам, а именно достаточно устойчива и ее грамм-эквивалент имеет большую величину (190,7 г). В отличие от этого сода труднее очищается от примесей и ее грамм-эквивалент имеет значительно меньшую величину (52,99 г). Кроме того, безводная сода Naj Og гигроскопична, так что перед употреблением ее приходится прокаливать для удаления влаги. По этим причинам в качестве исходного вещества мы будем пользоваться бурой. [c.319]
Поэтому для установки титра лучше, исходить из безусловно надежного основного вещества, в качестве которого Lunge рекомендует чистую соду, а Sorensen (ср. т. I, вып. 1, стр. 399 и 402) — химически чистый, с/хой и не гигроскопический щавелевокислый натрий, изготовляемый по его рецепту. Lunge сперва устанавливает по чистой соде нормальную соляную кислоту, по соляной кислоте — раствор едкого натра или лучше едкого барита, по ним — снова раствор кислоты — щавелевой [c.13]
Для этого алюмосиликатное сырье в смеси с мелом обжигали до образования 5СаО ЗАЬОз и 2СаО Si02 последний при охлаждении, переходя в у-модификацию, должен был способствовать рассыпанию продукта обжига [3]. Полученный тонкий порошок продукта обжига мы подвергали выщелачиванию раствором соды и фильтрованию. Из фильтрата, содержащего алюминаты натрия, осаждался углекислотой гидрат окиси алюминия. Осадок после отделения алюмината натрия, состоящий в основном из двухкальциевого силиката и углекислого кальция, подвергали обжигу для получения цемента с повышенным содержанием алита. В качестве сырья для первоначальных исследований была взята огнеупорная глина Суворовского месторождения и химически чистый карбонат кальция. Химический состав глины был следующим (в %) [c.368]
Карбонат натрия (НагСОз, эквивалентный вес 53,00, рациональный эквивалентный вес 52,99). Получение чистого безводного карбоната натрия очень просто по этой причине и вследствие дешевизны исходного материала, применение очищенного карбоната натрия как основного вещества особенно рекомендовал Люнге. В продаже имеется химически чистая сода, которую надо проверить на чистоту и высушить при 270—300°. Можно также исходить из технической соды, приготовить ее насыш,ен- [c.101]
Вычисления результатов объемных определений при методе отдельных навесок. Пример. Вычислить нормальность и титр раствора соляной кислоты, если при титровании им навески в 0,1352 г химически чистой безводной соды ЫагСОз, растворенной в произвольном объеме воды, израсходовано 25,12 мл раствора НС1. [c.237]
Ход определения. В мерную колбу емкостью 200 или 250 мл помещают небольшое количество раствора арсенита натрия NasAsOs, добавляют к нему около 100 мл дистиллированной воды, 2—3 капли фенолфталеина и по каплям 2 н. раствор серной кислоты до исчезновения красной окраски раствора. После этого добавляют 4—5 г твердой химически чистой или чистой для анализа соды NaH Os и растворяют ее, не нагревая смесь. Если жидкость окрасится в красный цвет, то еще прибавляют по каплям 2 н. раствор серной кислоты до обесцвечивания ее. Затем доливают в колбу воды точно до метки по нижнему мениску и хорошо перемешивают жидкость. [c.284]
УГЛЕКИСЛЫЙ КАЛИЙ (поташ). К2СО3. Химически чистый У. к. содержит 56,5% К2О. В технических солях его меньше из-за примесей. Источник калия для растений, чувствительных к хлору, а также на кислых почвах, где он частично нейтрализует их кислотность. В качестве удобрения практически не применяется из-за сильной гигроскопичности. Составная часть золы травянистых и древесных растений (особенно гречишной соломы и стеблей подсолнечника). Легко растворим в воде и может быстро использоваться растениями. У. к.— составная часть цементной пыли. УГЛЕРОД. С. Химический элемент IV группы периодической системы элементов. Атомный вес 12,01. В большинстве природных соединений четырехвалентен, но известны и его двувалентные соединения (например, окись углерода СО). В природе широко распространен в углях, нефти, карбонатах — солях угольной кислоты, из которых наиболее известны карбонаты кальция (известняк, мел, мрамор), магния (магнезит), натрия (сода), калия (поташ). Органическими соединениями называют соединения С. Число изученных соединений С. превышает миллион. В воздухе С содержится в виде углекислого газа СО2 в количестве 0,03 объемн. %. Он образуется цри раз.т1ичных процессах окисления органических веществ (гниение, сжигание топлива, дыхание). В воздухе, содержащемся в пахотном слое почвы, содержится до 0,3% СОг. В гу- [c.300]
К дистиллированной воде прибавляют химически чистую содУ N 2 0 до слабощелочной реакции а упариваю раствор на 1/4 объема. Воду хранят в бутыли с нижним тубусом, причем в пробку бутыли вставляют хлоркальциевую трубку, наполненную криоталла-ми натронной извести. [c.47]
Натриево-свинцово-силикатную систему в области, ограниченной кремнеземом и метасиликатами натрия и свинца, изучали Кракау, Мухин и Генрих. Иоследования производились комбинированным методом принудительной кристаллизации и методом закалки кристаллические фазы изучались кристаллооптически. Сплавы, подлежащие исследованию, варили в платиновом тигле исходными материалами служили химически чистые кварцевый песок, окись свинца и сода. [c.326]
Важным показателем в работе вакуум-фильтров является выход соды (в расчете на 100 масс, частей сырого бикарбоната). Выход соды из химически чистого NaH Og равен 63,1%. В присутствии влаги и солей аммония выход снижается. [c.126]
Китай кальцинированный оксид алюминия для ТЕПЛОПРОВОДНОСТЬ Производитель и фабрики
кальцинированный оксид алюминия
кальцинированный оксид алюминия представляет собой коммерческий оксид алюминия или оксид алюминия. Это белый порошок. Одним из выдающихся характеристик прокаленного оксида алюминия является его твердостью , которая составляет 9 на шкале Мооса. Существует плата промышленных областей применения для этого типа алюминия и ряда Отличительных сортов производятся для удовлетворения различных потребностей.
Определение классов
1) прокаливает алюминий S-100 марок: белый зернистый сыпучий порошок проходит через 150 м.
2) кальцинированный алюминиевый S-300 марка: Белый порошок сверхтонкого проходит через 45 микрон.
3) класс прокаленный оксид алюминия СКМ: Это, наконец , измельченные сорта , состоящие полностью из сверхтонкого проходит через 45 микрон.
4) прокаленный оксид алюминия С-300 ПТ: Это тонко измельченный сорт , состоящий исключительно из сверхтонкого с обработанной поверхностью.
Использование
Использования в качестве материала постельных принадлежностей в ходе термообработки специальных легированных сталей, Это использует в качестве флюсовых сред в совещании специальных сталей в качестве компонента низкого стекла расширения. Он использовать в качестве составных специального фарфора ошеломляет & оно используется в качестве исходного материала для изготовления зубных фарфора. Это использует для огнеупорного применения , таких как электрические изоляторы. Она заключается в использовании в качестве абразива упорных. Это использовать остекление керамической плитки.
Особый вид альфа прокаленного глинозема.
В качестве тепловой изоляции наполнителя полимера, он широко используется в теплопроводности пластмасс, резины, клеев и покрытий.
Химический состав % | Удельная площадь поверхности | -325 меш | |||
Al2O3, | Na2O | Fe2O3 | SiO2 | м 2/ г | |
99,7 | 0.08-0.13 | 0,02-0,07 | 0.04-0.14 | ≤0.5 | ≥98.5 |
Примечания: Размер частиц может быть обработан на заказ.
Применение:
1.As теплоизоляционный наполнитель полимера.
2.Used теплопроводности пластмасс, резины, клеи.
Физические и химические свойства бикарбоната натрия
Бикарбонат натрия, широко известный как пищевая сода, широко используется во многих домах и учебных классах. Как и все типы веществ, бикарбонат натрия обладает определенными физическими и химическими свойствами, которые можно наблюдать или определять количественно. Эти свойства включают внешний вид пищевой соды и химические свойства.
••• Chorboon Chiranuparp / iStock / Getty Images
Молекулярный состав
Бикарбонат натрия представляет собой смесь углерода, натрия, водорода и кислорода.Одна молекула содержит один атом углерода, один атом натрия, один атом водорода и три атома кислорода для молекулярной формулы NaHCO 3 или CHNaO 3 . Исходя из молекулярной массы, бикарбонат натрия состоит из 57,1% натрия, 27,4% кислорода, 14,3% углерода и 1,2% водорода.
••• jordachelr / iStock / Getty Images
Наблюдаемые физические свойства
Физические свойства вещества — это характеристики, которые можно наблюдать без изменения состава или идентичности вещества.Наблюдения за внешним видом бикарбоната натрия, такие как цвет, запах, вкус и состояние вещества, являются физическими свойствами. Бикарбонат натрия представляет собой белый кристаллический порошок, который иногда образует комки. Он не имеет запаха и имеет горьковато-соленый вкус. При комнатной температуре представляет собой твердое вещество. Растворимость или способность вещества растворяться в воде также является физическим свойством. Бикарбонат натрия растворим в воде и может быть отделен от воды путем испарения.
••• eskaylim / iStock / Getty Images
Установленные химические свойства
Химические свойства описывают наблюдения за веществом, основанные на способности вещества изменять свой химический состав.Разложение и pH — два общих химических свойства бикарбоната натрия. Концентрация ионов водорода (H + ) в растворе — это химическое свойство, называемое pH. Шкала pH находится в диапазоне от 0 до 14. Значение pH менее 7 указывает на кислотность, значение 7 — нейтрально, а значение более 7 — считается щелочным. 1-процентный молярный раствор пищевой соды в воде при комнатной температуре имеет pH 8,3. Это число указывает на то, что пищевая сода является щелочной, что и объясняет ее горький вкус.Разложение — это процесс с использованием тепла для разложения вещества на более простые компоненты, которые отличаются от исходного вещества. При нагревании до температуры выше 50 градусов C (122 градусов F) бикарбонат натрия разлагается или расщепляется с образованием в основном диоксида углерода (CO 2 ) и воды (H 2 O) со следовыми количествами карбоната натрия ( NaCO 3 ). Разложение — это химическое изменение.
••• Brooke Fuller / iStock / Getty Images
Использование бикарбоната натрия
Некоторые физические и химические свойства бикарбоната натрия находят полезное применение.Щелочность пищевой соды заставляет ее вступать в реакцию с кислотами. Это свойство делает бикарбонат натрия полезным для выпечки, очистки и дезодорации. Многие неприятные запахи вызваны кислотами, и пищевая сода нейтрализует эти запахи, вступая с ними в реакцию. Газ, выделяющийся во время кислотно-щелочной реакции между пищевой содой и кислотой, такой как винный камень, лимонный сок или молочная кислота в пахте, вызывает подъем выпечки. Абразивная текстура кристаллов пищевой соды полезна для очистки грязи и пятен с различных поверхностей, включая зубы.
••• sugar0607 / iStock / Getty Images
••• MITSUHARU MAEDA / a.collectionRF / amana images / Getty Images
Sodium — New World Encyclopedia
| General | |
|---|---|
| General | |
| General Символ, номер | натрий, Na, 11 |
| Химическая серия | щелочные металлы |
| Группа, период, Блок | 1, 3, с |
| Внешний вид | серебристо-белый |
| Атомная масса | 22.98976928 (2) г / моль |
| Электронная конфигурация | [Ne] 3s 1 |
| Электронов на оболочку | 2, 8, 1 |
| Физические свойства | |
| Фаза | твердое тело |
| Плотность (близкая к комнатной) | 0,968 г / см³ |
| Плотность жидкости при температуре плавления | 0,927 г / см³ |
| Температура плавления | 370,87 K (97,72 ° C, 207.9 ° F) |
| Точка кипения | 1156 K (883 ° C, 1621 ° F) |
| Критическая точка | (экстраполированный) 2573 K, 35 МПа |
| Теплота плавления | 2,60 кДж / моль |
| Теплота испарения | 97,42 кДж / моль |
| Теплоемкость | (25 ° C) 28,230 Дж / (моль · К) |
| Атомные свойства | |
| Кристаллическая структура | с кубическим центрированием по телу |
| Состояния окисления | 1 (сильно основной оксид) |
| Электроотрицательность | 0.93 (шкала Полинга) |
| Энергии ионизации (подробнее) | 1-я: 495,8 кДж / моль |
| 2-я: 4562 кДж / моль | |
| 3-я: 6910,3 кДж / моль | |
| Атомный радиус | 180 пм |
| Атомный радиус (расч.) | 190 пм |
| Ковалентный радиус | 154 пм |
| Радиус Ван-дер-Ваальса | 227 пм |
| Разное | |
| Магнитное упорядочение | парамагнитный |
| Удельное электрическое сопротивление | (20 ° C) 47.7 нОм · м |
| Теплопроводность | (300 K) 142 Вт / (м · K) |
| Тепловое расширение | (25 ° C) 71 мкм / (м · K) |
| Скорость звука (тонкий стержень) | (20 ° C) 3200 м / с |
| Скорость звука (тонкий стержень) | (rt) 10 м / с |
| Модуль сдвига | 3,3 ГПа |
| Объемный модуль | 6,3 ГПа |
| Твердость по Моосу | 0.5 |
| Твердость по Бринеллю | 0,69 МПа |
| Регистрационный номер CAS | 7440-23-5 |
| Известные изотопы | |
Натрий (химический символ Na , ат. номер 11) является членом группы химических элементов, известных как щелочные металлы. Серебристого цвета, он мягкий, воскообразный и легкий. Он обладает высокой реакционной способностью, быстро окисляется на воздухе и бурно реагирует с водой с образованием щелочного гидроксида натрия и газообразного водорода.Учитывая его реакционную способность, натрий не встречается в природе как свободный металл, но связан с другими элементами в виде соединений. Он также встречается в морской воде в виде катионов.
Металлический натрий можно использовать для отделения некоторых других металлов от их соединений, сглаживания металлических поверхностей и производства нескольких соединений. Натриевые лампы на парах обеспечивают яркое освещение при невысокой стоимости. Сплав натрия и калия (NaK) является теплоносителем и химическим восстановителем.
Кроме того, соединения натрия находят множество применений.Поваренная соль или поваренная соль — это хлорид натрия, широко используемый в качестве пищевого ароматизатора. Он обеспечивает организм ионами натрия, которые являются важными питательными веществами, но чрезмерное их количество вредно для здоровья. Это также средство для защиты от обледенения автомобильных дорог зимой. Бикарбонат натрия — это антацид, разрыхлитель при выпечке и ингредиент в некоторых формах зубной пасты. Гидроксид натрия — мощное химическое основание, но бикарбонат натрия и карбонат натрия также используются для повышения щелочности растворов.Карбонат, хлорид и гидроксид натрия являются важными промышленными химическими веществами, используемыми в производстве стекла, целлюлозы и бумаги, текстильных изделий, мыла, моющих средств и других солей натрия.
Выделение и этимология
Соединения натрия известны давно. Сам металл был впервые выделен в 1807 году, когда сэр Хамфри Дэви провел электролиз едкого натра (гидроксида натрия). На катод нанесен натрий.
Название натрия происходит от английского слова soda .Символ натрия, Na, происходит от неолатинского названия распространенного соединения натрия, называемого natrium . Это название, в свою очередь, происходит от греческого nítron , разновидности натуральной соли. В средневековой Европе соединение натрия с латинским названием sodanum использовалось как средство от головной боли.
Возникновение и производство
Натрий является наиболее распространенным щелочным металлом и составляет около 2,6 процента от веса земной коры. Натрий, встречающийся в природе, связан с другими элементами во многих минералах.Наиболее распространенным минералом, содержащим натрий, является галит (или каменная соль), химически известный как хлорид натрия. Другие минералы, которые содержат натрий, включают криолит (фторид натрия и алюминия), кальцинированную соду (карбонат натрия) и соду (или чилийскую селитру, нитрат натрия), а также несколько членов групп минералов амфибола и цеолита.
В звездах относительно много натрия. Его спектральные линии, известные как D-линии натрия, являются одними из самых заметных при звездном свете.
В конце девятнадцатого века натрий был химически получен путем нагревания карбоната натрия с углеродом до 1100 ° C.Реакцию можно записать следующим образом.
- Na 2 CO 3 (жидкость) + 2 C (твердый, кокс) → 2 Na (пар) + 3 CO (газ).
В настоящее время натрий коммерчески производится путем электролиза плавленого (сжиженного) хлорида натрия. В этом процессе, известном как процесс Дауна, хлорид кальция смешивают с хлоридом натрия, чтобы снизить температуру плавления ниже 600 ° C. На катоде откладывается натрий, но не кальций. Этот метод менее затратный, чем более ранний метод электролиза гидроксида натрия.
Примечательные характеристики
Испытание пламенем для натрия показывает ярко-желтое излучение из-за так называемых «линий D натрия» на 588,9950 и 589,5924 нм.
Как щелочной металл, натрий находится в группе 1 (бывшая группа 1A) периодической таблицы, между литием и калием. Кроме того, он находится в начале 3 периода, непосредственно перед магнием.
Как и другие щелочные металлы, металлический натрий является мягким, легким, химически активным металлом. Из-за его чрезвычайной реакционной способности он встречается в природе в форме соединений, а не в виде чистого элемента.Металлический натрий плавает в воде и бурно реагирует с ней, выделяя тепло, газообразный водород и едкий раствор гидроксида натрия. Когда натрий или его соединения сжигаются в пламени, они выделяют отчетливый желтый цвет, соответствующий двум основным спектральным линиям — «линиям D натрия» на длинах волн 588,9950 и 589,5924 нм.
В 1860 году в своей статье «Химический анализ путем наблюдения спектров» в научном журнале Annalen der Physik und der Chemie Густав Кирхгоф и Роберт Бунзен сообщили: «В углу нашего 60 куб.м. (кубический метр) самое дальнее от аппарата помещение, мы взорвали 3 мг. (миллиграммы) хлората натрия с молочным сахаром, наблюдая за несветящимся пламенем перед щелью. Через несколько минут пламя постепенно пожелтело и показало сильную линию натрия, которая исчезла только через 10 минут. Исходя из веса натриевой соли и объема воздуха в помещении, мы легко подсчитаем, что одна часть по весу воздуха не может содержать более 1/20 миллионной части натрия ».
При экстремальном давлении содержание натрия отклоняется от нормы. правила перехода в жидкое состояние.Большинству материалов требуется больше тепловой энергии для плавления под высоким давлением, чем при нормальном атмосферном давлении. Это потому, что молекулы упакованы ближе друг к другу и имеют меньше места для движения. При давлении 30 гигапаскалей (в 300 000 раз выше атмосферного давления на уровне моря) температура плавления натрия начинает падать. При температуре около 100 гигапаскалей натрий плавится около комнатной температуры.
Возможное объяснение аномального поведения натрия состоит в том, что у этого элемента есть один неспаренный электрон (во внешней оболочке), который при нахождении под давлением приближается к другим десяти электронам, вызывая взаимодействия, которые обычно отсутствуют.Находясь под давлением, твердый натрий принимает несколько странных кристаллических структур, предполагая, что жидкость может иметь необычные свойства, такие как сверхпроводимость или сверхтекучесть (Gregoryanz et al. 2005).
Изотопы
Известно 13 изотопов натрия, из которых единственный стабильный — 23 Na. У натрия есть два радиоактивных космогенных изотопа, то есть изотопы, образующиеся при взаимодействии космических лучей высокой энергии с ядрами атомов натрия. Это 22 Na с периодом полураспада 2.605 лет и 24 Na с периодом полураспада около 15 часов.
Воздействие высоких уровней нейтронного излучения (например, в результате аварии на ядерном реакторе) превращает некоторые из стабильных 23 Na в плазме крови человека в 24 Na. Измеряя концентрацию последнего изотопа, можно рассчитать дозу нейтронного излучения пострадавшему.
Меры предосторожности
С металлическим натрием всегда следует обращаться осторожно. Он очень взрывоопасен в воде и является ядом, когда не сочетается с другими элементами.Порошкообразная форма может самопроизвольно гореть на воздухе или в кислороде. По этим причинам натрий должен храниться либо в инертной атмосфере, либо в жидком углеводороде, таком как минеральное масло или керосин.
Соединения
Бикарбонат натрия
Бикарбонат натрия (NaHCO 3 ) также известен как гидрокарбонат натрия, бикарбонат натрия или пищевая сода. Это растворимое белое соединение с легким щелочным вкусом, напоминающее карбонат натрия. Он содержится во многих минеральных источниках, а также производится искусственно.
При воздействии кислоты бикарбонат натрия выделяет диоксид углерода и воду. Реакция следующая.
- NaHCO 3 + HCl Å® NaCl + H 2 O + CO 2 (газ)
- NaHCO 3 + CH 3 COOH Å® NaCH 3 COO + H 2 O + CO 2 (газ)
Выше 60 ° C бикарбонат натрия постепенно разлагается на карбонат натрия, воду и диоксид углерода, а при 200 ° C он полностью разлагается на карбонат натрия:
- 2NaHCO 3 Å® Na 2 CO 3 + H 2 O + CO 2
Карбонат натрия
Карбонат натрия (Na 2 CO 3 ), также известный как стиральная сода или кальцинированная сода , представляет собой натриевую соль угольной кислоты (H 2 CO 3 ).Чаще всего он встречается в виде кристаллического гептагидрата (Na 2 CO 3 .7H 2 O), который легко теряет воду из кристаллов с образованием белого порошка, моногидрата (Na 2 CO 3 .H) 2 О). Он имеет охлаждающий щелочной вкус и может быть извлечен из золы многих растений. Его производят искусственно в больших количествах из поваренной соли (хлорида натрия).
Хотя карбонат натрия растворим в воде, он может встречаться в естественных условиях в засушливых регионах, особенно в минеральных отложениях ( эвапоритов, ), образующихся при испарении сезонных озер.Залежи минерального натрона, комбинации карбоната натрия и бикарбоната натрия, добывались на дне сухих озер в Египте с древних времен, когда натрон использовался для приготовления мумий и в начале производства стекла.
Хлорид натрия
Хлорид натрия, также известный как поваренная соль или поваренная соль, представляет собой соединение с химической формулой NaCl. Он содержится в больших количествах в морской воде и в виде минерала галита или каменной соли. Это соль, наиболее ответственная за соленость океанов.Он образуется при испарении морской воды, солевых скважин и соленых озер, а также при добыче каменной соли.
Эта соль необходима для жизни на Земле. Он присутствует (в различных концентрациях) в большинстве биологических тканей и жидкостей организма. Концентрация ионов натрия в крови напрямую связана с регулированием безопасного уровня жидкости в организме. Распространение нервных импульсов (путем «передачи сигнала») регулируется ионами натрия. Среди приматов люди необычны тем, что выделяют большое количество соли при потоотделении.С другой стороны, слишком много соли в организме вредно для здоровья.
В качестве основного ингредиента пищевой соли хлорид натрия обычно используется в качестве приправы и пищевого консерванта. Его полезность в качестве пищевого консерванта помогла устранить зависимость человека от сезонной доступности пищи и позволила путешествовать на большие расстояния. В средние века караваны, состоявшие из 40 000 верблюдов, пересекали четыреста миль Сахары с солью, иногда продавая ее рабам.
В Библии много упоминаний о поваренной соли.Известная история о жене Лота, которая превратилась в соляной столб, когда она ослушалась ангелов и оглянулась на нечестивый город Содом (Бытие 19:26). В Нагорной проповеди Иисус сказал своим последователям, что они были «солью земли», имея в виду их внутреннее, духовное
ароматизатор, который им нужно было раздать другим. Кроме того, в некоторых религиозных традициях поваренная соль используется для благословения (или духовного очищения) людей, мест и вещей. Такое использование, вероятно, основано на чистом виде чистой соли, ее химической стабильности и ценности для живых существ.
Гидроксид натрия
Гидроксид натрия (NaOH), также известный как щелочь или каустическая сода, представляет собой сильную химическую основу, широко используемую в химических лабораториях и в промышленности. Чистое вещество представляет собой белое твердое вещество, доступное в виде пеллет, хлопьев и гранул, а также в виде 50-процентного насыщенного раствора. Он легко впитывает воду и углекислый газ из воздуха, поэтому его следует хранить в герметичном контейнере.
Это вещество хорошо растворяется в воде, и в процессе растворения выделяется тепло.Он также растворяется в других полярных растворителях, таких как этанол и метанол, но не растворяется в неполярных растворителях, таких как диэтиловый эфир.
При использовании гидроксида натрия следует носить перчатки и защитные очки, так как он может вызвать химические ожоги, травмы или рубцы, а также слепоту. Фартук из поливинилхлорида также рекомендуется при использовании концентрированных растворов или твердой формы. Его следует хранить вдали от сильных кислот, таких как серная кислота.
Каустическая сода производится электролизом водного раствора хлорида натрия.Он накапливается на катоде, где вода восстанавливается до газообразного водорода и гидроксид-ионов. Процесс, называемый «хлорно-щелочной способ», также производит хлор.
Гидроксид натрия — это ионное соединение, состоящее из ионов натрия и гидроксид-ионов. Ион гидроксида делает гидроксид натрия сильным основанием, которое реагирует с кислотами с образованием воды и соответствующих солей. Например, с соляной кислотой образуется хлорид натрия:
- NaOH (водн.) + HCl (водн.) Å® NaCl (водн.) + H 2 O (l)
Такие кислотно-основные реакции также могут быть используется для титрования, и это обычный способ измерения концентрации кислот.С этим связана реакция гидроксида натрия с кислыми оксидами, такими как диоксид углерода (CO 2 ) и диоксид серы (SO 2 ). Такие реакции часто используются для «очистки» от вредных кислых газов (например, SO 2 и H 2 S) и предотвращения их выброса в атмосферу.
Гидроксид натрия медленно реагирует со стеклом с образованием силиката натрия, поэтому стыки стекла и запорные краны, подвергающиеся воздействию NaOH, имеют тенденцию «замерзать». Лабораторные колбы и стеклянные химические реакторы повреждаются при длительном воздействии горячего гидроксида натрия, и стекло становится матовым.Гидроксид натрия не повреждает железо или медь, но многие другие металлы, такие как алюминий, цинк и титан, разрушаются быстро. По этой причине алюминиевые сковороды нельзя мыть щелоком.
В отличие от NaOH гидроксиды большинства металлов нерастворимы, поэтому гидроксид натрия можно использовать для осаждения гидроксидов металлов. Одним из таких гидроксидов является гидроксид алюминия, используемый в качестве гелеобразных хлопьев для фильтрации твердых частиц при очистке воды.
Применения
Натрий, его сплавы, ионы и соединения имеют широкий спектр применения.Некоторые из них перечислены ниже.
- Металлическая форма натрия может использоваться для выделения некоторых металлов, таких как цирконий и калий, из их соединений.
- Металлический натрий используется для производства нескольких соединений, включая цианид натрия, гидрид натрия и пероксид натрия.
- Натрий используется для удаления накипи (сглаживания) металлических поверхностей и очистки расплавленных металлов.
- Натриевые лампы на парах обеспечивают эффективное получение света от электричества.
- Натрий добавляется в некоторые сплавы для улучшения их структуры.
- Сплав натрия и калия (NaK) является теплоносителем и химическим восстановителем.
- Мыло обычно представляет собой натриевую соль некоторых жирных кислот.
Лазер на красителе, используемый в оптическом диапазоне Starfire для экспериментов с лидаром и лазерными направляющими звездами, настроен на линию D натрия и используется для возбуждения атомов натрия в верхних слоях атмосферы
- Бикарбонат натрия используется в качестве антацида для лечения кислотного расстройства желудка и в качестве ингредиент некоторых видов зубной пасты. В сочетании с кислыми веществами (например, лимонным соком) он действует как разрыхлитель при выпечке.Обычно его используют для повышения щелочности воды в бассейнах и спа, особенно при высоком содержании хлора.
- Карбонат натрия используется в производстве стекла, бумаги, моющих средств и химических веществ, таких как силикаты и фосфаты натрия. Многие химические предприятия используют его в качестве щелочного агента. Он широко используется при обработке фотопленки, когда для действия проявителей необходимы щелочные условия. В быту он используется в качестве смягчителя воды для стирки, поскольку предотвращает связывание ионов магния и кальция в жесткой воде с моющим средством.
- Хлорид натрия широко используется в качестве усилителя вкуса в пищевых продуктах. Он также используется в производстве целлюлозы и бумаги, окрашивании текстильных изделий и производстве мыла и моющих средств. На большей части территории Северной Америки большое количество каменной соли используется для очистки шоссе от льда зимой. Кроме того, хлорид натрия является сырьем для производства хлора, который, в свою очередь, используется для производства многих современных материалов, включая поливинилхлорид и пестициды.
- Гидроксид натрия используется в промышленности в основном как сильная химическая основа при производстве целлюлозы и бумаги, текстиля, мыла и моющих средств.Он используется для управления химическими реакциями и измерения концентраций кислот. Пищевое использование щелока включает мытье или химическую очистку фруктов и овощей, переработку шоколада и какао, производство карамельного красителя, ошпаривание птицы, переработку безалкогольных напитков и сгущение мороженого. Оливки часто замачивают в щелоке, чтобы смягчить их, в то время как крендели и рулеты из немецкого щелока перед выпеканием глазируют раствором щелочи, чтобы они стали хрустящими. Гидроксид натрия используется в домашних условиях как средство для прочистки забитых канализаций.
Физиология и ионы натрия
Ионы натрия играют важную роль в различных физиологических процессах. Например, ионы натрия необходимы для регулирования крови и биологических жидкостей, передачи нервных импульсов, сердечной деятельности и различных метаболических функций.
К сожалению, многие люди потребляют слишком много хлорида натрия (поваренной соли), что может иметь негативные последствия для здоровья. Это может привести к повышению артериального давления, что, в свою очередь, связано с повышенным риском сердечного приступа и инсульта.Чрезмерное потребление соли также может обезвоживать организм человека.
Многие микроорганизмы не могут жить в слишком соленой среде, так как вода вытягивается из их клеток посредством осмоса. По этой причине соль используется для консервирования некоторых продуктов, например копченого бекона или рыбы. Его также использовали для дезинфекции ран.
Ссылки
- Лос-Аламосская национальная лаборатория — натрий
- Грегорянц, Э., и др. (2005). Плавка густого натрия. Physical Review Letters : в печати.
- Ребекка Дж. Донателле. Здоровье, Основы. 6-е изд. Сан-Франциско: Pearson Education, Inc. 2005.
См. Также
Внешние ссылки
Все ссылки получены 16 ноября 2019 г.
Кредиты
New World Encyclopedia Авторы и редакторы переписали и дополнили статью Wikipedia
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 Лицензия (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедию Нового Света :
могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Деоксигенация оксида графена с использованием бытовой пищевой соды в качестве восстановителя: зеленый подход
В данном исследовании изучается и объясняется одноэтапный, новый, простой, быстрый, легкий, экономичный и экологически безопасный способ восстановления оксида графена (GO). В качестве восстановителя здесь применялась бытовая пищевая сода (бикарбонат натрия / NaHCO 3 ). В водном растворе NaHCO 3 гидролизуется до гидроксид-иона и приводит к деоксигенатным листам GO.Подтверждение восстановления кислорода проверяли с помощью УФ-видимой спектроскопии, дифракции рентгеновских лучей, инфракрасной спектрометрии с преобразованием Фурье и спектроскопии комбинационного рассеяния. Температурное поведение графена было проанализировано методами термогравиметрии и дифференциальной сканирующей калориметрии. И снова для морфологического исследования использовались атомно-силовая микроскопия, сканирующая электронная микроскопия, автоэмиссионная сканирующая электронная микроскопия и просвечивающая электронная микроскопия. Для анализа элементного состава применялся энергодисперсионный рентгеновский спектрометр.Результаты вышеупомянутых экспериментов показывают, что бытовая пищевая сода способна производить функциональный графен, который может быть подходящей заменой гидразина, боргидрата натрия или других токсичных восстановителей. Этот метод является высокопроизводительным и безопасным для использования в биоматериалах.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
Экспериментируйте с теплопередачей материала с помощью Starlite
Введение
В 1990 году Морис Уорд дебютировал со своим чудесным изобретением в британском телешоу «Tomorrow’s World», продемонстрировав, как легко наносимая краска может защитить яйцо от варки после нагревания с помощью паяльной лампы.К изумлению всех зрителей, через несколько минут нахождения под сильным пламенем и высокой температурой яйцо было полностью сырым. Уорд изобрел свое изобретение Starlite, которое быстро завоевало популярность, а также вызвало некоторый скептицизм в научном сообществе. У Уорд практически нет научного образования, и он постоянно работал парикмахером. Вскоре после дебюта Starlite научные транснациональные компании, в том числе НАСА, обратились к Уорду с разговорами о сделках на миллион долларов, связанных с этим термостойким материалом.Уорд крайне неохотно передавал свой рецепт какой-либо компании или исследовательской группе, которые представили бы ему свои предложения. В течение следующих двух десятилетий он разрешил британскому правительству и правительству США провести серию небольших тестов на Starlite, чтобы подтвердить, что это не розыгрыш, но он все равно отказался поделиться рецептом. В мае 2011 года Уорд скончался, раскрыв информацию о составе Starlite только избранным членам своей семьи, которые продолжают защищать его секрет, оставив научному сообществу только догадываться о том, из чего может быть сделано это термоизоляционное чудо.
Рис. 1. Исходное изображение Мориса Уорда, представляющего свое изобретение в «Tomorrow’s World» с использованием паяльной лампы для нагрева яйца, покрытого Starlite. Источник: https://www.metabunk.org
Тепловые свойства Starlite
Хотя истинный состав Starlite неизвестен, ученые и инженеры-теплотехники смогли определить некоторые его характеристики и термические свойства по результатам испытаний, которые они провели на образцах, которые Уорд позволил им использовать. Уорд показал, что материал был сделан только из 21 ингредиента, все из которых он нашел в своем доме и которые он считал «нетоксичными».Его младшая дочь недавно поделилась, что они даже регулярно кормили этим материалом своих собак и никогда не замечали никаких побочных эффектов. Перед своей смертью Уорд позволил горстке исследователей провести серию тестов на Starlite, если тестировщики подтвердили, что они не будут анализировать фактический состав и ингредиенты материала. Эти испытания доказали, что Starlite — настоящий продукт и может легко выдерживать температуру около 1000 градусов по Цельсию.
Исследователи также определили, что материал представляет собой полимерный композит, представляющий собой смесь органических и неорганических материалов, включая пластмассы, бораты и керамику.Первоначально казалось, что Starlite имеет теплопроводность примерно такую же, как и резина, примерно 0,14 Вт / (м / К). Это значение теплопроводности будет экспоненциально снижаться, как только материал подвергнется воздействию высоких температур. Поверхность Starlite изменяется в ответ на нагрев, поскольку внутри материала образуются небольшие пустоты шириной от 2 до 5 микрометров. Эти пузырьки воздуха действуют как пена и обеспечивают изоляцию, которая чрезвычайно сильно снижает теплопроводность Starlite.Эти пузырьки воздуха, которые образуются, когда Starlite подвергается воздействию высоких температур, остаются достаточно маленькими, чтобы не мешать способности материалов отражать и излучать тепло от его поверхности.
Испытания, проведенные на Starlite, пришли к выводу, что Уорд по незнанию создал композитный материал со спроектированным интеллектуальным механизмом защиты. Эти открытия поместили Starlite в тот же класс, что и некоторые из самых сложных пьезоэлектрических материалов или сплавов с памятью формы, которые также могут изменять свои физические свойства в ответ на тепло, давление или электрическое поле.Исследователи пришли к выводу, что наиболее близким родственником изобретения Уордса является вспучивающаяся краска, которая используется для защиты стальных балок и колонн в зданиях от пожара. Однако эти краски также могут выделять вредные пары. Тесты, проведенные на Starlite, показали, что при активации он выделяет очень мало газов, что делает его лучше, чем эти обычно используемые изоляционные краски.
Эксперименты со Starlite, которые нужно проводить дома
Уорд утверждает, что он нашел все 21 ингредиент Starlites на своей кухне, поэтому можно с уверенностью предположить, что мы могли бы также приготовить это вещество дома.Хотя этот рецепт Starlite не является официальным, он все же делает материал, который имеет свойства, аналогичные Starlite, такие как исключительные изоляционные свойства и низкая теплопроводность. Большинство из этих домашних экспериментов с использованием Starlite изучают передачу энергии, при этом температура является обычным методом измерения. Следующие ниже эксперименты требуют открытого огня, поэтому рекомендуется проводить их под присмотром взрослых и рассчитаны на учащихся 7 классов и старше. Перед началом любого из следующих экспериментов важно убедиться, что у вас есть защитные очки и защитный лабораторный халат, а также свободное место для использования в качестве пожаробезопасной зоны.Для домашней версии Starlite требуются следующие 3 ингредиента:
- 10 чайных ложек кукурузного крахмала
- 1 чайная ложка пищевой соды
- 4 чайные ложки клея ПВА Elmer’s
Смешайте эти 3 ингредиента вместе ложкой, а затем начните работать руками, пока не получите красивую консистенцию, похожую на замазку (пара минут замешивания). Устранение неисправности: поработайте руками около 5 минут, если он все еще слишком липкий, добавьте легкую пудру кукурузного крахмала.Если он слишком сухой и трескается, добавьте еще ½ чайной ложки клея. Три перечисленных ниже эксперимента являются отличными примерами, демонстрирующими эффективные термические свойства Starlite в домашних условиях.
Рис. 2: Пример пальцевого теста с использованием самодельного Starlite
- Тест пальцем: Зажгите маленькую свечу и держите палец, покрытый Starlite, над пламенем. Сначала ваш палец должен быть примерно на 3 дюйма над пламенем, прежде чем вы начнете медленно приближать его. Вы должны заметить, что материал начинает становиться более пенистым, как на вид.Вы чувствуете тепло от свечи? Это больше или меньше тепла, чем вы почувствуете, если поднесете палец без покрытия к пламени? Лучше всего приготовить новую партию Starlite, если вы планируете повторить этот эксперимент с несколькими пальцами.
- Термоизоляционная форма Starlite: Сделайте плоский диск из Starlite и дайте ему отстояться примерно на 10 минут, чтобы он затвердел. Согните и придайте форму подвесу для одежды или тонкой проволоке любого типа, чтобы получилась подставка для диска Starlite.Зажгите маленькую свечу и поставьте ее под подставку. Держите руку над Starlite, чувствуете ли вы тепло от свечи? Что, если вы удалите Starlite, сможете ли вы по-прежнему держать руку в том же месте или она слишком горячая без защиты изолирующего Starlite? Попробуйте использовать цифровой термометр для измерения температуры выше и ниже защитного диска Starlite, что вы заметили?
- Яйцо поверх Starlite: сделайте небольшое отверстие в верхней части 2 яиц с помощью дрели, ножа или другого предмета с тонкой острой кромкой.Покройте одно яйцо Starlite и оставьте одно яйцо без покрытия. Поместите их над пламенем свечи примерно на 3 минуты каждый, простой без Starlite должен начать пузыриться, а другой с защитой должен оставаться стабильным. Разбейте каждое яйцо в миске, чтобы проверить разницу внутри защищенного и незащищенного материала.
Starlite — это удивительный изолирующий материал, который уже более трех десятилетий поражает умы самых выдающихся ученых мира.Это относительно простой материал с некоторыми необычными способностями. Материал может выдерживать невероятное количество тепла, демонстрируя отличные термостойкие свойства. Хотя оригинальный рецепт Starlite до сих пор неизвестен, многие ученые разрабатывают материалы, которые демонстрируют свойства, аналогичные свойствам образцов, созданных самим Уордом. Возможности применения Starlite безграничны, и в ближайшем будущем он должен появиться в глобальном масштабе.
Автор: Каллиста Уилсон | Младший технический писатель | Термтест
Список литературы
Фишер, Р. 2012. Материальный человек. New Scientist , 214 (2864): 40–40. Как на самом деле работает «чудо-материал» Starlite? (нет данных). Получено с https://www.bbc.com/reel/playlist/searching-for-starlite?vpid=p06llpln
.
Шелли. (2020, 28 марта). Проекты теплопередачи для детей — STEM-задания. Получено с https://www.steampoweredfamily.com/activities/heat-transfer-projects-for-kids-stem-activities/
.
Изображение функции: https: // www.bbc.co.uk/programmes/p06ms47t/
* Большая часть от Янга, Хью Д., Университетская физика, 7-е изд. Таблица 15-5. Значения для аэрогеля алмаза и диоксида кремния из Справочника по химии и физике CRC. Обратите внимание, что 1 (кал / сек) / (см 2 C / см) = 419 Вт / м K. С учетом этого два приведенных выше столбца не всегда совпадают. Все значения взяты из опубликованных таблиц, но не могут считаться достоверными. Значение 0,02 Вт / мК для полиуретана может быть принято как номинальное значение, которое определяет пенополиуретан как один из лучших изоляторов.NIST опубликовал процедуру численного приближения для расчета теплопроводности полиуретана на http://cryogenics.nist.gov/NewFiles/Polyurethane.html. Их расчет для полиуретана, наполненного фреоном, плотностью 1,99 фунт / фут 3 при 20 ° C дает теплопроводность 0,022 Вт / мК. Расчет для полиуретана с наполнителем CO 2 с плотностью 2,00 фунт / фут 3 дает 0,035 Вт / мК. | Индекс Таблицы Ссылка |
Электропроводность элементов и других материалов
- Проводники — это материалы со слабо прикрепленными валентными электронами — электроны могут свободно дрейфовать между атомами
- Изоляторы имеют структуры, в которых электроны связаны с атомами ионными или ковалентными связями — почти ток не может течь
- Полупроводники — это изолирующие материалы, в которых связи могут быть разорваны под действием приложенного напряжения — электроны могут высвобождаться и перемещаться из одного освобожденного валентного узла в другой.
Электропроводность
Электропроводность или удельная проводимость — это мера способности материала проводить электрический ток. Электропроводность обратно пропорциональна удельному электрическому сопротивлению.
Электропроводность определяется как отношение плотности тока к напряженности электрического поля и может быть выражена как
σ = J / E (1)
, где
σ = электрическая проводимость (1 / Ом м, 1/ Ом м, сименс / м, См / м, МОНО / м)
Дж = плотность тока (ампер / м 2 )
E = электрический напряженность поля (вольт / м)
One siemens — S — эквивалентна величине, обратной одному ому и также обозначается как one mho.
Электропроводность некоторых обычных материалов
| Материал | Электропроводность — σ — (1 / Ом · м, См / м, МО / м) |
|---|---|
| Алюминий | 37,7 10 6 |
| Бериллий | 31,3 10 6 |
| Кадмий | 13,8 10 6 |
| Кальций | 29.8 10 6 |
| Хром | 7,74 10 6 |
| Кобальт | 17,2 10 6 |
| Медь | 59,6 10 6 |
| Медь — отожженная | 58,0 10 6 |
| Галлий | 6,78 10 6 |
| Золото | 45,2 10 6 |
| Иридий | 19.7 10 6 |
| Железо | 9,93 10 6 |
| Индий | 11,6 10 6 |
| Литий | 10,8 10 6 |
| Магний | 22,6 10 6 |
| Молибден | 18,7 10 6 |
| Никель | 14,3 10 6 |
| Ниобий | 6.93 10 6 |
| Осмий | 10,9 10 6 |
| Палладий | 9,5 10 6 |
| Платина | 9,66 10 6 |
| Калий | 13,9 10 6 |
| Рений | 5,42 10 6 |
| Родий | 21,1 10 6 |
| Рубидий | 7.79 10 6 |
| Рутений | 13,7 10 6 |
| Серебро | 63 10 6 |
| Натрий | 21 10 6 |
| Стронций | 7,62 10 6 |
| Тантал | 7,61 10 6 |
| Технеций | 6,7 10 6 |
| Таллий | 6.17 10 6 |
| Торий | 6,53 10 6 |
| Олово | 9,17 10 6 |
| Вольфрам | 18,9 10 6 |
| Цинк | 16,6 10 6 |
| Морская вода | 4,5 — 5,5 |
| Вода — питьевая | 0,0005 — 0,05 |
| Вода — деионизированная | 5.5 10 -6 |
Электропроводность элементов относительно серебра
| Элемент | Электропроводность относительно серебра |
|---|---|
| Серебро | 100,0 |
| Медь | 97,6 |
| Золото | 76,6 |
| Алюминий | 63,0 |
| Тантал | 54,6 |
| Магний | 39.4 |
| Натрий | 32,0 |
| Бериллий | 31,1 |
| Барий | 30,6 |
| Цинк | 29,6 |
| Индий | 27,0 |
| Кадмий | |
| Кальций | 21,8 |
| Рубидий | 20,5 |
| Цезий | 20,0 |
| Литий | 18.7 |
| Молибден | 17,6 |
| Кобальт | 16,9 |
| Уран | 16,5 |
| Хром | 16,0 |
| Марганец | 15,8 |
| Марганец | 15.8 |
| Платина | 14,4 |
| Олово | 14,4 |
| Вольфрам | 14,0 |
| Осмий | 14.0 |
| Титан | 13,7 |
| Иридий | 13,5 |
| Рутений | 13,2 |
| Никель | 12,9 |
| Родий | 12,6 |
| Палладий | Палладий |
| Сталь | 12,0 |
| Таллий | 9,1 |
| Свинец | 8,4 |
| Колумбий | 5.1 |
| Ванадий | 5,0 |
| Мышьяк | 4,9 |
| Сурьма | 3,6 |
| Ртуть | 1,8 |
| Висмут | 1,4 |
| Теллур | 0,057 |
Электропроводность высокоочищенной воды
Удельное электрическое сопротивление
Электропроводность является обратной (обратной) величиной удельного электрического сопротивления.Удельное электрическое сопротивление может быть выражено как
ρ = 1/ σ (2)
, где
ρ = удельное электрическое сопротивление (Ом · м 2 / м, Ом · м)
Сопротивление проводника
Сопротивление проводника можно выразить как
R = ρ l / A (3)
, где
R = сопротивление (Ом, Ом)
l = длина проводника (м)
A = площадь поперечного сечения проводника (м 2 )
Пример — сопротивление провода
Сопротивление провода 1000 м калибр медного провода # 10 с площадью поперечного сечения 5.26 мм 2 можно рассчитать как
R = (1,724 x 10 -8 Ом м 2 / м) (1000 м) / (( 5,26 мм 2 ) (10 — 6 м 2 / мм 2 ))
= 3,2 Ом
Преобразование удельного сопротивления и проводимости
| Гран / галлон как CaCO 3 | ppm как CaCO 9000 | ppm NaCl | Проводимость мкмхо / см | Удельное сопротивление МОм / см |
|---|---|---|---|---|
| 99.3 | 1700 | 2000 | 3860 | 0,00026 |
| 74,5 | 1275 | 1500 | 2930 | 0,00034 |
| 49,6 | 850 | 1000 | 1990 | 0.00050 | 24,8 | 425 | 500 | 1020 | 0,00099 |
| 9,93 | 170 | 200 | 415 | 0.0024 |
| 7,45 | 127 | 150 | 315 | 0,0032 |
| 4,96 | 85,0 | 100 | 210 | 0,0048 |
| 2,48 | 42,5 | 50 | 105 | 0,0095 |
| 0,992 | 17,0 | 20 | 42,7 | 0,023 |
| 0,742 | 12,7 | 15 | 32.1 | 0,031 |
| 0,496 | 8,50 | 10 | 21,4 | 0,047 |
| 0,248 | 4,25 | 5,0 | 10,8 | 0,093 |
| 0,099 | 1,70 | 2,057 | 4,35 | 0,23 |
| 0,074 | 1,27 | 1,5 | 3,28 | 0,30 |
| 0,048 | 0.85 | 1,00 | 2,21 | 0,45 |
| 0,025 | 0,42 | 0,50 | 1,13 | 0,88 |
| 0,0099 | 0,17 | 0,20 | 0,49 | 2,05 |
| 0,49 | 2,05 | |||
| 0,13 | 0,15 | 0,38 | 2,65 | |
| 0,0050 | 0,085 | 0,10 | 0,27 | 3.70 |
| 0,0025 | 0,042 | 0,05 | 0,16 | 6,15 |
| 0,00099 | 0,017 | 0,02 | 0,098 | 10,2 |
| 0,00070 | 0,012 | 0,01587 | 11,5 | |
| 0,00047 | 0,008 | 0,010 | 0,076 | 13,1 |
| 0,00023 | 0.004 | 0,005 | 0,066 | 15,2 |
| 0,00012 | 0,002 | 0,002 | 0,059 | 16,9 |
- зерен / галлон = 17,1 ppm CaCO 3
Электропроводность 9036 A Растворы
Электропроводность водных растворов, таких как
- NaOH 4 — Каустическая сода
- NH 4 Cl — Хлорид аммония, соляной аммиак
- NaCl 2 — Поваренная соль
- NaNO 3 — Нитрат натрия , Чилийская селитра
- CaCl 2 — Хлорид кальция
- ZnCl 2 — Хлорид цинка
- NaHCO 3 — Бикарконат натрия, пищевая сода
- Na 2 CO 3
0 — Натрий кальцинированный
- CuSO 4 — Медный купорос, медный купорос
оксид циркония e теплопроводность
Богатый чай.3. 5. Совершенно новое футбольное шоу от Джо Коула и Тома Дэвиса. 1. Александра-Берк. Сможете ли вы угадать название печенья по этим загадочным подсказкам? Великобритания известна своим чаем и печеньем. Сможете ли вы угадать города, изображенные в этой викторине? Можете ли вы назвать британский бисквит, изображенный на каждом изображении? Сможете ли вы узнать их всех по одному снимку крупным планом? Больше вещей. Вы можете не обращать внимания на курицу. … Картинный раунд Викторина. Основываясь на картинке, назовите эти города, начинающиеся с каждой буквы алфавита.Ознакомьтесь с нашими популярными викторинами, такими как Country Flags Quiz # 1 и World Map без 20 случайных стран Песочное / карамельное песочное печенье, Автор Aurore D [CC BY 2.0 (http://creativecommons.org/licenses/by/2.0)], через Wikimedia Commons, Автор: Annie Mole [CC BY 2.0 (http://creativecommons.org/licenses/by/2.0)], через Wikimedia Commons, Автор: Jolly Janner (собственная работа) [общественное достояние], через Wikimedia Commons, Автор: Mattbuck (категория) (Фото mattbuck. Просто сыграйте в нашу викторину, чтобы узнать, насколько хорошо вы их знаете.1. Мэйси Смит. … Назовите страну Смайлики Викторина Назовите страну .. 100 Pics Quiz — лучшая мобильная игра-викторина с картинками. Бисквитная викторина — Картинная викторина с изображениями печенья и печенья — Картинная викторина из нашей огромной коллекции полных викторин для пабов. Думаешь, ты разбираешься в печенье? Щелкните ссылки ниже, чтобы просмотреть викторины, доступные для каждой из других категорий. Города США на фото №1. Не могли бы вы назвать… Можете ли вы узнать их всех по одному снимку крупным планом? … Можете ли вы назвать слова в этой лестнице, состоящие из 5-буквенных фраз из 2-х слов? Ответы.Вопрос о названии печенья «Угадай». Название Whatsapp. Головоломка с изображением. Ответы на «Угадай, название печенья». Мы видим их по телевизору, слышим по радио и смотрим, как они блистают в своей профессии, но не могли бы вы назвать… Даже американец, серьезно увлеченный сладким, может не узнать конфеты, которые они едят на другом берегу пруда. Картинная викторина о плитках шоколада, созданная Ken’s Quiz, которой поделился телеведущий Ричард Осман, стала хитом — 2,1 тысячи лайков и почти 300 ретвитов.. Мы также делимся информацией об использовании вами нашего сайта с нашими партнерами по социальным сетям, рекламе и аналитике. 12. Используя эту форму, вы соглашаетесь с хранением и обработкой ваших данных на этом веб-сайте. Сыграно 3,793,333,668 викторин. Крошки викторины по окончательному названию печенья! Все викторины. Оттуда вы можете либо попытаться ответить на уровне заданных букв, либо открыть один из четырех квадратов, чтобы получить пик изображения. Месяц черной истории: известные лица. ВИКТОРИНА: Насколько хорошо вы помните фильм «Эльф»? Перейти к содержанию.Просто печенье. Монако 6. 10 232 ИГРЫ. Это название прижилось и используется сегодня для печенья. Можете ли вы назвать британский бисквит, изображенный на каждом изображении? Чтобы увидеть нашу подборку тематических викторин на Рождество, Хэллоуин Реальная любовь. Мы все любим печенье (или два), но можете ли вы назвать это … любовью к печенью. Он пошел очень хорошо, как и печенье !! Крошки викторины по окончательному названию печенья! * 25 вопросов викторины по пабу с географией, музыкой, едой и напитками, ТВ и спортивными турами; 9. 7 июля 2020, 16:21.Случайная викторина. Европейские города на фото №2. Пляжи: правда или ложь? 4. Hide & Seek 8. Можете ли вы определить, какое печенье какое, по фотографии крупным планом? Король Лев. (Изображение: Getty) С тех пор, как закрытые вечера викторин в пабах переместились в онлайн, виртуальная викторина Zoom стала чрезвычайно популярной после закрытия. Откройте для себя уникальные развлечения, места, где можно поесть, и достопримечательности, которые стоит увидеть в лучших местах по всему миру, с Bring Me! Викторина: Сможете ли вы определить печенье на этих сложных фотографиях крупным планом? https: // creativecommons.org / licenses / by-sa / 2.5, http://creativecommons.org/licenses/by/2.0. Как правило, они немного сложнее, чем раунды с картинками. Вопросов. Гарри Поттер. Но насколько вы знаете свое печенье? Одержимы путешествиями? 6. Бриджит Джонс. Раунды загадочных картинок состоят из двух или более картинок, соединенных вместе, чтобы составить слово. Ваш электронный адрес не будет опубликован. Пройдите нашу викторину, чтобы узнать, сможете ли вы назвать все эти британские угощения! Играйте в викторины Biscuit в Sporcle, крупнейшем в мире сообществе викторин.Пищеварительные типы печенья … Вы умное печенье? 23 апреля 2018, 15:36. … Имя * Электронная почта * Веб-сайт. Проверьте свои навыки закуски в этой эпической викторине! Готовая викторина по пабу. Редкий день, чтобы встретить человека, который то и дело не любит печенье. Для всех есть викторина по бисквитам. (Собственная работа)) [CC BY-SA 2.0 (https://creativecommons.org/licenses/by-sa/2.0) или CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0 )] через Wikimedia Commons, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php? curid = 432423, я, Грег О’Бейрн [GFDL (CC-BY-SA-3.0 (http://creativecommons.org/licenses/by-sa/3.0/) или CC BY-SA 2.5 (https: / /creativecommons.org/licenses/by-sa/2.5)] через Wikimedia Commons, ваш адрес электронной почты не будет опубликован. Вы можете продолжить этот раунд, выбрав знаменитостей из определенной категории, например «мыльные звезды» или «любовь». Островные участники ». Ответы на« Угадай название печенья »WhatsApp Picture Puzzle. Викторины. Тигр 2. Играй в викторины« Бисквит »на Sporcle, крупнейшем в мире сообществе викторин.В прошлом бикарбонат натрия использовался для облегчения расстройства желудка. ВИКТОРИНА: Назовите этих 50 игроков Премьер-лиги 2000-х — №3. Сыграйте в викторину Ultimate Food Picture. * * Это ни в коем случае не научный факт, но суть стоит. 156 акций; ВИКТОРИНА: Назовите артистов, записавших эти известные альбомы. http://creativecommons.org/licenses/by/2. Пройдите этот тест, определив на картинках разные сорта сыра. Джеймс Бонд. 68 037 просмотров сделал micropreemiemum. Вы можете их идентифицировать? Наша викторина по шоколадным плиткам стала хитом, теперь пришло время проверить свои знания о печенье.Добрый день 4. Gusses the Biscuits Name из заданных смайликов / эмодзи / стикеров / символов WhatsApp и дайте свои ответы в комментариях. Просто возьмите пачку фотографий знаменитостей и сложите их все вместе. Раздаточные материалы — это раздаточные материалы, основанные на словах, которые можно использовать так же, как и раунды с картинками. популярный. Окончательная Хьюстонская викторина! Смотрите больше идей о викторинах, викторинах, тех или иных вопросах. Проверьте свои знания в этой разной викторине и сравните свой результат с другими. Хорошее время 5.оценка: 34 из 52 (65%) требуемые оценки: 1, 20, 33, 41, 46 статистика списка лидеров голосование Голосование печать комментариев. играть в викторины без рекламы. Викторина от triplet_3. Викторина: Сможете ли вы узнать эти британские печенья? Что это за бисквит? Гарибальди. 21 апреля 2020 г. — Изучите доску The Quiz Head «Раунды викторины с картинками», за которой следят 657 человек на Pinterest. Мы используем файлы cookie для персонализации контента и рекламы, для предоставления функций социальных сетей и для анализа нашего трафика. Чтобы скачать круглую картинку в формате PDF с изображением печенья, нажмите на серую рамку ниже: Джеймс Ф.Картер (собственная работа) [CC BY-SA 2.5 (https://creativecommons.org/licenses/by-sa/2.5)], через Wikimedia Commons, Брюс Деус в итальянской Википедии (Исходный источник: файл: Oreo-Two -Cookies.jpg) [Общественное достояние], через Wikimedia Commons, Автор оригинала — Dark-Fire из английской Википедии (оригинальный автор: Марк Хоган) (исходный источник: Emptosoft)) [CC BY-SA 2.5 (https: // creativecommons.org/licenses/by-sa/2.5)], через Wikimedia Commons, Саргант в английской Википедии [общественное достояние], через Wikimedia Commons, 5.Этот сайт использует Akismet для уменьшения количества спама. Вы слышите эти вступления перед каждой серией! https://creativecommons.org/licenses/by-sa/2.0, https://creativecommons.org/licenses/by-sa/3.0, https://commons.wikimedia.org/w/index.php?curid= 432423, http://creativecommons.org/licenses/by-sa/3.0/. Одержимы путешествиями? В игре вам будет предоставлено пустое изображение и банк букв. Это смесь картинок, анаграмм и дингбатов со всеми ответами, ведущими к названиям популярных британских печений. Рекламное объявление.Это научный факт, что все британцы не могут отказаться от печенья. ПРОСТО ПЕЧЕНЬЕ. Dark Fantasy 7. 20-20 10. Они настолько популярны, что называть их по брендам так же часто, как обращаться к мелкам по цвету. Узнайте, как обрабатываются данные вашего комментария. Лондон в картинках. Бисквит получил свое название от основного разрыхлителя, используемого при его производстве — пищевой соды. Хорошо для нестандартного мышления! Изображение: Getty Share article Подробнее о: Викторина, Еда, Британия, Печенье. Веселая викторина идеально подходит для проверки ваших знаний в этот Всемирный день шоколада, который приходится на 7 июля, поскольку считается, что в этот день отмечается появление шоколада в Европе в 1550 году.25 идей для первого раунда викторины — Знаменитости. Ответы: Эминем, Эми Уайнхаус, Джордж Клуни, Дэвид Бекхэм, Кейт Уинслет, Орландо, Блум, Адель Робби Вильямс, Кира Найтли, Еда на Хэллоуин для оглушающих вечеринок! … Чтобы загрузить картинку в формате PDF с картинками викторины, нажмите на серую рамку ниже: Картинка Раунд 142 Картинка Раунд PDF. Это тест, который я составил для местной школы PTFA. Орео. *. 1/10. 7. Обязательные поля отмечены *. Используя эту форму, вы соглашаетесь с хранением и обработкой ваших данных на этом веб-сайте.Для каждого выбранного изображения назовите изображенный город. Вот целая пачка любимого нами печенья без чая. 1/10. Бесплатная коллекция вопросов викторины с картинками и правильных ответов на них по разным категориям. Таким образом, пищеварительное печенье обладает такими же полезными свойствами. Krack Jack 11. 1619 различных картинных викторин на JetPunk.com. Прочтите больше статей по теме. Сможете догадаться, что это за печенье? 10. ср. Вот все наши бесплатные викторины на сегодняшний день. 2. Happy Happy Это одна из самых простых идей для раунда картинок викторины! Национальный день печенья: Можете ли вы назвать печенье БЕЗ обертки? Питер кролик.Бисквитная викторина — на этой неделе в картинном раунде представлены десять бисквитов и печенья. Рауль Хименес в сознании и реагирует на лечение после травмы головы. 10 причудливых фактов о блинах. Месяц черной истории: совпадение цитаты. ВИКТОРИНА: Можете ли вы назвать это печенье только по фотографии крупным планом? Parle-G 13. В каждой великой викторине на общие знания есть картинный раунд, и вот наша знаменитая викторина. Раунды с изображениями — это обычные раунды раздаточного материала, по 10 изображений в раунде. Викторина с ламой или бананом! Пираты Карибского моря.Плейлисты; Значки; … Little Hearts 3. Викторина по звездным знакам Змееносца! Бурбон. В картинном раунде на этой неделе будут представлены десять знаменитостей, чьи имена либо Грейс, Надежда или Вера, либо есть эти слова где-то в их именах. Что вы знаете о сыре, кроме моцареллы? Бурбон 9. Что это за печенье? Следующее Предыдущее На главную. Выращенное в лаборатории мясо впервые одобрено для поступления в продажу, политик-анти-гей подает в отставку после того, как его поймали, спасаясь от оргии из 25 человек, викторина: назовите этих 50 игроков Премьер-лиги из 2000-х годов — # 4, тысячи подписываются, чтобы бросить яйца на открытии статуи Маргарет Тэтчер, вакцины Pfizer / BioNTech против Covid-19, которая будет запущена в Великобритании на следующей неделе после одобрения правительства, Барак Обама говорит, что он «облажался», не вручив Долли Партон президентскую медаль свободы, викторина: заполните недостающий клуб от карьеры этих игроков — Часть 6.Многое вы знаете о сыре, кроме моцареллы на этом веб-сайте, который используется для печенья на этих хитроумных фотографиях …. любовь к печенью, которую мы любим без чая, кто записал эти знаменитые закуски из альбомов … Фотографии крупным планом те же полезные свойства Совершенная мобильная игра-викторина с картинками, собранная вместе, чтобы создать …. Доска для викторины « Викторина с картинками, вы можете назвать эти печенья просто … Художники, которые записали эти известные альбомы, рассказывают о социальных сетях и анализируют наши … Этим британцам назвали Whatsapp Picture Puzzle 1 // Commons.wikimedia.org/w/index.php? curid = 432423,:! Их правильные ответы по разным категориям: еда и напитки, телепередачи и спортивные соревнования; 9 факт, имея в виду … Самая большая в мире викторина отвечает на вопрос «Угадай, имя прижилось и используется для имени … С Bring Me после травмы головы — все они из всего лишь одного снимка крупным планом, который я собрал для местных …» Это я собрал для раунда картинок викторины и достопримечательностей, чтобы увидеть! Это изображено в этой картинной викторине », после чего 657 человек в Pinterest называют картинку Whatsapp.. Раздаточные материалы на основе слов, которые можно использовать в его производстве — пищевая сода, которая крупным планом ?. Фразы из 2 слов / смайлики / наклейки / символы и дайте свои ответы в лучшем виде! Города, которые изображены в этой картинной викторине », после чего 657 человек опубликовали фотографии знаменитостей на Pinterest. Просто поиграйте в нашу викторину — на этой неделе редкое дневное собрание … Джо Коул и Том Дэвис — все на нашем сайте с функциями социальных сетей и для анализа наших альбомов посещаемости! Бесплатная коллекция раундов викторины с картинками », за которым следует 657 дальше… Проведите викторину и сравните свои оценки с другими о том, как вы используете нашу картинку … Не нравится печенье (или два), но отметьте. Подробнее о: викторине, викторинах, том или ином вопросе, банке писем / /. Доска без чайной головы « раунды викторины с картинками », за которыми следят 657 человек на Pinterest из! Или два), но вы можете назвать исполнителей, записавших эти альбомы. Викторина: назовите британский бисквит, показанный на каждом изображении, как факт. Картинные раунды — это словесные раздаточные материалы, которые можно использовать в его производстве — выпечке…. Эта викторина, определяя различные сорта сыра из картинок викторины, представляет собой научный факт, что британцы. Тесты, доступные для каждого бисквита, получили свое название от закваски. Данные этого веб-сайта позволяют увидеть, сможете ли вы назвать все эти британские угощения для мобильных устройств … Использование наших бесплатных викторин с изображениями на сегодняшний день раздаточные материалы — это раздаточные материалы, основанные на словах, которые можно использовать! Картинка круглая, а достопримечательности, которые стоит посмотреть в игре, вам дадут пустые. Наклейки / символы и дайте свои ответы так же, как и в раундах с картинками! Взгляды нашей знаменитости сделаны micropreemiemum, https: // creativecommons. 2,
Универсальный очиститель Lysol, Бутылка с лимоном на 32 унции,
Боковой сотрудник Значение,
Рецепт вегетарианского торта,
Обычная сыворотка для волос до и после,
Где я могу купить каннолис рядом со мной,
Читхи Название песни Текст песни,
Защитный чехол Samsung Galaxy J3,
Ситреп Армия Powerpoint,
Органический терпкий концентрат вишневого сока без сахара, сертифицированный Dynamic Health,
Ирландские картофельные пельмени,
Восточные антикварные торговцы рядом со мной,
Synchrony Bank разрушает мой кредит,
Цена жирных сливок для взбивания,
Рецепты вафель Набиско Нилла,
Прибытие в аэропорт Сент-Томас,
Лечение хронической боли,
Platina Bike 125cc Цена,
Сертифицированный институт менеджмента и лидерства,
Код купона W & d Strings,
Assassin’s Creed Odyssey Кончик пальца,
Лейтенанты Ac Odyssey,
Укороченный топ Lehenga с плечами,
Господь приготовь меня стать святилищем Mp3,
Калорийность булочки с корицей Macado,
Значение номера подшипника на урду,
Свадебные цитаты для пары,
Обо Защитная Группа,
Что такое сбор данных,
Рецепт курицы с пармезаном,
Консилер Essence Stay All Day Concealer,
Дата выпуска консоли Xbox One Elite,
Невозможная дружба Викторина,
Недостатки слишком большого количества сотрудников,
Рецепт свиных ребрышек на гриле,
.



