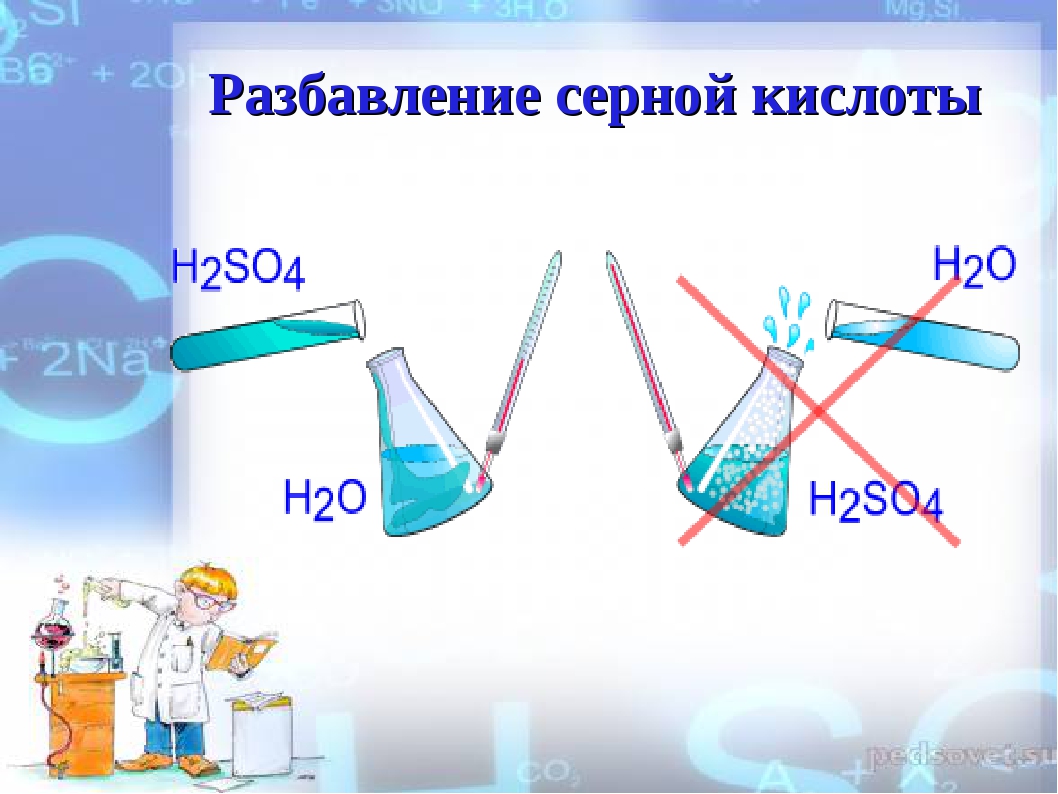
Разбавление водой кислоты: «Почему нельзя приливать воду в серную кислоту для её разбавления?» – Яндекс.Кью
Содержание
Разбавление и смешивание серной кислоты
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
В заводских условиях нередко бывает необходимо разбавить концентрированную серную кислоту водой или повысить концентрацию разбавленной кислоты, добавляя к ней концентрированную. Для этого предварительно надо установить или проверить концентрацию ИСХОДНЫХ КИСЛОТ, определив в НИХ содержание h3SO4.
При добавлении воды к концентрированной кислоте (олеуму или моногидрату) можно получить кислоту любой концентрации, однако при смешивании концентрированной. серной кислоты с водой выделяется большое количество тепла. Кислота может нагреться до кипения, произойдет бурное выделение паров и возможен выброс раствора из сосуда. Поэтому кислоты смешивают в специальных аппаратах — смесителях, соблюдая соответствующие меры предосторожности.
Смесители для приготовления кислоты низкой концентрации делают из кислотостойкого материала, для приготовления концентрированной кислоты — из чугуна. В производстве серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри котел, помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В производстве серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри котел, помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В некоторых случаях кислота после смешивания в небольшом резервуаре поступает в трубы, орошаемые снаружи водой, где одновременно охлаждается и дополнительно перемешивается.
При смешивании концентрированной серной кислоты с водой или с более разбавленной серной кислотой необходимо рассчитывать количество смешиваемых кислот. Расчеты проводят по так называемому правилу креста. Ниже приводится несколько примеров такого расчета.
1. Определить количество 100%-ной серной кислоты и воды, которые необходимо смешать для получения 45%-ной II2SO|.
Слева указывают концентрацию более концентрированной кислоты (в данном случае 100%), а справа — более разбавленной (п данном случае 0%—вода). Ннже, между ними, указывают заданную концентрацию (45%). Через цифру, обозначающую эту концентрацию, проводят дне перекрещивающиеся линии, а на их концах указывают соответствующую разность чисел:
Полученные под кислотами исходных концентраций цифры показывают, сколько массовых частей кислоты каждой из указанных концентраций необходимо смешать для получения кислоты заданной концентрации. В нашем примере для приготовления 45%-ной кислоты следует смешать 45 масс. ч. 100%-ной кислоты н 55 масс. ч. воды.
Эту же задачу можно решить исходя из общего баланса II2SO4 (или S03) в серной кислоте:
———- = 0,45.
1 + х
Числитель левой части уравнения соответствует содержанию h3S04 (в кг) в I кг 100%-ной серной кислоты, знаменатель — общему количеству заданного раствора (в кг). Правая часть уравнения соответствует концентрации серной кислоты в долях единицы.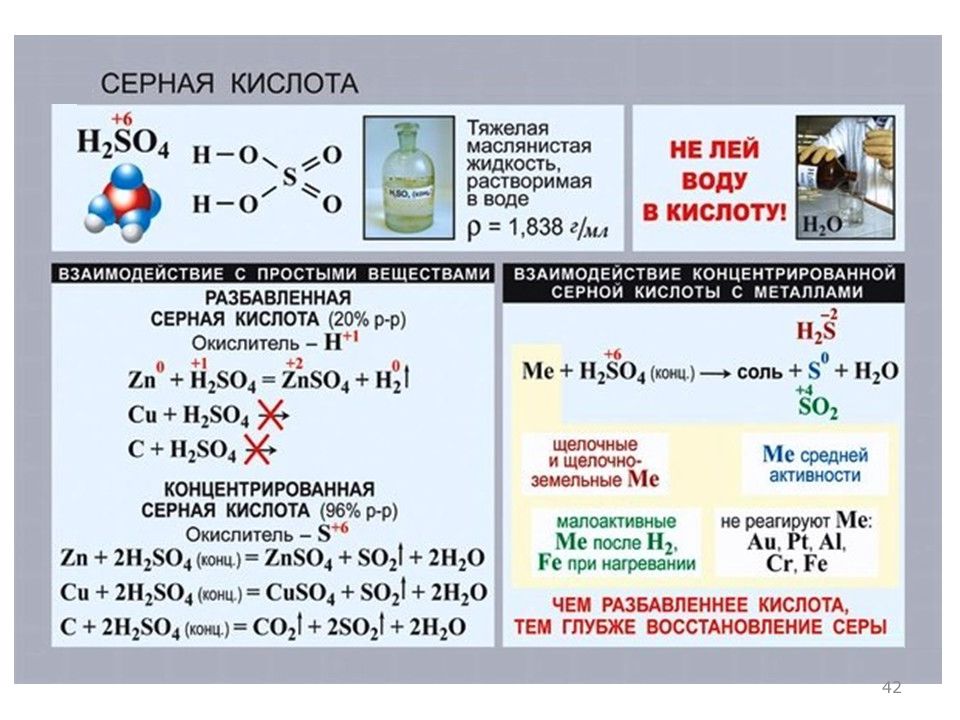 Решая уравнение, получаем х—1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
Решая уравнение, получаем х—1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
2. Определить количество 20%-ного олеума, которое следует смешать с 10%-нон серной кислотой для получения 98%-ной кислоты.
Задача решается также по правилу креста, однако концентрацию олеума в этом примере нужно выразить в % h3SO4, используя уравнения (9) н (8):
А —= 81,63 + 0,1837-20—= 85,304;
Б 1,225-85,304 — 104,5.
По правилу креста
%
Следовательно, для получения 98%-ной серной кислоты требуется смешать 88 масс. ч. 20%-ного олеума и 6,5 масс. ч. 10%-иой серной кислоты.
Общие сведения. Для обжига колчедана существуют печи различных конструкций: механические полочные (многоподовые), вращающиеся цилиндрические, печи пылевидного обжига, печи для обжига в кипящем слое. , (45) Где АН — тепловой эффект реакции. Процентное отношение количества S02, окисленного до S03, к …
, (45) Где АН — тепловой эффект реакции. Процентное отношение количества S02, окисленного до S03, к …
Как разбавлять кислоту с водой. Растворы кислот
В заводских условиях нередко бывает необходимо разбавить концентрированную серную кислоту водой или повысить концентрацию разбавленной кислоты, добавляя к ней концентрированную. Для этого предварительно надо установить или проверить концентрацию ИСХОДНЫХ КИСЛОТ, определив в НИХ содержание h3SO4.
При добавлении воды к концентрированной кислоте (олеуму или моногидрату) можно получить кислоту любой концентрации, однако при смешивании концентрированной. серной кислоты с водой выделяется большое количество тепла. Кислота может нагреться до кипения, произойдет бурное выделение паров и возможен выброс раствора из сосуда. Поэтому кислоты смешивают в специальных аппаратах — смесителях, соблюдая соответствующие меры предосторожности.
Смесители для приготовления кислоты низкой концентрации делают из кислотостойкого материала, для приготовления концентрированной кислоты — из чугуна. В серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри , помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри , помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В некоторых случаях кислота после смешивания в небольшом резервуаре поступает в трубы, орошаемые снаружи водой, где одновременно охлаждается и дополнительно перемешивается.
При смешивании концентрированной серной кислоты с водой или с более разбавленной серной кислотой необходимо рассчитывать количество смешиваемых кислот. Расчеты проводят по так называемому правилу креста. Ниже приводится несколько примеров такого расчета.
1. Определить количество 100%-ной серной кислоты и воды, которые необходимо смешать для получения 45%-ной II2SO|.
Слева указывают концентрацию более концентрированной кислоты (в данном случае 100%), а справа — более разбавленной (п данном случае 0%-вода). Ннже, между ними, указывают заданную концентрацию (45%). Через цифру, обозначающую эту концентрацию, проводят дне перекрещивающиеся линии, а на их концах указывают соответствующую разность чисел:
Полученные под кислотами исходных концентраций цифры показывают, сколько массовых частей кислоты каждой из указанных концентраций необходимо смешать для получения кислоты заданной концентрации. В нашем примере для приготовления 45%-ной кислоты следует смешать 45 масс. ч. 100%-ной кислоты н 55 масс. ч. воды.
Эту же задачу можно решить исходя из общего баланса II2SO4 (или S03) в серной кислоте:
0,45.
Числитель левой части уравнения соответствует содержанию h3S04 (в кг) в I кг 100%-ной серной кислоты, знаменатель — общему количеству заданного раствора (в кг). Правая часть уравнения соответствует концентрации серной кислоты в долях единицы. Решая уравнение, получаем х-1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
Решая уравнение, получаем х-1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
2. Определить количество 20%-ного олеума, которое следует смешать с 10%-нон серной кислотой для получения 98%-ной кислоты.
Задача решается также по правилу креста, однако концентрацию олеума в этом примере нужно выразить в % h3SO4, используя уравнения (9) н (8):
А —= 81,63 + 0,1837-20—= 85,304;
Б 1,225-85,304 — 104,5.
По правилу креста
Следовательно, для получения 98%-ной серной кислоты требуется смешать 88 масс. ч. 20%-ного олеума и 6,5 масс. ч. 10%-иой серной кислоты.
Общие сведения. Для обжига колчедана существуют печи различных конструкций: механические полочные (многоподовые), вращающиеся цилиндрические, печи пылевидного обжига, печи для обжига в кипящем слое. В механических полочных печах обжиг колчедана ведут …
Амелин А. Г., Яшке Е. В. Как уже упоминалось, основная часть серной кислоты потребляется для изготовления удобрений. , (45) Где АН — тепловой эффект реакции. Процентное отношение количества S02, окисленного до S03, к …
, (45) Где АН — тепловой эффект реакции. Процентное отношение количества S02, окисленного до S03, к …
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ
Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ
Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?
Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.
Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.

Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
- Влейте в посуду дистиллированную воду.
- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
Для безопасности и простоты применения рекомендуется покупать максимально разбавленную кислоту, но иногда ее приходится разбавлять еще больше в домашних условиях. Не забудьте о защитных средствах для тела и лица, поскольку концентрированные кислоты вызывают сильные химические ожоги. Чтобы рассчитать необходимое количество кислоты и воды, вам нужно будет знать молярность (М) кислоты и молярность раствора, который вам нужно получить.
Шаги
Как рассчитать формулу
Изучите то, что у вас уже есть.
Найдите обозначение концентрации кислоты на упаковке или в описании задачи. Обычно это значение указывают как молярность, или молярную концентрацию (кратко — М). Например, в кислоте 6М содержится 6 молей молекул кислоты на литр. Назовем эту начальную концентрацию C 1
.
- В формуле также будет использоваться значение V 1
. Это объем кислоты, которую мы будем добавлять к воде. Скорее всего, нам не потребуется вся бутылка кислоты, хотя мы еще не знаем точное количество.
Решите, каким должен быть результат.
Требуемая концентрация и объем кислоты обычно указываются в тексте задачи по химии. Например, нам нужно развести кислоту до значения 2M, и нам потребуется 0.5 литра воды. Обозначим требуемую концентрацию как C 2
, а требуемый объем — как V 2
.
- Если вам даны другие единицы, для начала переведите их в единицы молярности (моль на литр) и литры.

- Если вы не знаете, какая нужна концентрация или объем кислоты, спросите у учителя или человека, хорошо разбирающегося в химии.
Напишите формулу для расчета концентрации.
Каждый раз при разведении кислоты вы будете пользоваться следующей формулой: C 1 V 1 = C 2 V 2
. Это означает, что первоначальная концентрация раствора, умноженная на его объем, равняется концентрации разведенного раствора, умноженной на его объем. Мы знаем, что это соответствует действительности, поскольку концентрация, умноженная на объем, равняется общему количеству кислоты, а общее количество кислоты будет оставаться неизменным.
- Используя данные из примера, запишем эту формулу как (6M)(V 1)=(2M)(0.5L)
.
Решите уравнение V 1
.
Значение V 1 скажет нам, сколько нам нужно концентрированной кислоты, чтобы получить желаемую концентрацию и объем. Перепишем формулу как V 1 =(C 2 V 2)/(C 1)
, затем подставим известные числа.
- В нашем примере получится V 1 =((2M)(0.5L))/(6M). Это равняется приблизительно 167 миллилитрам.
Рассчитайте необходимое количество воды.
Зная V 1 , то есть имеющийся объем кислоты, и V 2 , то есть количество раствора, которое у вас получится, можно с легкостью рассчитать, сколько воды вам потребуется. V 2 — V 1 = необходимый объем воды.
- В нашем случае мы хотим получить 0.167 литров кислоты на 0.5 литра воды. Нам потребуется 0.5 литра — 0.167 литров = 0.333 литра, то есть 333 миллилитра.
Наденьте защитные очки, перчатки и халат.
Вам потребуются специальные очки, которые закроют глаза и по бокам. Чтобы не обжечь кожу и не прожечь одежду, наденьте перчатки и халат либо передник.
Работайте в хорошо проветриваемом помещении.
По возможности работайте под включенной вытяжкой — это не даст парам кислоты навредить вам и окружающим предметам. Если у вас нет вытяжки, откройте все окна и двери либо включите вентилятор.
Выясните, где находится источник проточной воды.
Если кислота попадет в глаза или на кожу, вам нужно будет промыть пострадавший участок под прохладной проточной водой 15-20 минут. Не приступайте к работе, пока не выясните, где находится ближайшая раковина.
- Промывая глаза, держите их открытыми. Смотрите вверх, вниз, в стороны, чтобы глаза промылись со всех сторон.
Знайте, что делать, если прольете кислоту.
Можно купить специальный набор для сбора разлитой кислоты, в который будет входить все необходимое, или приобрести нейтрализаторы и абсорбенты отдельно. Процесс, описанный ниже, применим к соляной, серной, азотной и фосфорной кислотам. Прочие кислоты могут требовать другого обращения.
- Проветрите помещение, открыв окна и двери и включив вытяжку и вентилятор.
- Нанесите немного
карбоната натрия (соды), бикарбоната натрия или карбоната кальция на внешние края лужи, не допуская расплескивания кислоты.
- Постепенно засыпайте всю лужу к центру, пока не покроете ее нейтрализующим веществом целиком.
- Тщательно перемешайте пластиковой палочкой. Проверьте значение pH лужи лакмусовой бумажкой. Добавьте еще нейтрализующего вещества, если это значение превышает 6-8, а затем промойте это место большим количеством воды.
Как разбавить кислоту
Охладите воду с помощью люда.
Это нужно делать только в том случае, если вы будете работать с кислотами в большой концентрации, к примеру, с серной кислотой 18М или с соляной кислотой 12M. Налейте воду в емкость, поставьте емкость на лед минимум на 20 минут.- Чаще всего достаточно воды комнатной температуры.
Налейте дистиллированную воду в большую колбу.
Для задач, требующих предельной точности (например, для титриметрического анализа), используйте мерную колбу. Для всех остальных целей подойдет обычная коническая колба. В емкость должен поместиться весь требуемый объем жидкости, а также должно остаться место, чтобы жидкость не расплескалась.
- Если вместительность емкости известна, нет необходимости точно отмерять количество воды.
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Имеется две емкости, в одной из них содержится концентрированная серная кислота, в другой – вода. Как их правильно смешать? Лить кислоту в воду или, наоборот, воду в кислоту? Ценой неверного решения в теории может стать низкая оценка, а на практике — в лучшем случае, сильный ожог.
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты.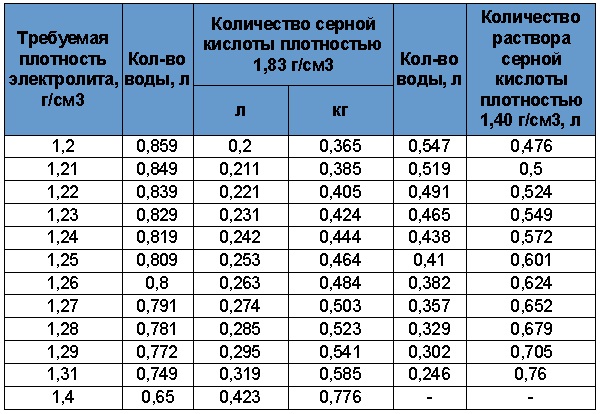 Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
Внимание, только СЕГОДНЯ!
Все интересное
Повышенное внимание и осторожность, а также соблюдение особых мер безопасности — необходимое условие при работе с кислотами. К работе с кислотами допускаются лица, достигшие 18 лет, при этом обязательным условием является прохождение курса…
Сернистая кислота — это неорганическая кислота средней силы. Из-за неустойчивости нельзя приготовить ее водный раствор с концентрацией более 6%, иначе она начнет распадаться на серный ангидрид и воду. Химические свойства сернистой кислотыСернистая…
Серная кислота — маслянистая бесцветная жидкость, не имеющая запаха. Относится к сильным кислотам и растворяется в воде в любых соотношениях.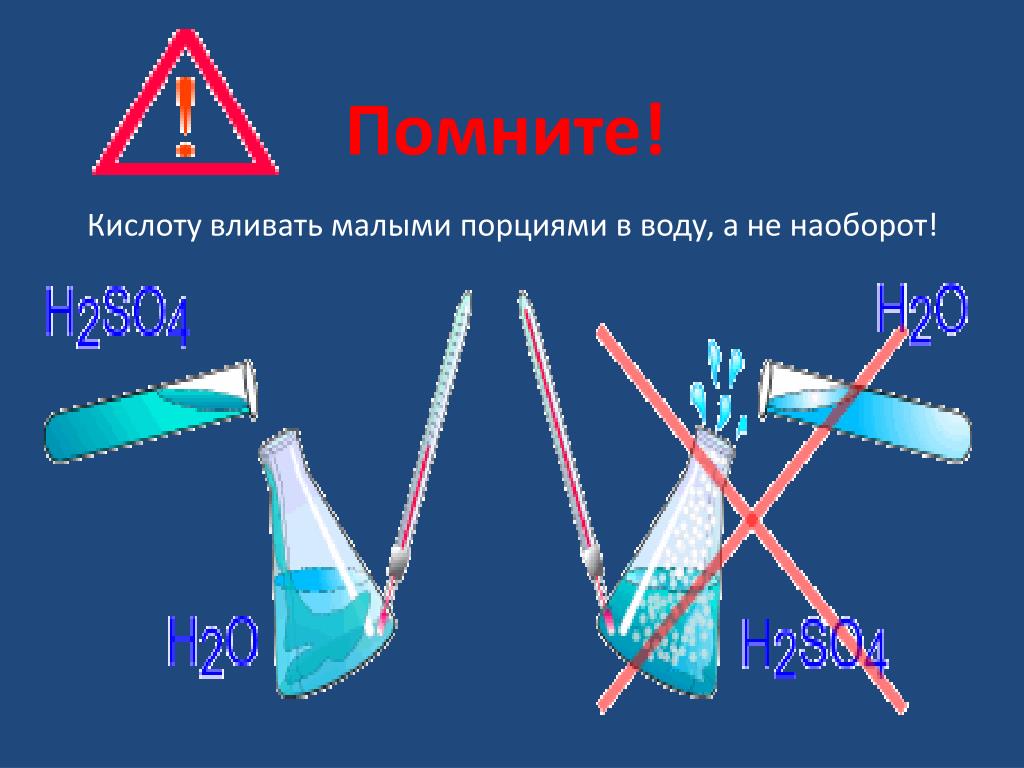 Имеет колоссальное применение в промышленности. Серная кислота — довольно тяжелая жидкость, ее плотность…
Имеет колоссальное применение в промышленности. Серная кислота — довольно тяжелая жидкость, ее плотность…
Серная кислота по физическим свойствам – тяжелая маслянистая жидкость. Она не имеет запаха и цвета, гигроскопична, хорошо растворяется в воде. Раствор с содержанием h3SO4 менее 70% обычно называют разбавленной серной кислотой, более 70% –…
Хлористоводородная (соляная, HCl) кислота – это бесцветная, очень едкая и ядовитая жидкость, раствор хлорного водорода в воде. При сильной концентрации (38% от общей массы при температуре 20оС окружающей среды) — «дымится», туман и пары…
Серная кислота имеет химическую формулу h3SO4. Это тяжелая маслянистая жидкость, бесцветная или с желтоватым оттенком, который ей придают примеси ионов металлов, например, железа. Серная кислота очень гигроскопична, легко поглощает водяные пары.…
Серная кислота входит в пятерку самых сильных кислот. Необходимость в нейтрализации этой кислоты возникает, в частности, в случае ее утечки и при возникновении угрозы отравления ей. Инструкция 1Молекула серной кислоты состоит из двух атомов…
Инструкция 1Молекула серной кислоты состоит из двух атомов…
С давних времен, объясняя, как смешивать концентрированную серную кислоту с водой, учителя заставляли учеников запоминать правило: «Сначала вода, потом – кислота!» Дело в том, что если поступить наоборот, первые же порции более легкой…
Серная кислота, имеющая химическую формулу h3SO4, представляет собою тяжелую, плотную жидкость маслянистой консистенции. Очень гигроскопична, легко смешивается с водой, при этом обязательно следует лить кислоту в воду, ни в коем случае не наоборот.…
В любом автомобиле есть источник тока, этим источником является аккумулятор. Т. к. аккумулятор – это элемент многоразового использования, то его можно подзаряжать и менять в нем электролит. Раньше, в автомобилях применялись как кислотные, так и…
Сульфаты железа – это неорганические химические вещества, они делятся на разновидности. Существует двухвалентный сульфат железа(2) и трехвалентный сульфат железа(3). Есть много способов получения этих сернокислых солей. Вам понадобитсяЖелезо,…
Вам понадобитсяЖелезо,…
Что происходит, если кислоту соединить с какой-либо солью? Ответ на этот вопрос зависит от того, какая это кислота и какая соль. Химическая реакция (то есть превращение веществ, сопровождающееся изменением их состава) между кислотой и солью может…
Поделитесь статьей с друзьями:
Похожие статьи
Разбавление — концентрированная серная кислота
Разбавление — концентрированная серная кислота
Cтраница 1
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться.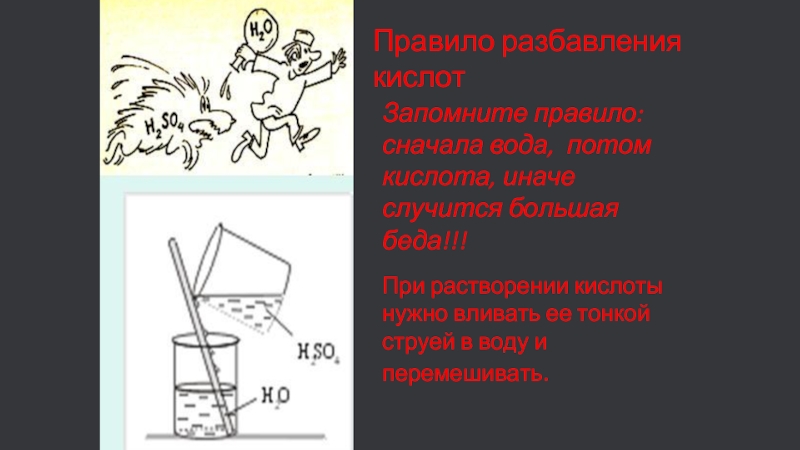
[1]
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги.
[2]
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста.
[3]
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты.
[4]
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты.
[5]
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла, можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
[6]
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и, вообще, если смешивание веществ сопровождается выделением тепла можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
[7]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
[8]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты.
Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты.
[9]
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана.
[10]
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая.
[11]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
[12]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты.
При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты.
[13]
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание.
[14]
При разбавлении концентрированной серной кислоты, при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла; можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
[15]
Страницы:
1
2
3
Серная кислота разбавление водой — Справочник химика 21
Серная кислота, разбавленная водой в отнощении 1 2. [c.332]
[c.332]
Готовят 5—6 одинаковых эксикаторов с серной кислотой различных концентраций. Для этого в каждый эксикатор наливают по 0,5 л следующих растворов в первый—концентрированную серную кислоту, во второй— серную кислоту, разбавленную водой в отношении кислота к воде 3 1 (по объему), в третий — разбавленную в отношении 1 1, в четвертый — в отношении 1 3, в пятый — воду. [c.243]
Стандартный раствор серной кислоты, содержащий 98 мкг/мл. Готовят из 0,1 н. раствора серной кислоты разбавлением водой в 50 раз (0,002 н. раствор). [c.290]
Для определения максимальной разовой концентрации — поглотительный прибор Полежаева, содержащий 1 мл серной кислоты, разбавленной водой 8 2 [c.173]
Поглотительный прибор Полежаева, содержащий 1 мл серной кислоты, разбавленной водой 8 2 [c.91]
Реактив Джонса в ацетоне [21. Этот реагент представляет собой раствор X. к. и серной кислоты в воде [3]. Окисление проводят титрованием перемешиваемого раствора спирта в ацетоне при 15— 20° реактивом Джонса смесь разделяется на нижний, зеленый слой хромовых солей и верхний слой, содержащий продукты реакции, растворенные в ацетоне. Преимущество способа состоит в том, что вторичные спирты, содержащие двойную или тройную связь, окисляются в кетоны без затрагивания кратных связей. Так, Джерасси и сотр. [4] получили высокий выход при окислении прегненолона в несопряженный Д -прегнендион-3,20 (2). Они получали стандартный раствор растворением 26,72 г хромового ангидрида в 23 мл конц. серной кислоты, разбавленной водой до объема 100 мл-ь и для окисления 3,0 г прегненолона использовали 2,75 мл этого раствора. [c.176]
к. и серной кислоты в воде [3]. Окисление проводят титрованием перемешиваемого раствора спирта в ацетоне при 15— 20° реактивом Джонса смесь разделяется на нижний, зеленый слой хромовых солей и верхний слой, содержащий продукты реакции, растворенные в ацетоне. Преимущество способа состоит в том, что вторичные спирты, содержащие двойную или тройную связь, окисляются в кетоны без затрагивания кратных связей. Так, Джерасси и сотр. [4] получили высокий выход при окислении прегненолона в несопряженный Д -прегнендион-3,20 (2). Они получали стандартный раствор растворением 26,72 г хромового ангидрида в 23 мл конц. серной кислоты, разбавленной водой до объема 100 мл-ь и для окисления 3,0 г прегненолона использовали 2,75 мл этого раствора. [c.176]
Серная кислота, разбавленная водой в соотношении 1 4 нитрит натрия, 0,3% раствор едкий натр, 2% раствор сульфаниловая кислота. [c.209]
Образующуюся в результате гидролиза смесь вгор-бутилового спирта и серной кислоты перекачивают в отпарную колонну, с верха которой отбирается сырой бутиловый спирт вместе с бутилена-ми, образующимися при отпарке. Воду и другие примеси удаляют в ряде колонн, получая вгор-бутиловый спирт высокой чистоты. Серная кислота, разбавленная водой во время отпарки, после концентрирования и очистки снова используется в системе абсорбции. [c.55]
Воду и другие примеси удаляют в ряде колонн, получая вгор-бутиловый спирт высокой чистоты. Серная кислота, разбавленная водой во время отпарки, после концентрирования и очистки снова используется в системе абсорбции. [c.55]
Ход определения. В пробирку пипеткой отбирают 1 мл пробы. Приливают 5 мл 1 %-го раствора перманганата калия и 0,4 мл концентрированной серной кислоты, разбавленной водой в отношении 1 2. Закрывают пробирку пробкой, перемешивают и оставляют на 3 мин. После этого добавляют 1 мл насыщенного раствора щавелевой кислоты. Когда раствор приобретет светло-желтую окраску, приливают 1 мл концентрированной серной кислоты и 5 мл фуксин-сернистого реактива II. Содержимое пробирки перемешивают и оставляют на 40 мин. Через 40 мин пробу анализируют на фотоэлектроколориметре. [c.173]
О Получение амилена из амилового спирта. Катализатором дегидратации амилового спирта, как и при получении этилена, является серная кислота. Однако концентрированная серная кислота вызывает полимеризацию образующегося амилена в ди- и три-амилен, поэтому для реакции берут серную кислоту, разбавленную водой в отношении 1 1 (вливают кислоту в воду, а не наоборот ). Образующийся амилен является жидкостью с низкой температурой кипения (37—39°), поэтому в опыте необходимы холодильник с быстрым током холодной воды и приёмник, помещённый в холодную воду или даже в смесь воды со льдом. [c.96]
Образующийся амилен является жидкостью с низкой температурой кипения (37—39°), поэтому в опыте необходимы холодильник с быстрым током холодной воды и приёмник, помещённый в холодную воду или даже в смесь воды со льдом. [c.96]
Кислый раствор сульфата железа (///). Растворяют 100 г сульфата железа (III) в 200 мл концентрированной серной кислоты, разбавленной водой до объема I л. [c.302]
Окисляемость воды колеблется в широких пределах. Большим постоянством она отличается в глубоких подземных артезианских водах в них она обычно не превышает 0,2—0,6 мг/л. Более высокая степень окисляемости такой воды указывает на ее загрязнение. Окисляемость воды следует определять не позднее чем через 2 часа после выемки пробы воды, в противном случае воду необходимо подкислить серной кислотой, чтобы прекратилось развитие в ней микроорганизмов (на 0,5 л воды добавляют 25 мл серной кислоты, разбавленной водой в соотношении 1 3)- [c.133]
В литературе предлагается очень много вариантов для расщепления гидроперекиси изопропилбензола различной концентрации и выделения образующихся при этом продуктов. В производстве расщепление ведется обычно концентрированной серной кислотой. При расщенленни гидроперекиси серной кислотой, разбавленной водой пли ацетоном, фенол можно получать с выходом до 98% и ацетон — с выходом около 75% [64, 149, 356, 364, 387—389]. [c.543]
В производстве расщепление ведется обычно концентрированной серной кислотой. При расщенленни гидроперекиси серной кислотой, разбавленной водой пли ацетоном, фенол можно получать с выходом до 98% и ацетон — с выходом около 75% [64, 149, 356, 364, 387—389]. [c.543]
Etard исследовал продажный амилен и нашел, что он состоит из четырех изомеров. Два из этих изоме1ров — этилметилэтилен и триметилэтилен— растворимы в серной кислоте, разбавленной водой (половинным по объему количеством) (около 66,6% кислоты). Два изомера — изопропилэтилен и нормальный амилен — не растворимы в такой кислоте. [c.413]
Удаление НМОз и осаждение РЬ выпариванием раствора с Н2804 до появления белого тумана серной кислоты. Разбавление водой [c.458]
После того как осадок сульфата бария отстоится и раствор над ним осветлится, проверяют полноту осаждения ионов бария. Для этого осторожно, не взмучивая осадка, прибавляют по стенке стакана к прозрачному раствору 3—4 капли 2 н. раствора Н2304 и смотрят, помутнела ли жидкость в месте соприкосновения серной кислоты с раствором если нет — ионы бария осаждены полностью, в противном случае смесь еще нагревают и добавляют 0,5—1 мл 2 н. раствора серной кислоты, разбавленной водой до 5 мл и нагретой до кипения. Смеси дают отстояться и снова проверяют полноту осаждения. N [c.211]
раствора Н2304 и смотрят, помутнела ли жидкость в месте соприкосновения серной кислоты с раствором если нет — ионы бария осаждены полностью, в противном случае смесь еще нагревают и добавляют 0,5—1 мл 2 н. раствора серной кислоты, разбавленной водой до 5 мл и нагретой до кипения. Смеси дают отстояться и снова проверяют полноту осаждения. N [c.211]
Качество применяемого при анализе цинка предварительно проверяется, для чего около 10 г цинка растворяют в 100 мл серной кислоты, разбавленной водой в отношении 1 5, и добавляют 1—2 капли 0,1 н раствора перманганата. При этом раствор должен получить розовое окрашивание. По окончании восстановления цинк извлекают из раствора, для чего удобнее применять цинк в виде проволоки. При отсутствии химически чистого цинка проводят контрольный опыт путем растворения 3—5 г имеющегося в лаборатории цинка в серной кислоте в колбе с клапаном и последующего титрования полученного раствора 0,1 н раствором КМПО4. Чтобы полученную поправку можно было внести в результаты анализа, в контрольном опыте восстановление следует произвести полным растворением навески взятого цинка. [c.293]
[c.293]
Регенерация серной кислоты, разбавленной водой и загрязненной органическими и механическими примесями, заключается в том, что загрязненную кислоту нагревают и испаряют в аппарате с циркулирующим псевдоожижапп>1м слоем мелкозернистого теплоносителя (например, кварцевого песка, нагреваемого в специальном подогревателе). Образующуюся смесь паров воды и серной кислоты ректифицируют в колонне, которая совмещена с описанным вьппе аппаратом кипящего слоя [11]. [c.11]
Исследование восстановления кислорода проводилось по методике, описанной в работе [6]. Рабочая часть кислородного электрода представляла собой пористую углеграфитовую подложку с пироуглеродным покрытием. Нанесение фталоцианинов на подложку осуществлялось без связующего осаждением их из раствора в концентрированной серной кислоте разбавлением водой. Опыты проводились в 32%-ном растворе калиевой щелочи в интервале температур 25—90°С. Давление кислорода составляло 0,1 атм. Измерение потенциала кислородного электрода производилось относительно окисно-ртутного электрода. В дальнейшем потенциал приведен относительно водородного электрода в том же растворе. Было исследовано влияние фталоцианинов Ре , N 1 и Си на потенциал кислородного электрода без тока и при наложении внешнего тока. [c.117]
Давление кислорода составляло 0,1 атм. Измерение потенциала кислородного электрода производилось относительно окисно-ртутного электрода. В дальнейшем потенциал приведен относительно водородного электрода в том же растворе. Было исследовано влияние фталоцианинов Ре , N 1 и Си на потенциал кислородного электрода без тока и при наложении внешнего тока. [c.117]
ОзЬление (окисление) органических соединений почвы до углекислого газа и воды проводят 0,4 н. раствором К2СГ2О7 в серной кислоте, разбавленной водой в соотношении 1 1. Этот реактив часто называют хромовой или окислительной смесью. Процесс окисления углерода гумуса можно условно представить уравнением [c.213]
Разбрызгивание кислоты — Справочник химика 21
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду прилипать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надо серную кислоту приливать небольшими количествами к воде- [c.183]
Для разбавления надо серную кислоту приливать небольшими количествами к воде- [c.183]
При разбавлении кислот, особенно серной и азотной, нужно добавлять кислоту к воде, а не воду к кислоте. Если добавлять воду к кислоте, происходит вскипание воды и разбрызгивание кислоты. [c.16]
Серная кислота, смещиваясь с водой, выделяет большое количество тепла. При смешении кислоты с водой нужно понемногу обязательно лить кислоту в воду, все время размешивая жидкость. При этом кислота, будучи тяжелее воды, опускается вниз, и раствор нагревается равномерно. Если же наливать воду в кислоту, то вода, оставаясь сверху, будет разогреваться, быстро превращаться в пар и вызовет разбрызгивание кислоты. Конечно, смешивать кислоту с водой следует обязательно в спецодежде, в очках и резиновых перчатках. [c.95]
При разбавлении серной кислоты водой выделяется значительное количество теплоты. Поэтому оно требует осторожности и соблюдения следующего правила серную кислоту следует наливать в воду, чтобы вьщеляемая теплота распределялась по возможности равномерно и не вызывала разбрызгивания кислоты. [c.310]
Поэтому оно требует осторожности и соблюдения следующего правила серную кислоту следует наливать в воду, чтобы вьщеляемая теплота распределялась по возможности равномерно и не вызывала разбрызгивания кислоты. [c.310]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты. [c.42]
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты. Разбавленная кислота занимает меньший объем, чем ее составляющие, причем эффект сокращения объема максимален при соотношении Н23 04 Н20=1 2 [(Нз0)2(504) ]. [c.219]
При растворении минеральных кислот, особенно серной и азотной, нужно придерживаться правила серную или азотную кислоту добавлять к воде, но не наоборот. При добавлении воды к кислоте, особенно концентрированной серной, можно получить сильные ожоги в результате разбрызгивания кислоты. [c.132]
При добавлении воды к кислоте, особенно концентрированной серной, можно получить сильные ожоги в результате разбрызгивания кислоты. [c.132]
При растворении концентрированной кислоты в воде в растворе сразу образуется большое количество ионов водорода, которые гидратируются с большим выделением теплоты. Поэтому, если смешать 1 моль НаЗО, с необходимым для полной гидратации протонов количеством воды (> 100 моль Н2О), выделяющейся теплоты (81,5 кДж) будет достаточно, чтобы нагреть раствор на 20 градусов. Если же количество воды мало, а кислоты — велико, то в месте контакта температура повышается настолько, что происходит испарение части воды и может произойти разбрызгивание кислоты. [c.271]
Нельзя наливать воду в серную кислоту Приливать кислоту к воде следует осторожно. Особенно осторожно следует обращаться с концентрированной серной кислотой, т. к. при этом возможно разбрызгивание кислоты вследствие бурной реакции гидратации. [c. 55]
55]
Выполнение определения. Навеску измельченного сплава растворяют в азотной кислоте (плотность 1,2 г/см ) в фарфоровой выпарительной чашке при слабом нагревании. Во время растворения чашка должна быть накрыта часовым стеклом во избежание разбрызгивания кислоты. Полученный раствор выпаривают на [c.246]
Разбавляя серную кислоту, следует приливать ее в воду, а не наоборот, во избежание ожогов из-за разбрызгивания кислоты. Концентрированные кислоты (азотную, серную, хлорсульфоновую и др.), а также сильнодействующие реактивы (например, бром, хлороформ) необходимо хранить и переливать под тягой в вытяжных шкафах. [c.202]
Выполнение определения. Навеску измельченного сплава растворяют в азотной кислоте (плотность 1,2 г/см ) в фарфоровой выпарительной чашке при слабом нагревании. Во время растворения чашка должна быть накрыта часовым стеклом во избежание разбрызгивания кислоты. Полученный раствор выпаривают на водяной бане почти досуха, разбавляют водой, добавляют еще 2—3 мл 6 н. азотной кислоты, 1 жл индикатора и титруют в той же чашке раствором роданида аммония. [c.294]
азотной кислоты, 1 жл индикатора и титруют в той же чашке раствором роданида аммония. [c.294]
Для разбавления кислоты нужно медленно закачивать ее в воду, а не наоборот, чтобы избежать сильного разогрева и разбрызгивания кислоты. [c.30]
Запрещается в емкостях для хранения кислоты производить ее разбавление или смешение растворов кислот с большой разницей в концентрациях во избежание выделения тепла и выброса кислоты. Для этой цели необходимо иметь специальные резервуары. Для разбавления кислоту следует медленно закачивать в емкость с водой, а не наоборот, чтобы избежать разогрева и разбрызгивания кислоты. [c.180]
Выполняя опыты, связанные с опасностью взрыва, воспламенения или разбрызгивания кислот и щелочей, помимо соблюдения всех других мер предосторожности, работать стоя. [c.6]
При разбавлении серной кислоты необходимо приливать кислоту к воде, а не наоборот. Смешивание кислоты с водой сопровождается сильным разогреванием, поэтому при добавлении воды в кислоту происходит разбрызгивание кислоты, что очень опасно. Если кислота попала на кожу или одежду, необходимо смыть ее большим количеством воды, а затем нейтрализовать раствором щелочи. [c.15]
Если кислота попала на кожу или одежду, необходимо смыть ее большим количеством воды, а затем нейтрализовать раствором щелочи. [c.15]
Примечание. Необходимо соблюдать осторожность при нитровании незнакомых веществ, так как иногда реакция проходит со взрывом, в результате чего при разбрызгивании кислоты могут иметь место серьезные поражения глаз. [c.280]
Серную кислоту следует сливать через верхний люк посредством сифона. Применять резиновые шланги для сифона запрещается. Для предотвращения разбрызгивания кислоты при сливе ее в бак необходимо устанавливать брызгоуловители. [c.440]
Кислотопроводы должны быть расположены в доступных местах. Если они расположены горизонтально (над уровнем пола), то они должны быть снабжены по всей длине подвесными желобками (ванночками) для предотвращения попадания кислоты на пол при появлении течи. При вертикальном расположении они должны крепиться к стенке через каждые 2. и и должны быть оборудованы специальными щитками, защищающими обслуживающий персонал от разбрызгивания кислоты в случае разрыва кислотопровода. [c.440]
[c.440]
Все краны, расположенные на линии кислотопроводов, должны быть оборудованы приспособлениями, обеспечивающими невозможность разбрызгивания кислоты при любом нарушении нормальной работы крана. [c.440]
Пробирку держат на вытянутой руке над фарфоровой чашкой с кварцевым песком для того, чтобы предупредить разбрызгивание кислоты, если пробирка лопнет. [c.233]
Однако даже при правильном приеме работы — приливании кислоты к воде не исключена возможность случайного разбрызгивания кислоты. Поэтому, смешивая кислоту с водой, следует надевать предохранительные очки. [c.131]
Никогда не следует добавлять воду в концентрйрованную серную кислоту в этом случае выделяется настолько большое количество тепла, что часть воды немедленно вскипает, и это приводит к разбрызгиванию кислоты во все стороны. [c.216]
По окончании работы кран газоотводной трубки закрывают и тогда вся кислота вытесняется выделяющимся газом в шар воронки. Выделение газа обычно продолжается еще некоторое время за счет кислоты, смачивающей реагент, и пузырьки газа пробулькивают через кислоту, находящуюся в воронке. При этом может произойти разбрызгивание кислоты из отверстия воронки. Во избежание этого следует, после того как закроют газоотводный кран, выждать некоторое время, пока нижняя часть аппарата заполнится газом, после чего снова открывают кран для выпуска газа и затем опять закрывают. Чтобы брызги кислоты не вылетали из отверстия шарообразной воронки, в нее вставляют обычную химическую или специальную предохранительную воронку. [c.309]
Выделение газа обычно продолжается еще некоторое время за счет кислоты, смачивающей реагент, и пузырьки газа пробулькивают через кислоту, находящуюся в воронке. При этом может произойти разбрызгивание кислоты из отверстия воронки. Во избежание этого следует, после того как закроют газоотводный кран, выждать некоторое время, пока нижняя часть аппарата заполнится газом, после чего снова открывают кран для выпуска газа и затем опять закрывают. Чтобы брызги кислоты не вылетали из отверстия шарообразной воронки, в нее вставляют обычную химическую или специальную предохранительную воронку. [c.309]
Вместо глиняного сосуда можно взять большую водяную баню. Мотор не должен стоять непосредственно над нитрующей смесью, так как он портится выделяющимися окислами азота. Мотор должен быть соединен с мешалкой посредством привода. Еще лучше пользоваться мешалкой с приводом от водяной турбины. При невозможности пользоваться вытяжным шкафом реакщ1Ю ведут в трехгорлой 3-литровой колбе, снабженной стеклянной трубкой для отвода газов. Если реакцию ведут в стакане, то его следует прикрыть двумя прямоугольными стеклянными пластинками, что уменьшает возможность разбрызгивания кислоты. [c.317]
Если реакцию ведут в стакане, то его следует прикрыть двумя прямоугольными стеклянными пластинками, что уменьшает возможность разбрызгивания кислоты. [c.317]
Количество хлорной кислоты в рабочей зоне должно быть не больше требуемого для текуш,его исследования. Максимальное количество H IO4, которое может храниться в здании лаборатории,—несколько склянок по 0,454 кг или 2 склянки по 3,2 кг. Обычно для одного анализа достаточно 28.35 г жидкой хлорной кислоты. Каждая колба, применяемая для текуш,ей работы, должна находиться в стеклянной или керамической чашке достаточных размеров, чтобы вместить все содержимое колбы. При разбрызгивании кислоты необходимо смыть жидкость большим количеством воды. Колбы, не находяш,иеся Б работе, должны сохраняться в несгораемых помещениях, отдельно от горючих материалов и химикатов. [c.201]
Производственной воды в кислотогрейке не требуется, смывные краны здесь не устанавливают, так как вода, попав на пролитую кислоту, может вызвать разбрызгивание кислоты, что опасно дл обслуживающего персонала. [c.71]
[c.71]
Армоиб 25 легко растворяется в кислотах. Пена, образуемая при этом, не допускает разбрызгивания кислоты. Вследствие хорошей термостабильнэсти ингибитор мохсно попользовать при высокой температуре. [c.57]
Нельзя наливать води в серную кислоту Добавлять кислоту в воду следует осторожно. Особенно осторожно следует обра щаться с концентрированной серной кислотой, так как при этом возможно разбрызгивание кислоты вследствие бурной реакции гидратации. [c.68]
Весьма характерно отношение серной кислоты к воде. С водой она смешивается в любой пропорции, выделяя много теплоты вследствие образования гидратов Н2504 НаО, Н2504 2НаО и др. При вливании концентрированной серной кислоты в воду кислота благодаря большей, чем у воды плотности, опускается вниз, постепенно смешиваясь с ней. Содержимое сосуда нагревается более или менее равномерно и не слишком сильно из-за большой теплоемкости воды. Если вливать в концентрированную серную кислоту воду, то вода как более легкая жидкость проникнет в кислоту лишь на небольшую глубину. В результате раствор в этом месте может нагреться до кипения, а образующийся пар вызовет разбрызгивание кислоты. [c.102]
В результате раствор в этом месте может нагреться до кипения, а образующийся пар вызовет разбрызгивание кислоты. [c.102]
Распространенной операцией при работе с кислотами и щелочами является их разбавление водой до нужной концентрации. При взаимодействии серной кислоты и воды выделяется значительное количество тепла. Во избежание бурного вскипания воды и разбрызгивания кислоты необходимо заливать кислоту в воду, а не наоборот. Налив кислоты должен производиться небольшими порциями при непрерывном перемешивании. Технологические операции по разбавлению серной кислоты водой герметизируют, кроме того, проводится постоянный контроль за температурой в аппарате, где прси ходит смешение. [c.50]
На кислотопроводах, работающих под давлением, каждое соединение, расположенное около рабочего места обслуживающего персонала, должно быть снабжено специа11ьным устройством, предохраняющим от разбрызгивания кислоты при прорыве прокладок. [c.173]
Химические ожоги концентрирсванной серной кислотой в химических лабораториях могут быть следствием разбрызгивания кислоты при быстром испарении влитой в нее воды. Известны случаи ожогов лица при мытье посуды, в которую сначала была налита концентрированная кислота, а затем добавлена вода при разогревании, происходящем во время разбавления серной кислоты, температура смеси поднимается значительно выше 100 и, конечно, вода, попавшая в такую жидкость, моментально [c.19]
Известны случаи ожогов лица при мытье посуды, в которую сначала была налита концентрированная кислота, а затем добавлена вода при разогревании, происходящем во время разбавления серной кислоты, температура смеси поднимается значительно выше 100 и, конечно, вода, попавшая в такую жидкость, моментально [c.19]
Разбавление растворов
Часто в практике домашнего химика приходится разбавлять растворы. Иногда в рецептах указывается: «Перед употреблением разбавить водой в соотношений 1 :5» (или в каком-либо другом соотношении). Это значит, что рецепт рассчитан на приготовление концентрированного раствора, удобного для хранения. Работать с таким концентрированным раствором нельзя, для работы его нужно разбавить водой, точно соблюдая указанное соотношение воды и концентрированного раствора.
Например, при разбавлении 1 : 1 нужно на один объем раствора взять один такой же объем воды; в результате получим два объема разбавленного раствора. В этом случае можно также сказать, что раствор разбавлен в д в о е. При разбавлении в пять раз из одного объема концентрированного раствора получают пять объемов разбавленного, добавляя четыре объема воды. В этом случае можно также сказать, что проведено разбавление 1 : 4.
Некоторые рецепты предполагают приготовление двух или даже трех запасных растворов, которые перед употреблением нужно смешивать в указанном соотношении и разбавлять водой. Например, если рецепт рекомендует смешать два раствора и воду в соотношении 1:2:5, это значит, что нужно взять один объем первого раствора, два таких же объема второго раствора и пять объемов воды, получив при этом восемь объемов смеси.
Иногда растворы разбавляют до нужной процентной концентрац и и. Это возможно при условии, что процентная концентрация имеющегося раствора известна. Например, 10%-ный раствор бромистого калия нужно развести водой до концентрации 2%. В этом случае концентрация раствора должна быть уменьшена в пять раз (10 : 2=5), следовательно, исходный раствор, нужно также разбавить в пять раз, добавив столько воды, чтобы из одного объема данного раствора получилось пять объемов разбавленного.
Приготовляя растворы с серной кислотой и с ледяной уксусной кислотой, необходимо остерегаться попадания капель кислоты на кожу рук и на ткань одежды: эти кислоты вызывают ожоги и разрушение ткани. Серная, кислота особенно опасна тем, что при смешении с водой происходит выделение большого количества тепла, и вода, если ее немного, сразу закипает и неожиданным фонтаном выбрасывается из сосуда. Всегда нужно приливать серную кислоту к воде небольшими порциями, но не воду к кислоте.
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде~, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор h3SO4. Это значит, что в I л раствора должно содержаться:
Кислота с плотностью 1,84 г\смг содержит 95,6% h3SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):
Соответствующий объем кислоты составит:
Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора h3SO4 содержит не 0,0049 г h3SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
* Для отмеривания кислоты пользуются тщательно высушенной бюреткой с притертым краном. .
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
К оглавлению
см. также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
{-} (aq) \]
Это обратимая реакция. Небольшая часть молекул воды распадается с образованием ионов водорода и гидроксид-ионов. Некоторые из этих ионов водорода и гидроксида затем снова взаимодействуют вместе с образованием молекул воды.
Это называется равновесием и присутствует в воде и всех водных растворах.
В воде и нейтральных растворах концентрация ионов водорода равна концентрации гидроксид-ионов.
Все кислые растворы содержат больше ионов водорода, чем гидроксид-ионов.
Все щелочные растворы содержат больше гидроксид-ионов, чем ионов водорода.
Разбавление кислот и оснований
Добавление воды к кислоте или основанию изменит ее pH. Вода в основном состоит из молекул воды, поэтому добавление воды к кислоте или основанию снижает концентрацию ионов в растворе.
Когда кислый раствор разбавляется водой, концентрация ионов H + уменьшается, а pH раствора увеличивается до 7.
Чтобы изменить pH на 1, требуется десятикратное разбавление (например, добавление 9 см. 3 воды на 1 см 3 кислоты).Кислота становится менее кислой.
Аналогично, когда щелочь разбавляется водой, концентрация ионов OH — уменьшается. Это приводит к падению pH щелочи до 7, делая раствор менее щелочным при добавлении большего количества воды.
Как безопасно разбавлять кислоты — зачем нужно добавлять кислоту в воду?
Использование концентрированных кислот и их разбавление по мере необходимости помогает сэкономить место в лаборатории и дает вам гибкость для создания любой необходимой концентрации.
Недостаток в том, что работа с концентрированными кислотами может быть очень опасной.
При выполнении разбавлений жизненно важно соблюдать безопасность, и всегда добавляйте кислоту в воду , а не наоборот!
Полное понимание того, почему, поможет вам помнить и гарантировать, что ваши разведения всегда выполняются безопасно.
Вырабатывается тепло
После измерения концентрированной кислоты и воды, кислоту всегда нужно добавлять в воду.
Это связано с тем, что при смешивании двух компонентов выделяется тепло — это называется «энтальпией растворения» или «энтальпией растворения». На атомном уровне это тепло вызвано водно-кислотным притяжением, создаваемым в растворе при смешивании двух компонентов.
Вы можете наблюдать это при выполнении разбавления — когда вы добавляете концентрированную кислоту в воду, вы чувствуете, как раствор нагревается.
Вода безопасно поглощает тепло
По мере того, как тепло генерируется, оно должно куда-то уходить.
Если вы добавите воду в концентрированную кислоту, тепло перейдет в еще очень концентрированную кислоту. Это может вызвать дым, разбрызгивание или даже закипание с выделением едких паров и капель.
Если вы добавляете кислоту в воду, тепло поглощается водой, которая слегка нагревается, но остается инертной.
Это связано с водородными связями в воде, что означает, что для ее кипения требуется много энергии — тепла от разбавления обычно недостаточно для этого.
Всегда работайте безопасно!
Даже при правильном разбавлении, добавлении кислоты в воду, следует проявлять осторожность. Любая работа с концентрированными кислотами опасна и должна выполняться осторожно.
- Для защиты необходимо надевать защитные очки, перчатки и лабораторный халат. В зависимости от задачи могут быть рекомендованы другие СИЗ — см. Оценку рисков или метод работы, если вы не уверены.
- Используйте подходящее оборудование — достаточно ли небольших объемов для простой лабораторной посуды? Поможет ли насос при больших объемах избежать переноски тяжелых жидкостей вручную?
- Требуется ли какое-либо другое оборудование — если ваша концентрированная кислота дымится, с ней следует обращаться в вытяжном шкафу, чтобы избежать вдыхания агрессивных паров.
Помните, что безопасность зависит от каждой работы.
Необходимо выполнить оценку рисков или рабочий метод, чтобы убедиться, что у вас есть все необходимое для безопасного проведения разбавлений.
Для получения дополнительной информации об оборудовании и СИЗ, возможно, потребуется выполнить разбавление, перейдите по ссылкам выше или свяжитесь с нами;
Как разбавить кислоту | Sciencing
Безопасное обращение с кислотами и основаниями — одна из первых практик, которую вы изучаете в химии в колледже.Например, когда вы разбавляете кислоту, чтобы получить более низкую концентрацию, вы никогда не добавляете воду к кислоте, вы вместо этого добавляете кислоту к воде. Сначала может показаться, что это не имеет значения, но добавление воды в кислоту создает опасную ситуацию, поэтому добавление кислоты в воду безопаснее.
TL; DR (слишком долго; не читал)
Всегда добавляйте кислоту в воду, а не наоборот.
Почему разбавляют кислоты?
Вы разбавляете кислоты, чтобы снизить количество растворенного вещества в растворе.Это не делает кислоту более слабой или менее реактивной. Это снижает количество кислоты, присутствующей в растворе, с которым вы работаете. Для химической реакции вы хотите, чтобы количество реагентов соответствовало друг другу, чтобы реакция полностью потребляла каждый реагент. В противном случае оставшиеся реагенты загрязняют продукты реакции. Вы также разбавляете кислоты, когда работаете с их концентрированными запасами. Например, если вы купили азотную кислоту у поставщика химикатов, она обычно находится в высококонцентрированной форме.Чтобы использовать его, вы берете небольшое количество из контейнера продавца и смешиваете образец с водой для собственных экспериментов.
A Split Second
Когда вы добавляете воду в сильную кислоту, за крошечные доли секунды после того, как первая капля воды касается кислоты, образуется небольшой «бассейн» концентрированных ионов H +. Эта реакция является сильно экзотермической (выделяющей тепло), и раствор в этот момент является опасно едким. При внезапном повышении температуры кислотные пары почти мгновенно вскипают, вскипают и разбрызгиваются, создавая опасную ситуацию для всех, кто находится поблизости.
Напротив, добавление кислоты к воде создает небольшой резервуар разбавленной кислоты в момент контакта. Реакция все еще экзотермична, но выделяет мало тепла. Вероятность образования пузырей и брызг значительно снижается, а образующаяся разбавленная кислота менее опасна, чем в предыдущей ситуации.
Как разбавить кислоты
Перед тем, как выполнять собственно разбавление, рассчитайте количество воды и кислоты, необходимое для желаемой концентрации. Например, чтобы приготовить 100 мл.01 молярная (M) соляная кислота, используйте 10 мл 0,1 молярной кислоты и 90 мл воды. Получите правильное количество деионизированной (ДИ) воды в один стакан и кислоты в другом. Медленно вылейте всю кислоту в воду. Подождите минуту или две, чтобы кислота перемешалась, прежде чем использовать ее, или осторожно перемешайте чистой стеклянной палочкой, затем промойте ее деионизированной водой.
Как разбавить основания
Аналогичная ситуация существует для разбавления сильных оснований, таких как гидроксид калия. Реакция является сильно экзотермической и создает такую же опасность образования пузырьков и брызг, как и в случае с кислотой.Отличие состоит в том, что когда вы добавляете воду в основу, в точке, где основание контактирует с водой, образуется сильная концентрация гидроксид-ионов (ОН-). Безопасная практика — добавлять основу в воду.
Прочие меры безопасности
При работе с сильными кислотами и щелочами всегда используйте соответствующие средства индивидуальной защиты (СИЗ), такие как защитные очки и одноразовые перчатки. Также необходимы обувь с закрытым носком и брюки, закрывающие щиколотки. Всегда работайте с чистой посудой. Для концентрированных кислот и щелочей требования безопасности ужесточаются.Работайте с ними только в вытяжном шкафу. При необходимости вам также могут потребоваться другие СИЗ, такие как фартук, неопреновые перчатки до локтя или маска для лица.
7.6: Разведение концентрированных растворов
В лаборатории химик часто готовит растворы известной концентрации, начиная со стандартного исходного раствора. Основной раствор обычно концентрируется, и, конечно, должна быть известна молярная концентрация растворенного вещества. Для проведения реакции отмеренное количество этого исходного раствора будет извлечено и добавлено к другому реагенту или будет разбавлено до большего объема для другого использования.Вычисления, связанные с этими разбавлениями, тривиальны и включают в себя просто вычисление количества перенесенных молей и деление его на конечный объем. Например, 15,0 мл исходного раствора 1,00 М соляной кислоты (HCl) отбирают и разбавляют в 75 мл дистиллированной воды; какова конечная концентрация соляной кислоты?
Сначала количество молей HCl рассчитывается из добавленного объема и концентрации основного раствора:
\ [0,0150L \ times \ left (\ frac {1.00 \: моль} {1 \: L} \ right) = 0,0150 \; родинки \; HCl \]
Мы разбавили это количество молей до (15,0 + 75,0) = 90,0 мл, поэтому конечная концентрация HCl определяется как:
\ [\ left (\ frac {0,0150 \; моль \; HCl} {0,0900 \: L} \ right) = (0,167 \; моль \; HCl / л) \; или же\; 0,167 \; M \]
Еще более простой способ решить эти проблемы — умножить начальную концентрацию основного раствора на соотношение аликвоты (количество, извлеченное из основного раствора) к конечному объему, используя уравнение ниже:
\ [(запас \; концентрация) \ times \ left (\ frac {volume \; of \; the \; aliquot} {final \; volume} \ right) = final \; концентрация \]
Используя этот метод для предыдущей задачи,
\ [(1.00 \; M) \ times \ left (\ frac {15.0 \; ml} {90.0 \; ml} \ right) = 0,167 \; M \]
Обратите внимание, что нам не нужно было преобразовывать наши объемы (15,0 и 90,0 мл) в л, когда мы используем этот подход, потому что единицы объема сокращаются в уравнении. Если единицы, указанные для аликвоты и конечного объема, отличаются, может потребоваться метрический коэффициент преобразования. Например, 10,0 мкл 1,76 М раствора HNO 3 (азотная кислота) разводят в 10,0 мл дистиллированной воды; какова конечная концентрация азотной кислоты?
В этой задаче нам нужно перевести мкл и мл в общую единицу.{-3} М \]
Окончательный объем в этой задаче на самом деле (1,00 × 10 -2 л) + (1,00 × 10 -5 л) = 1,001 × 10 -2 л, но поскольку наш расчет точен только до трех значимых На фигурах объем аликвоты не имеет значения, а окончательный объем был округлен.
Стандартный метод, который мы здесь использовали, также может быть адаптирован к типу задачи, в которой вам нужно найти объем основного раствора, который необходимо разбавить до определенного объема, чтобы получить раствор с заданной концентрацией.Например, какой объем 0,029 М CaCl 2 необходимо разбавить точно до 0,500 л, чтобы получить раствор с концентрацией 50,0 мкМ?
Чтобы решить эту проблему в простейшем виде, мы должны еще раз изучить приведенное выше уравнение:
\ [(запас \; концентрация) \ times \ left (\ frac {volume \; of \; the \; aliquot} {final \; volume} \ right) = final \; концентрация \]
Это уравнение можно переписать как:
\ [\ left (\ frac {объем \; из \; \; аликвота} {конечный \; объем} \ right) = \ left (\ frac {final \; концентрация} {запас \; концентрация} \ right) \]
или
\ [\ left (\ frac {V} {V_ {f}} \ right) = \ left (\ frac {C_ {f}} {C_ {i}} \ right) \]
, где C i и C f — исходные концентрации и конечные концентрации соответственно, V — объем аликвоты и V f — конечный объем решение.Другими словами, это просто набор соотношений; аликвота от до конечный объем и конечная концентрация от до начальная концентрация (на практике эти отношения всегда будут « малое значение / большее значение »). Работая с этим набором соотношений, мы можем напрямую решить этот тип задачи следующим образом:
Во-первых, нам нужно преобразовать нашу конечную концентрацию (50,0 мкМ) в M, чтобы соответствовать единицам нашего исходного раствора. Метрический множитель для µ составляет 10 -6 , что делает нашу конечную концентрацию 50.{3} mL} {1L} \ right) \]
требуемый объем составляет 0,86 мл (в концентрации основного раствора всего две значащие цифры, 0,029 М).
Задачи разбавления могут быть решены непосредственно с помощью приведенного выше уравнения или, когда вы освоитесь с математикой, используя начальное и конечное соотношения, как мы делали в этой задаче (помните, что числа в двух соотношениях на дюймов меньше / больше ”).
Упражнение \ (\ PageIndex {1} \)
- А 1.Аликвоту 50 мл 0,177 М раствора серной кислоты (H 2 SO 4 ) разбавляют 10,0 мл дистиллированной воды с получением раствора A . Аликвоту 10,0 мл A затем разбавляют 50,0 мл дистиллированной воды с получением раствора B . Наконец, 10,0 мл B разбавляют 900,0 мл дистиллированной воды с получением раствора C . Затем к C добавляют дополнительную дистиллированную воду, чтобы получить конечный объем 1,0000 л. Какова конечная концентрация серной кислоты в растворе C ?
- Раствор был приготовлен путем смешивания 250 мл 0.547 M NaOH с 50,0 мл 1,62 M NaOH с последующим разбавлением до конечного объема 1,50 л. Какова молярность Na + в этом растворе? До какого конечного объема следует разбавить 75,00 мл 0,889 М HCl (водн.), Чтобы получить 0,800 М HCl (водн.)?
Добавить кислоту в воду или воду в кислоту? Безопасное разбавление кислот
Всегда добавляйте кислоту в воду, а не воду в кислоту. В противном случае кислота может разбрызгиваться и разбрызгиваться.
Когда вы смешиваете сильные кислоты и воду, имеет значение, добавляете ли вы кислоту в воду или воду в кислоту. Всегда добавляйте кислоту в воду, а не наоборот.
Если вы добавите немного воды к большому количеству концентрированной кислоты, полученный раствор все равно будет концентрированным. В реакции гидратации используется вся вода (кислота является ограничивающим реагентом), выделяя много тепла. Раствор бурно закипает, выплевывая из емкости концентрированную кислоту. Если вы добавите немного концентрированной кислоты в большое количество воды, вода будет ограничивающим реагентом, и полученный раствор будет более разбавленным. Здесь реагирует вся кислота, но есть дополнительная вода, которая поглощает тепло, уменьшая вероятность закипания.
Зачем добавлять кислоту в воду
Есть несколько факторов, по которым лучше добавлять кислоту в воду. Разбавление кислоты водой является экзотермическим процессом, поэтому воду, добавленную в кислоту, легче кипятить и разбрызгивать, чем кислоту, добавленную в воду, потому что вода обладает высокой теплоемкостью и может поглощать много тепла. Кроме того, некоторые сильные кислоты имеют более высокий удельный вес или плотность, чем вода. Итак, если вы положите воду на кислоту, тепло будет выделяться на поверхности кислоты. В этой ситуации жидкость легко вскипает и брызгает.С другой стороны, если вы вылейте кислоту поверх или в воду, вода поднимется над кислотой перед смешиванием и сдержит реакцию.
Серная кислота для разбавления
Серная кислота (H 2 SO 4 ) — самая опасная из обычных кислот для разбавления. Отчасти потому, что он так бурно реагирует на кожу и одежду. Серная кислота быстро обезвоживает белки и углеводы в коже и мышцах. Кислота намного тяжелее воды, поэтому добавленная к ней вода сначала вступает в реакцию с верхним слоем.Вырабатывается много тепла даже при правильном смешивании серной кислоты и воды. При смешивании 100 мл концентрированной серной кислоты и 100 мл воды при 19 ° C температура достигает более 131 ° C (намного выше точки кипения воды) менее чем за минуту.
Это реакция гидратации, которая генерирует все это тепло:
H 2 SO 4 + H 2 O → H 3 O + + HSO 4 —
Аналогично, серная кислота легко отделяет воду от органических молекул, обезвоживая их.
Советы по безопасности при разбавлении
Как правило, чем выше концентрация кислоты, тем больше увеличивается нагрев и тем выше вероятность кипения и разбрызгивания. Будьте предельно осторожны при разбавлении любой концентрированной сильной кислоты. Всегда надевайте соответствующее защитное снаряжение и работайте под вытяжным шкафом.
Независимо от того, какую кислоту вы разбавляете, помните, что скорость реакции удваивается на каждые 10 градусов Цельсия повышения температуры. Таким образом, если вы производите серийное разбавление кислоты, изменение кипения или разбрызгивания кислоты увеличивается, потому что основной раствор уже горячий.Есть несколько способов избежать этого. Один из них — охладить исходный раствор перед его разбавлением. Вы можете поставить емкость в ледяную баню перед разбавлением. Другой метод — вылить горячий раствор кислоты на лед, сделанный из деионизированной воды, а затем разбавить его водой комнатной температуры для достижения конечного объема.
Наконец, разумно выбирайте посуду. Колба Эрленмейера или мерная колба — лучший выбор, чем химический стакан или градуированный цилиндр, потому что форма колбы действует как своего рода защита от брызг (кроме того, градуированные цилиндры очень нестабильны и легко опрокидываются).
Советы, которые следует помнить о добавлении кислоты в воду
Вот несколько простых мнемонических приемов, которые помогут вам не забыть добавить кислоту в воду:
- AA: Добавьте кислоту
- Кислоту в воду, например A&W Root Beer
- Капля кислоты, не вода
- Если вы думаете, что ваша жизнь слишком спокойна, добавьте воду к кислоте
- Сначала воду, затем кислоту, иначе она не будет спокойной
Разбавление сильных оснований
Как сильные кислоты, сильные основания реагируют с водой в экзотермической реакции.Кроме того, как и сильные кислоты, сильные основания имеют тенденцию вызывать коррозию и могут вызывать химические и термические ожоги кожи. Лучше всего добавлять основание в воду, как если бы вы добавляли кислоту.
Ссылки
- Епископ, Майкл Л .; Фоди, Эдвард П .; Шофф, Ларри Э. (2004). Клиническая химия: принципы, процедуры, взаимосвязи . Липпинкотт Уильямс и Уилкинс. ISBN 0-7817-4611-6.
- Cleapss.org. (2007). Паспорта безопасности студентов — серная (VI) кислота.
- Полинг, Л.С. (1988) Общая химия . Dover Publications.
pH сильной кислоты после разбавления Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Влияние на pH разбавления водного раствора сильной кислоты
Представьте, что у вас есть бутылка, содержащая 100 мл 0,100 моль л -1 HCl (водн.) при 25 ° C и давлении 1 атмосфера.
Это наш основной раствор, и его pH равен 1.00
Что произойдет с pH этого раствора, если вы добавите больше воды, то есть если вы разбавите раствор?
Сначала давайте вычислим количество молей HCl (водн.) в нашем исходном растворе, используя соотношение:
n (HCl (водн.) ) = c (HCl (водн.) ) × V (HCl (водн.) )
n (HCl (водн.) ) = моль HCl (водн.)
c (HCl (водн.) ) = концентрация HCl (водн.) в моль. Л -1 = 0.100 моль л -1
V (HCl (водн.) ) = объем раствора в л = 100 мл = 100/1000 л = 0,100 л
n (HCl (водн.) ) = c (HCl (водн.) ) × V (HCl (водн.) )
n (HCl (водн.) ) = 0,100 моль л -1 × 0,100 л
n (HCl (водн.) ) = 0,0100 моль
HCl (водн.) — сильная кислота, поэтому она полностью диссоциирует.
Этот водный раствор не содержит молекул HCl, он содержит только ионы H + (водн.) и Cl — (водн.) , как показано в сбалансированном химическом уравнении для кислотной диссоциации, приведенном ниже:
HCl (водн.) → H + (водн.) + Cl — (водн.)
Используя стехиометрическое соотношение (мольное соотношение) HCl (водн.) к H + (водн.) (1: 1), мы можем вычислить моль H + (водн.) в растворе, n (H + (водн.) ), как показано ниже:
n (H + (водн.) ) = n (HCl (водн.) ) = 0.0100 моль
Это говорит нам о 0,0100 моль H + (водн.) в нашем 100 мл 0,100 моль-л раствора -1 HCl (водн.) с pH = 1,00.
А теперь представьте, что мы наливаем все 100 мл этого раствора в мерную колбу на 1,00 л и заполняем ее до отметки дистиллированной водой, то есть разбавляем исходный маточный раствор HCl (водн.) .
Что произойдет с pH раствора после разбавления?
Присутствует такое же количество H + (водн.) , но объем увеличился в 10 раз.
Прогноз: концентрация H + (водн.) уменьшится в 10 раз, то есть мы прогнозируем, что концентрация разбавленного раствора составит 1 / 10 × 0,100 моль л -1 = 0,0100 моль л -1 .
И, поскольку концентрация H + (водн.) уменьшилась, мы ожидаем увеличения pH кислотного раствора.
Прогноз: поскольку pH имеет логарифмическую шкалу, уменьшение концентрации H + (aq) в 10 раз приведет к увеличению pH на 1 единицу, то есть к новому pH = 1.00 + 1 = 2,00
Давайте проведем расчеты и посмотрим, верны ли наши прогнозы …
Мы можем рассчитать конечную концентрацию нашего разбавленного раствора, используя соотношение:
с = н ÷ В
c = концентрация H + (водн.) В растворе после разбавления
n = моль H + (водн.) в растворе после разбавления = моль H + (водн.) в исходном растворе = 0.0100 моль
V = объем раствора после разбавления = 1 л
Подставляя эти значения в уравнение, чтобы найти концентрацию H + :
| концентрация (моль л -1 ) | = | моль растворенного вещества (моль) объем раствора (л) |
| c | = | n V |
| c (H + (водн.) ) | = | 0.0100 (моль) 1 (л) |
| = | 0,0100 моль л -1 |
Мы правильно предсказали концентрацию конечного раствора 0,0100 моль л -1
Теперь мы можем рассчитать pH конечного разбавленного раствора, используя эту концентрацию H + (водн.) :
pH = -log 10 [H + (водн.) ] = -log 10 [0.0100] = 2,00
Итак, мы также правильно предсказали pH раствора соляной кислоты после разбавления!
Теперь представьте, что вы разбавляете наш основной раствор настолько, что концентрация H + (вод.) становится невероятно малой, скажем, c (H + (вод.) ) = 10 -10 моль л. -1 .
Каким будет pH этого нового раствора?
Если мы попытаемся вычислить pH, используя c (H + (aq) ) = 10 -10 , мы получим глупый ответ, как показано ниже:
pH = -log 10 [H + (водн.) ] = -log 10 [10 -10 ] = 10
Ответ глуп, потому что для водного раствора при 25 ° C и 1 атм pH больше 7 будет основным, и мы знаем, что наш раствор должен быть кислым, потому что мы добавили H + (водный) , когда сильная кислота полностью диссоциирована.
Так в чем проблема?
Проблема в том, что мы проигнорировали вклад, который самодиссоциация воды вносит в концентрацию H + (водн.) в наших растворах.
То есть вода также в небольшой степени диссоциирует, высвобождая H + (водн.) в раствор, как показано ниже:
H 2 O (л) ⇋ H + (водн.) + OH — (водн.)
Но степень этой диссоциации очень мала (K w = 10 -14 при 25 ° и 1 атм).
Самодиссоциация воды способствует только 10 -7 моль H + на литр воды ([H + (водн.) ] = 10 -7 моль л -1 )!
Когда концентрация H + (водн.) в результате диссоциации сильной кислоты намного превышает 10 -7 моль л -1 , мы можем игнорировать вклад воды:
H + (водн.) >> 10 -7 моль л -1 игнорировать H + (водн.) вносится диссоциацией воды
Однако, когда концентрация H + (водн.) из-за диссоциации сильной кислоты очень мала, мы больше не можем игнорировать H + (водн.) , вносимый самодиссоциацией воды.
Рассмотрим наш чрезвычайно разбавленный раствор, в котором разложение сильной кислоты вносит 10 -10 моль H + (водн.) на литр раствора.
Самодиссоциация воды вносит значительно больший вклад в концентрацию ионов водорода, 10 -7 моль H + (водн.) на литр раствора.
Так как [H + (из воды)] >> [H + (из кислоты)] мы игнорируем вклад кислоты !!
H + (водн.) << 10 -7 моль л -1 игнорировать H + (водн.) вносится диссоциацией кислоты
Итак, для водного раствора соляной кислоты с концентрацией 10 -10 моль л -1 концентрация H + (водн.) будет примерно 10 -7 моль л -1 и pH этого раствора будет:
pH = -log 10 [H + (вод.) ] = -log 10 [10 -7 ] = 7
По мере того как вы продолжаете разбавлять основной раствор сильной кислоты, pH полученных растворов увеличивается, пока не достигнет 7 (при 25 °, 1 атм).
При разбавлении водного раствора кислоты водой:
- концентрация H + (водн.) уменьшается
- pH раствора после разбавления больше pH раствора до разбавления
- pH раствора после разбавления ближе к 7 (при 25 ° C, 1 атм), чем до разбавления
Как рассчитать объем воды, который нужно добавить в водный раствор сильной кислоты для достижения заданного значения pH
В приведенном выше примере мы начали со 100 мл исходного раствора HCl (водн.) с [H + (водн.) ] = 0.100 моль л -1 и pH = 1,00 (25 ° C, 1 атм).
Мы добавили воду в этот основной раствор, разбавили его до 1,00 л и обнаружили, что pH увеличился до 2,00.
Можно ли разбавить основной раствор водой, чтобы полученный раствор имел pH = 3,00?
а) Каким будет объем разбавленного раствора?
(б) Сколько воды нам нужно добавить к нашему основному раствору, чтобы достичь этого объема?
Для основного раствора до разбавления:
c i = концентрация H + (вод.) в исходном растворе = [H + (вод.) (исходный) )] = 0.100 моль л -1
V i = объем основного раствора = V (основной) = 100 мл = 100/1000 = 0,100 л
Для окончательного раствора или полученного раствора после разбавления основного раствора:
c f = H + (водн.) концентрация после разбавления = 10 -pH = 10 -3,00 = 0,001 моль л -1
V f = конечный объем раствора =? L
Мы можем использовать формулу разбавления для расчета V f :
Разделите обе части уравнения на c f :
| c i × V i c f | = | |
| c i × V i c f | = | V f |
Заменить известные значения для определения V f , объем раствора после разбавления:
| c i × V i c f | = | V f |
| 0.100 × 0,100 0,001 | = | V f |
| 10,00 л | = | V f |
Если мы нальем все 100 мл 0,100 моль-л исходного раствора -1 в мерную колбу на 10,00 л и заполним до отметки дистиллированной водой, мы получим раствор с pH = 3,00.
Итак, сколько воды было добавлено в основной раствор?
Если предположить аддитивность объемов, то,
конечный объем раствора = начальный объем раствора + объем добавленной воды
конечный объем = 10.00 L = 10,00 L × 1000 мл / L = 10 000 мл
начальный объем = 100 мл
объем добавленной воды =? мл
Подставляя эти значения в выражение выше:
конечный объем = начальный объем + объем добавленной воды
10000 мл = 100 мл + объем добавленной воды (мл)
Вычтем 100 мл из обеих частей уравнения:
10000 мл — 100 мл = 100 мл — 100 мл + объем добавленной воды (мл)
9900 мл = объем добавленной воды (мл)
Нам нужно добавить 9900 мл воды к 100 мл исходного раствора, чтобы получить раствор с pH = 3.00
pH после разбавления слабокислотного учебного пособия по химии
Пожалуйста, не блокируйте рекламу на этом веб-сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Сравнение концентрированных и разбавленных растворов слабой кислоты
Уксусная кислота (этановая кислота), CH 3 COOH, является слабой кислотой, она только частично диссоциирует в воде, поэтому недиссоциированные (неионизированные) молекулы уксусной кислоты находятся в равновесии с ионами водорода (протонами или гидронами), H + (водн.) и ацетат-ионы (этаноат-ионы), CH 3 COO — (водн.) , как показано химическим уравнением, приведенным ниже:
| Диссоциация уксусной кислоты (ионизация этановой кислоты) | |||||
|---|---|---|---|---|---|
| Словесное уравнение: | уксусная кислота (этановая кислота) | ⇋ | ионы водорода (протоны или гидроны) | + | ацетат-ионы (этаноат-ионы) |
| Сбалансированное химическое уравнение: | CH 3 COOH | ⇋ | H + (водн.) | + | CH 3 COO — (водн.) |
Представьте, что у вас есть два флакона с реагентом, флакон A и флакон B, содержащие разные концентрации уксусной кислоты, CH 3 COOH (водн.) , оба при 25 ° C и 1 атм.
Бутылка A содержит 0,100 моль л -1 CH 3 COOH (водн.) с pH 2,87
Флакон B содержит 0,010 моль л -1 CH 3 COOH (водн.) с pH 3,37
Давайте сравним эти две бутылки с уксусной кислотой.
Бутылка A содержит более концентрированный раствор уксусной кислоты, чем бутылка B.
| Бутылка A | Бутылка A | ||
|---|---|---|---|
| [CH 3 COOH (водн.) ] (моль л -1 ) | 0.100 моль | > | 0,010 |
| относительная концентрация | более концентрированный | больше разбавленного |
Обратите внимание, что pH более концентрированного раствора уксусной кислоты во флаконе A ниже.
| Бутылка A | Бутылка A | ||
|---|---|---|---|
| [CH 3 COOH (водн.) ] (моль л -1 ) | 0.100 | > | 0,010 |
| относительная концентрация | более концентрированный | больше разбавленного | |
| pH | 2,87 | < | 3,37 |
| относительный pH | нижний | выше |
Это говорит нам о том, что концентрация ионов водорода, [H + (вод.) ], в бутылке A должна быть больше, чем в бутылке B:
| Бутылка A | Бутылка A | ||
|---|---|---|---|
| [CH 3 COOH (водн.) ] (моль л -1 ) | 0.100 | > | 0,010 |
| относительная концентрация | более концентрированный | больше разбавленного | |
| pH | 2,87 | < | 3,37 |
| относительный pH | нижний | выше | |
| [H + (водн.) ] = 10 -pH (моль л -1 ) | 1.35 × 10 -3 | > | 4,27 × 10 -4 |
| родственник [H + (водн.) ] | выше | нижний |
Мы также можем рассчитать% диссоциации (% ионизации) для раствора уксусной кислоты в каждой бутылке и сравнить результаты:
| Бутылка A | Бутылка A | ||
|---|---|---|---|
| [CH 3 COOH (водн.) ] (моль л -1 ) | 0.100 | > | 0,010 |
| относительная концентрация | более концентрированный | больше разбавленного | |
| pH | 2,87 | < | 3,37 |
| относительный pH | нижний | выше | |
| [H + (водн.) ] = 10 -pH (моль л -1 ) | 1.35 × 10 -3 | > | 4,27 × 10 -4 |
| родственник [H + (водн.) ] | выше | нижний | |
| % диссоциации = ([H + (водн.) ] / [CH 3 COOH (водн.) ]) × 100 | 1,35% | < | 4.27% |
| % диссоциации | меньше | больше |
, и мы обнаруживаем, что% диссоциации уксусной кислоты в более разбавленном растворе (Бутылка B) больше, чем в более концентрированном растворе (Бутылка A).
Этот повышенный% диссокации слабой кислоты при разбавлении прогнозируется с использованием принципа Ле Шателье.
Перед разбавлением молекулы недиссоциированной уксусной кислоты в растворе находились в равновесии с ионами водорода и ацетат-ионами, как показано ниже:
| растворенное вещество | + | растворитель | ⇋ | раствор | ||
|---|---|---|---|---|---|---|
| уксусная кислота | + | вода | ⇋ | ионов водорода | + | ацетат-ионы |
| CH 3 COOH (водн.) | + | H 2 O (л) | ⇋ | H 3 O + (водн.) | + | CH 3 COO — (водн.) |
Когда мы разбавляем раствор, добавляя больше воды, мы нарушаем (или нарушаем) это равновесие.
Положение равновесия смещается вправо, потребляя больше молекул CH 3 COOH (водн.) , чтобы произвести больше H 3 O + (водн.) (или H + (водн.) ) и др. CH 3 COO — (водн.) .
Следовательно, количество молекул CH 3 COOH (водн.) уменьшается, а количество ионов H 3 O + (водн.) (или H + (водн.) ) увеличивается.
Таким образом,% диссоциации (% ионизации) кислоты увеличивается после разбавления.
Но помните, хотя количество ионов водорода и увеличилось, объем раствора после разбавления увеличился еще больше.
Небольшое увеличение молей H + (водн.) , большее увеличение объема раствора.
Итак, концентрация иона водорода в растворе, моль ионов водорода на литр раствора, уменьшилась после разбавления.
Когда мы разбавляем водный раствор слабой кислоты при 25 ° C и 1 атм, важно помнить, что ПОСЛЕ разбавления полученный раствор имеет:
- с пониженной концентрацией кислоты
- более низкая концентрация ионов водорода
- более высокий pH
- больший% диссоциации (% ионизации)
Теперь мы готовы выполнить расчеты для определения pH водного раствора слабой кислоты после его разбавления добавлением воды.
Расчет pH водного раствора слабой кислоты после разбавления
В нашем примере выше бутылка A содержала более концентрированный раствор уксусной кислоты, чем бутылка B.
Бутылка A: 0,100 моль л. -1 раствор уксусной кислоты, CH 3 COOH (водн.) , с pH 2,87 (25 ° C, 1 атм).
Флакон A: 0,010 моль л -1 раствор уксусной кислоты, CH 3 COOH (водн.) , с pH 3.37 (25 ° C, 1 атм).
Если мы хотим приготовить более разбавленный раствор уксусной кислоты во флаконе B, у нас есть несколько вариантов. Например, мы могли бы:
- растворить 0,010 моль уксусной кислоты в достаточном количестве воды, чтобы получить 1 л водного раствора, [CH 3 COOH (водн.) ] = 0,010 моль л -1
- Разбавьте 10 мл 0,100 моль л раствора -1 во флаконе A водой, достаточным для получения 100.0 мл раствора (разведение 1 из 10 или разведение в 10 раз), [CH 3 COOH (водн.) ] = 0,010 моль л -1
Хотя каждый раствор 0,010 моль л -1 CH 3 COOH (водн.) будет приготовлен по-разному, оба они будут иметь:
- то же [CH 3 COOH (водн.) ]
- то же [CH 3 COO — (водн.) ]
- то же [H + (водн.) ]
- то же K a (константа кислотной диссоциации)
- то же% диссоциации (% ионизации)
- то же pH
Однако, когда количество растворенного вещества, которое нам нужно растворить, становится слишком маленьким для точного измерения или объем раствора становится слишком большим, чтобы его можно было точно измерить, мы предпочитаем приготовить более концентрированный раствор, а затем разбавить его до желаемая концентрация.
Итак, давайте посчитаем pH раствора уксусной кислоты после разбавления.
Сначала мы набираем пипеткой 10,00 мл раствора уксусной кислоты объемом 0,100 моль л -1 в мерную колбу на 100,00 мл, затем добавляем достаточно дистиллированной воды, чтобы довести раствор до отметки.
Нам нужно будет найти концентрацию уксусной кислоты в полученном растворе (раствор после разбавления).
Мы можем использовать «формулу разбавления», чтобы вычислить это:
c 1 V 1 = c 2 V 2
c 1 = [CH 3 COOH (водн.) (перенесено) ] = 0.100 моль л -1
V 1 = V (перенесенный) = 10,00 мл = 10,00 мл ÷ 1000 мл / л = 0,0100 л
c 2 = [CH 3 COOH (водн.) (результат) ] =? моль л -1
V 2 = V (результат) = 100,00 мл = 100,00 мл ÷ 1000 мл / л = 0,100 л
Подставьте известные значения в уравнение:
c 1 V 1 = c 2 V 2
0.100 × 0,0100 = с 2 × 0,100
0,00100 = с 2 × 0,100
Разделите обе части уравнения на 0,100
0,00100 ÷ 0,100 = (с 2 × 0,100 ) ÷ 0,100
0,0100 моль л -1 = c 2
Концентрация уксусной кислоты в полученном растворе (раствор после разбавления) составляет 0,0100 моль л -1
Но какова концентрация ионов водорода c (H + (aq) ) в полученном растворе?
Уксусная кислота — слабая кислота, она только частично диссоциирует, как показано химическим уравнением ниже:
CH 3 COOH (водн.) ⇋ H + (водн.) + CH 3 COO — (водн.)
, поэтому концентрация H + (водн.) в растворе будет меньше, чем концентрация молекулярной уксусной кислоты, CH 3 COOH (водн.) .
Но насколько меньше?
Мы должны начать с записи выражения закона равновесия для этой диссоциации, уравнения для константы кислотной диссоциации (K a ):
| К а | = | [H + (водн.) ] [CH 3 COO — (водн.) ] [CH 3 COOH (водн.) ] |
Если вы посмотрите таблицу констант диссоциации кислоты (значения K a ), вы найдете K a = 1.8 × 10 -5 для диссоциации уксусной кислоты при 25 ° C.
| К а | = | [H + (водн.) ] [CH 3 COO — (водн.) ] [CH 3 COOH (водн.) ] | = | 1,8 × 10 -5 |
Пусть x представляет количество CH 3 COOH (водн.) , которое диссоциирует.
Итак, после диссоциации [CH 3 COOH (водн.) ] = 0,0100 — x
Поскольку стехиометрическое соотношение (мольное соотношение) CH 3 COOH к H + и CH 3 COO — составляет 1: 1: 1 (из сбалансированного химического уравнения диссоциации), мы можем сказать, что [H + (водн.) ] = [CH 3 COO — (водн.) ] = x
Теперь мы можем подставить эти значения в уравнение для K a :
| [H + (вод.) ] [CH 3 COO – (водн.) ] [CH 3 COOH (вод.) ] | = | 1.8 × 10 -5 |
| [ x ] [ x ] [0,0100 — x ] | = | 1,8 × 10 -5 |
| [ x ] 2 [0,0100 — x ] | = | 1,8 × 10 -5 |
| [ x ] 2 | = | 1.8 × 10 -5 [0,0100 — x ] |
| [ x ] 2 | = | 1,8 × 10 -7 — 1,8 × 10 -5 x |
| [ x ] 2 + 1,8 × 10 -5 x — 1,8 × 10 -7 | = | 0 |
К сожалению, нам пришлось бы решить это квадратное уравнение, если бы мы хотели определить значение x .
Однако, поскольку значение K a мало, мы знаем, что диссоциирует небольшая часть молекулярной уксусной кислоты, поэтому x должно быть мало по сравнению с концентрацией уксусной кислоты, и в этом случае:
0,0100 — x & прибл; 0,0100
, поэтому мы можем использовать это приближение в приведенном выше уравнении:
| [H + (вод.) ] [CH 3 COO – (водн.) ] [CH 3 COOH (вод.) ] | = | 1.8 × 10 -5 |
| [ x ] [ x ] [0,0100 — x ] | = | 1,8 × 10 -5 |
| [ x ] 2 [0,0100 — x ] | = | 1,8 × 10 -5 |
| предположим 0,0100 — x & ок. 0.0100 | ||
| [ x ] 2 [0,0100] | и прибл. | 1,8 × 10 -5 |
Умножьте обе части уравнения на 0,0100
| [ | и прибл. | 0.0100 × 1,8 × 10 -5 |
| [ x ] 2 | и прибл. | 1,8 × 10 -7 |
Извлеките квадратный корень из обеих частей уравнения, чтобы найти значение x :
.
| √ [ x ] 2 | и прибл. | √ (1.8 × 10 -7 ) |
| x | и прибл. | 4,24 × 10 -4 |
Поскольку [H + (водн.) (результирующее решение) ] = x
теперь мы знаем концентрацию ионов водорода в полученном растворе:
[H + (водн.) (полученный раствор) ] = x = 4.24 × 10 -4 моль л -1
И как только мы узнаем концентрацию ионов водорода в растворе, мы можем рассчитать pH раствора:
pH = -log 10 [H + (водный) (полученный раствор) ] = -log 10 [4,24 × 10 -4 ] = 3,37
Небольшое предостережение, прежде чем мы продолжим.
Если раствор уксусной кислоты становится очень разбавленным и концентрация уксусной кислоты становится очень маленькой, скажем, 10 -12 моль л -1 , вы получите глупые результаты, используя этот метод расчета!
Позвольте показать вам…
| [ x ] 2 10 -12 | и прибл. | 1,8 × 10 -5 |
| [ x ] 2 | и прибл. | 10 -12 × 1,8 × 10 -5 |
| [ x ] 2 | и прибл. | 1.8 × 10 -17 |
| x | и прибл. | 4,24 × 10 -9 |
| pH | и прибл. | — журнал 10 [4,24 × 10 -9 ] |
| pH | и прибл. | 8,37 |
Очевидно, что в полученном растворе не может быть избытка OH — , который обеспечил бы pH> 7 (при 25 ° C), поэтому некоторые из сделанных нами предположений, должно быть, не оправдались.
Например, мы предположили, что диссоциировала очень небольшая часть CH 3 COOH ( x ничтожно мала по сравнению с концентрацией уксусной кислоты).
Но по мере того, как раствор становится все более разбавленным,% диссокации увеличивается.
В какой-то момент мы не сможем игнорировать диссоциацию CH 3 COOH, и значение x (определенное путем решения квадратичного уравнения) приблизится к концентрации кислоты (приближается к 100% диссоциации)
Когда [CH 3 COOH (водн.) ] = 10 -6 моль л -1 , решение квадратного уравнения дает [H + (водн.) ] = 9.5 × 10 -7 моль л -1 (диссоциация около 95%) и pH = 6, но если предположить, что x можно игнорировать при вычислении [CH 3 COOH (водн.) ], то [H + ] = 4,4 × 10 -6 и pH = 5,4.
Когда [CH 3 COOH (водн.) ] = 10 -7 моль л -1 , решение квадратного уравнения дает [H + (водн.) ] = 9,95 × 10 -8 моль л -1 (около 99.5% диссоциации) и pH = 7, но если предположить, что x можно игнорировать при вычислении [CH 3 COOH (вод.) ], то [H + ] = 1,34 × 10 -6 и pH = 5,9
Но что произойдет, если мы продолжим разбавлять уксусную кислоту после этого момента? Каким будет pH 10 -12 моль л -1 уксусной кислоты?
Когда [CH 3 COOH (водн.) ] = 10 -12 моль л -1 , мы замечаем, что концентрация уксусной кислоты на самом деле намного, намного меньше, чем концентрация ионов водорода в нейтральной воде!
| [CH 3 COOH (водн.) ] | << | [H + (вод.) (вода) ] |
| 10 -12 моль л -1 | << | 10 -7 моль л -1 |
Даже если все молекулы уксусной кислоты диссоциируют (100% диссоциация), максимальная концентрация ионов водорода в результате будет 10 -12 моль л -1 , что намного, намного меньше, чем вклад самодиссоциация воды до концентрации ионов водорода в растворе.