Таблица температура кипения воды в зависимости от давления: Зависимость температуры кипения воды от давления:
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Вода, лед и снег (хладагент R718) / / Зависимость температуры кипения воды от давления. 7- 310°C, 0,01-100 кгс/см2 100- 374°C / 212- 706°F, 1-222 кгс/см2 = 14-3226 psia. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Свойства рабочих сред / / Вода, лед и снег / / Зависимость температуры кипения воды от давления. 7- 310°C, 0,01-100 кгс/см2
| |||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | |||||||||||||||
TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | ||||||||||||||
Температура кипения воды в зависимости от давления (Таблица)
Справочные таблицы содержат значения температуры кипения воды при различном давлении (в разных единицах измерения).
Обозначения: P — давление, мбар, бар, мм рт. ст. или ат; t — температура, °С.
Температура кипения воды при давлении в мбар
|
P
|
t, °C
|
P
|
t, °C
|
P
|
t, °C
|
|
900
|
96,7
|
960
|
98,5
|
1020
|
100,2
|
|
910
|
97,0
|
970
|
98,8
|
1030
|
100,5
|
|
920
|
97,3
|
980
|
99,1
|
1040
|
100,7
|
|
930
|
97,6
|
990
|
99,4
|
1050
|
101,0
|
|
940
|
97,9
|
1000
|
99,6
|
1060
|
101,3
|
|
950
|
98,2
|
1010
|
99,9
|
1070
|
101,6
|
Температура кипения воды при давлении в бар
|
P
|
t, °C
|
P
|
t, °C
|
P
|
t, °C
|
|
1
|
99,7
|
15
|
198,2
|
65
|
283
|
|
2
|
120,3
|
16
|
201,3
|
70
|
288
|
|
3
|
133,4
|
17
|
204,2
|
75
|
293
|
|
4
|
143,5
|
18
|
207,0
|
80
|
297
|
|
5
|
151,7
|
19
|
210,2
|
85
|
301
|
|
6
|
158,7
|
20
|
212,3
|
90
|
305
|
|
7
|
164,8
|
25
|
224
|
95
|
309
|
|
8
|
170,3
|
30
|
236
|
100
|
313
|
|
9
|
175,2
|
35
|
244
|
110
|
320
|
|
10
|
179,7
|
40
|
252
|
120
|
327
|
|
11
|
183,8
|
45
|
259
|
130
|
333
|
|
12
|
187,8
|
50
|
266
|
140
|
339
|
|
13
|
191,5
|
55
|
272
|
150
|
344
|
|
14
|
195,0
|
60
|
277
|
160
|
350
|
Температура кипения воды при давлении в мм рт. ст.
ст.
|
P
|
t, °C
|
P
|
t, °C
|
P
|
t, °C
|
|
680
|
96,9
|
720
|
98,5
|
760
|
100,0
|
|
685
|
97,1
|
725
|
98,7
|
765
|
100,2
|
|
690
|
97,3
|
730
|
98,9
|
770
|
100,4
|
|
695
|
97,5
|
735
|
99,1
|
775
|
100,6
|
|
700
|
97,7
|
740
|
99,3
|
780
|
100,7
|
|
705
|
97,9
|
745
|
99,5
|
785
|
100,9
|
|
710
|
98,1
|
750
|
99,6
|
790
|
101,1
|
|
715
|
98,3
|
755
|
99,8
|
800
|
101,5
|
Температура кипения воды при давлении в ат
|
P
|
t, °C
|
P
|
t, °C
|
P
|
t, °C
|
P
|
t, °C
|
|
1
|
99,1
|
8
|
169,6
|
18
|
206,1
|
70
|
287
|
|
2
|
119,6
|
9
|
174,5
|
19
|
208,9
|
80
|
296
|
|
3
|
132,9
|
10
|
179,0
|
20
|
211,4
|
90
|
304
|
|
4
|
142,9
|
12
|
187,1
|
30
|
235
|
100
|
312
|
|
5
|
151,1
|
14
|
194,1
|
40
|
251
|
120
|
326
|
|
6
|
158,1
|
15
|
197,4
|
50
|
265
|
140
|
338
|
|
7
|
164,2
|
16
|
200,4
|
60
|
276
|
160
|
348
|
Зависимость температуры кипения воды от давления
Зависимость температуры кипения воды от давления представлена таблицей В. П.Вукаловича
П.Вукаловича
Таблица В.П.Вукаловича
| Р | t | i/ | i// | r |
| 0,010 | 6,7 | 6,7 | 600,2 | 593,5 |
| 0,050 | 32,6 | 32,6 | 611,5 | 578,9 |
| 0,10 | 45,5 | 45,5 | 617,0 | 571,6 |
| 0,20 | 59,7 | 59,7 | 623,1 | 563,4 |
| 0,30 | 68,7 | 68,7 | 626,8 | 558,1 |
| 0,40 | 75,4 | 75,4 | 629,5 | 554,1 |
| 0,50 | 80,9 | 80,9 | 631,6 | 550,7 |
| 0,60 | 85,5 | 85,5 | 633,5 | 548,0 |
| 0,70 | 89,5 | 89,5 | 635,1 | 545,6 |
| 0,80 | 93,0 | 93. 1 1 | 636,4 | 543,3 |
| 0,90 | 96,2 | 96,3 | 637,6 | 541,3 |
| 1,0 | 99,1 | 99,2 | 638,8 | 539,6 |
| 1,5 | 110,8 | 111,0 | 643,1 | 532,1 |
| 2,0 | 119,6 | 120,0 | 646,3 | 526,4 |
| 2,5 | 126,8 | 127,2 | 648,7 | 521,5 |
| 3,0 | 132,9 | 133,4 | 650,7 | 517,3 |
| 3,5 | 138,2 | 138,9 | 652,4 | 513,5 |
| 4,0 | 142,9 | 143,7 | 653,9 | 510,2 |
| 4,5 | 147,2 | 148,1 | 655,2 | 507,1 |
| 5,0 | 151,1 | 152,1 | 656,3 | 504,2 |
| 6,0 | 158,1 | 159,3 | 658,3 | 498,9 |
| 7,0 | 164,2 | 165,7 | 659,9 | 494,2 |
| 8,0 | 169,6 | 171,4 | 661,2 | 489,8 |
Р — абсолютное давление в ат, кгс/см2; t — температура в оС; i / — энтальпия кипящей воды, ккал/кг; i// — энтальпия сухого насыщенного пара, ккал/кг; r — скрытая теплота парообразования, ккал/кг.
Зависимость температуры кипения воды от давления прямопропорциональная, то есть чем больше давление, тем больше и температура кипения. Для лучшего понимания данной зависимости, вам предлагается ответить на следующие вопросы:
1. Что такое перегретая вода? Какая максимальная температура воды возможна в вашей котельной?
2. Чем определяется давление, при котором работает ваш водогрейный котел?
3. Приведите примеры использования зависимости температуры кипения воды от давления в вашей котельной.
4. Причины гидравлических ударов в водяных тепловых сетях. Почему слышится потрескивание в местных системах отопления частного дома и как его избежать?
5. И наконец, что такое скрытая теплота парообразования? Почему мы испытываем, при определенных условиях, в Русской бане непереносимый жар и покидаем парную. Хотя температура в парной при этом не более 60оС.
Комплект Учебно-методических материалов для Оператора котельной.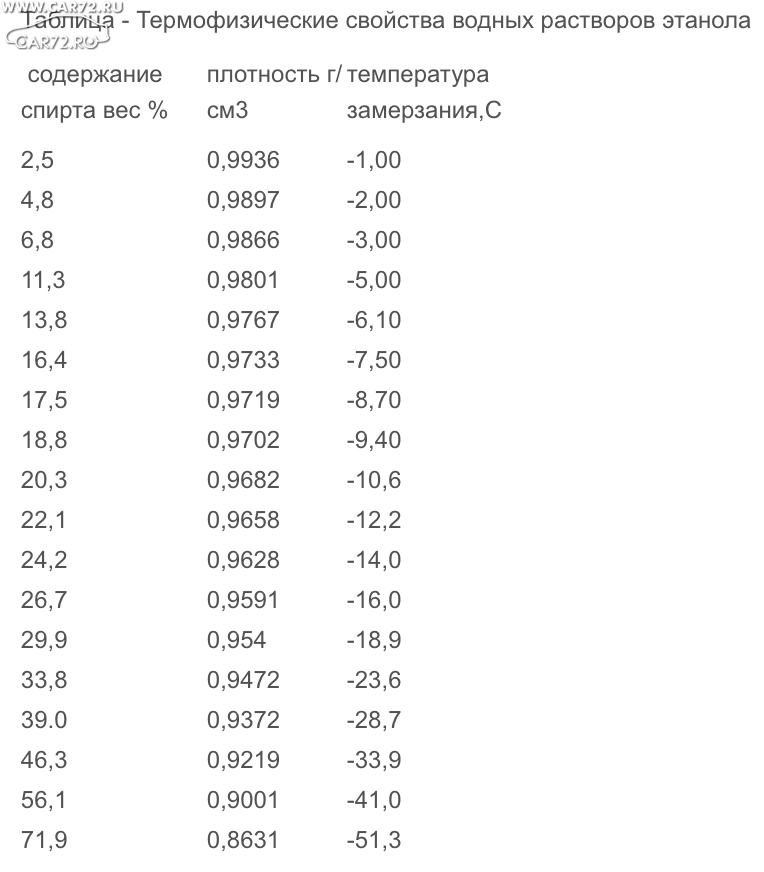 Купить Материал хорошо структурирован и опробирован в учебных заведениях по подготовке Операторов котельной. Сделайте подарок себе и знакомым. Будьте профессионалом! Купить Материал хорошо структурирован и опробирован в учебных заведениях по подготовке Операторов котельной. Сделайте подарок себе и знакомым. Будьте профессионалом! |
Температура кипения воды в зависимости от давления
Т а б л и ц а П-8 Температура кипения воды в зависимости от давления
[c.302]
Температура кипения водя в зависимости от барометрического давления [c.76]
Температура кипения, °С, воды в зависимости от барометрического давления В, мм рт. ст. [c.302]
Определим теоретически возможные пределы изменения расхода воздуха для испарительного охлаждения воды при пониженном давлении в контактном аппарате. С этой целью рассмотрим идеальный контактный аппарат, в котором охлаждение воды происходит только з-а счет ее испарения. Условно примем, что воздух в этом аппарате насыщается до 100 %, не изменяя своей температуры, равной температуре поступающей воды, которую, как характерную для компрессоров и конденсаторов холодильных машин, примем равной 35 С. Найдем удельный расход воздуха g для отводимого теплового потока Q = 1,16 кВт в зависимости от давления в аппарате. Для расчетов принимаем следую цие граничные условия верхнее давление Я = Ра = 1-10 Па — атмосферное давление, соответствующее режиму работы градирен нижнее давление Р Р — = 5700 Па — давление, соответствующее режиму работы вакуумного аппарата с кипением воды при температуре tn, равной 35 °С.
[c.139]
Найдем удельный расход воздуха g для отводимого теплового потока Q = 1,16 кВт в зависимости от давления в аппарате. Для расчетов принимаем следую цие граничные условия верхнее давление Я = Ра = 1-10 Па — атмосферное давление, соответствующее режиму работы градирен нижнее давление Р Р — = 5700 Па — давление, соответствующее режиму работы вакуумного аппарата с кипением воды при температуре tn, равной 35 °С.
[c.139]
Это — линейное соотношение, к которому изотермы приближаются, когда р стремится к нулю. Отношение между двумя величинами температуры на термодинамической шкале, соответствующее любым двум воспроизводимым уровням температуры (например, температурам кипения воды и таяния льда при давлении в 1 стандартную атмосферу , может быть найдено измерением объема любого пара или смеси паров ири нескольких низких давлениях на каждом уровне температуры. Произведение давления и объема в зависимости от давления может быть выражено графически 1(рис.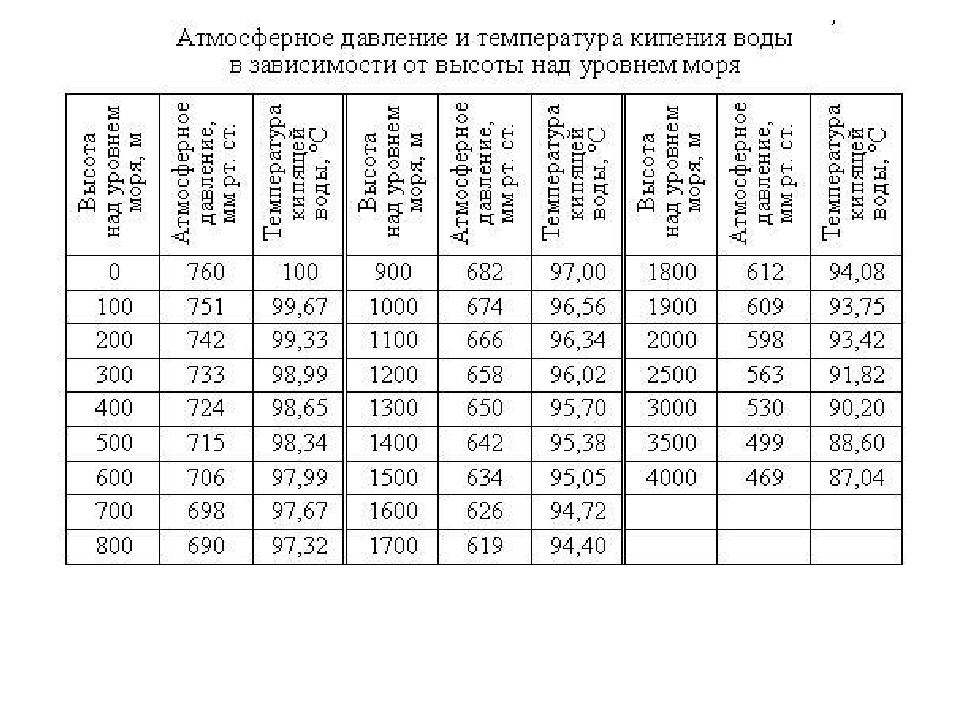 2il-l) с экстраполяцией кривых до нулевого давления. В таком случае из уравнения (21-2) имеем
[c.206]
2il-l) с экстраполяцией кривых до нулевого давления. В таком случае из уравнения (21-2) имеем
[c.206]
Значения критической плотности теплового потока qy для кризиса первого рода при кипении воды в условиях вынужденного течения в круглой трубе диаметром 8 мм и длиной /> 160 мм, обогреваемой равномерно по периметру и длине, представлены в табл. 3.27 [89] в зависимости от давления р, массовой скорости G, степени недогрева воды до температуры насыщения Д — Т или массового паросодержания в месте кризиса х = = 0 /(0 + ( п), где и — массовые расходы пара и жидкости. Представленные значения получены приведением большого числа экспериментальных данных по для различных условий к диаметру трубы 8 мм и единым значениям других определяющих факторов, находящихся в диапазонах р = 3—20 МПа G = 750—5000 кг/(м -с) Д ед = 75-0К л = 0-л . [c.243]
В зависимости от степени подогрева питательной воды экономайзеры подразделяют на некипящие и кипящие . В водяных экономайзерах некипящего типа (чугунном или стальном) питательная вода подогревается до температуры на 40. . . 50° ниже температуры кипения при данном давлении в паровом котле, а в водяных экономайзерах кипящего типа питательная вода нагревается до температуры кипения, при которой до 25 % ее массы превращается, во влажный насыщенный пар. При наличии автоматических устройств, регулирующих температуру подогреваемой воды, допускается разность температур кипения воды в котле и воды в экономайзере некипящего типа 20°.
[c.86]
. . 50° ниже температуры кипения при данном давлении в паровом котле, а в водяных экономайзерах кипящего типа питательная вода нагревается до температуры кипения, при которой до 25 % ее массы превращается, во влажный насыщенный пар. При наличии автоматических устройств, регулирующих температуру подогреваемой воды, допускается разность температур кипения воды в котле и воды в экономайзере некипящего типа 20°.
[c.86]
При уменьшении или увеличении давления на свободной поверхности жидкости при данной температуре соответственно уменьшается или увеличивается давление насыщенного пара. Следовательно, при уменьшении атмосферного давления (например, в горах) температура кипения воды снижается, а при повышении (например, в глубокой шахте) температура кипения возрастает. Имея таблицу зависимости давления насыщенного пара жидкости от температуры, можно по температуре кипения жидкости (например, воды) определить соответствующее ей давление насыщенного пара, равное (для открытых сосудов) атмосферному давлению.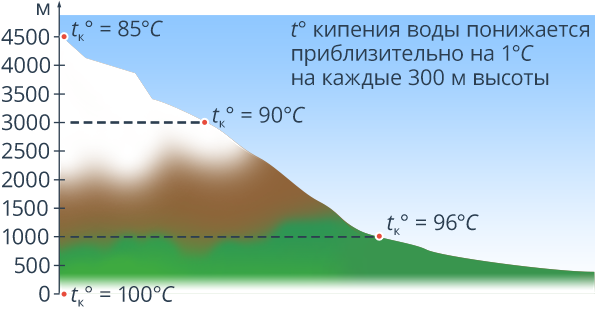 [c.14]
[c.14]
На рис. 6-6 приведена типичная картина зависимостей g и а от температурного напора А , под которым понимается превышение температуры стенки ст над температурой насыщения которая находится по таблицам насыщенного пара соответственно заданному давлению [12,22]. Экспериментальные числовые значения характеризуют ориентировочно случай кипения воды в [c.167]
Графики изменения теплотехнических характеристик конденсационной части поверхностного конденсатора в зависимости от изменения относительного массового содержания ДФС по длине трубного пучка представлены на рис. 8.2. Из них видно, что температура наружной поверхности труб на 16. .. 18 К превосходит температуру кипения воды при атмосферном давлении. Поэтому вдоль всего конденсационного участка трубного пучка теплоотдача к воде осуществляется в режиме поверхностного кипения. Значение коэффициента теплоотдачи при этом имеет тот же порядок, что и при конденсации ДФС. Это обеспечивает достаточно высокие значения плотностей тепловых потоков, лежащие в диапазоне от 1,92-10 до 2,73-10 Вт/м .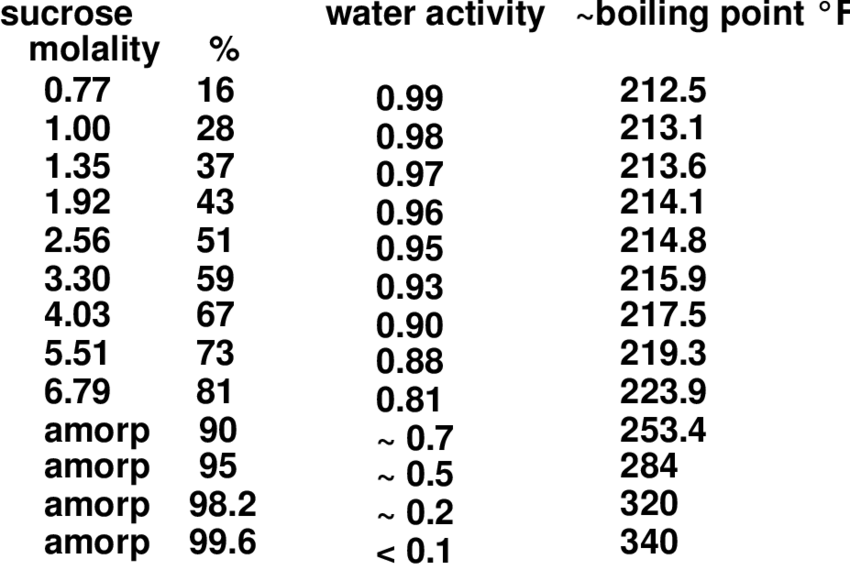 Отметим, что указанные
[c.157]
Отметим, что указанные
[c.157]
Из повседневного опыта мы знаем, что одно и то же вещество в зависимости от внешних условий (давление и температура) может находиться в различных агрегатных состояниях. Например, при атмосферном давлении вода существует в жидком состоянии при температурах от О до 100° С. При температуре ниже 0° С при атмосферном давлении вода переходит в твердую фазу — лед, а при нагреве выше 100° С вода переходит в парообразное состояние. Известно также, что при изменении давления температуры затвердевания и кипения вещества изменяются. [c.135]
Предельный регенеративный цикл перегретого пара, характеризуемый подогревом питательной воды до температуры кипения при начальном давлении в бесконечно большом числе ступеней подогрева, мог бы дать увеличение термического к. п. д. сравнительно с циклом Ренкина на 15—25%, в зависимости от значения начальных параметров, но практически он неосуществим. [c.89]
Если рассматривать каждую кривую жидкости в отдельности, то увидим, что для каждой жидкости зависимость температуры кипения от давления очень значительна и притом интенсивность изменения от изменения р различна, а именно — увеличивается с возрастанием давления.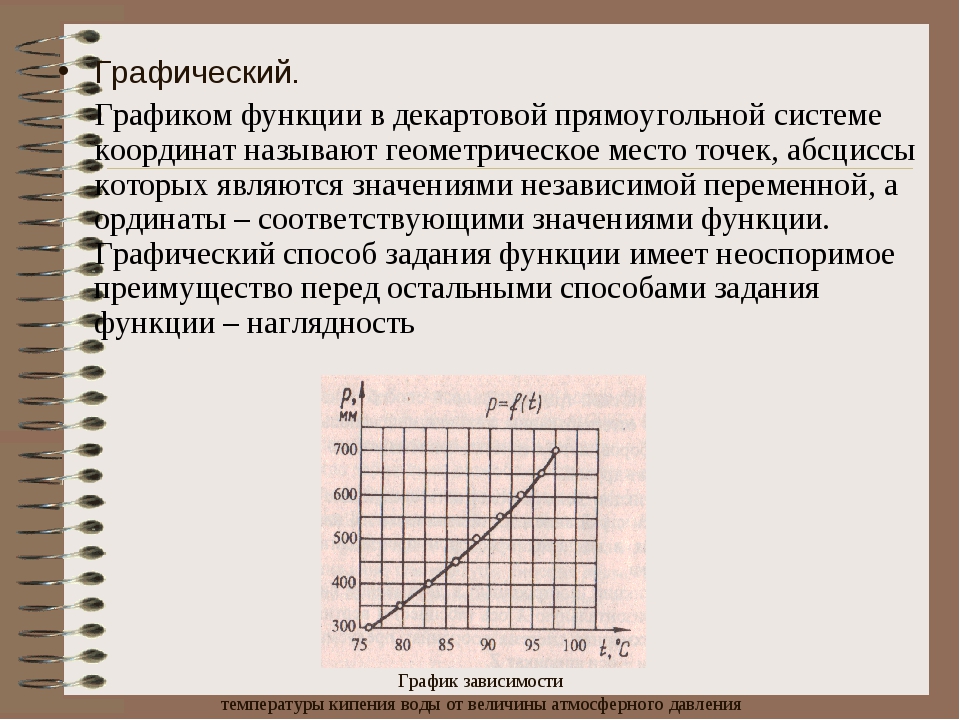 Например, при 1 ат температура кипения воды =100° С, а при 2 ата 1 =119,53, т. е. температура изменяется на 19″ ,53С с изменением давления на 1 ата при изменении же давления также на 1 ата, но в пределах давлений от 99 до 100 ага изменение / составляет всего лишь на 0,79° С, т. е. интенсивность изменения температуры кипения понизилась в 23 раза. Примерно такое же явление имеем и для других жидкостей, что видно из характера кривых, приведенных на фиг. 9. 3.
[c.216]
Например, при 1 ат температура кипения воды =100° С, а при 2 ата 1 =119,53, т. е. температура изменяется на 19″ ,53С с изменением давления на 1 ата при изменении же давления также на 1 ата, но в пределах давлений от 99 до 100 ага изменение / составляет всего лишь на 0,79° С, т. е. интенсивность изменения температуры кипения понизилась в 23 раза. Примерно такое же явление имеем и для других жидкостей, что видно из характера кривых, приведенных на фиг. 9. 3.
[c.216]
Система охлаждения может быть открытой или закрытой в зависимости от того, имеет ли она непосредственное сообщение с атмосферой. В открытой системе образующийся пар непрерывно отводится в атмосферу, что вызывает сравнительно большой расход охлаждающей жидкости. В закрытой системе выход пара возможен через специальный клапан только при образовании внутри системы избыточного давления 0,2—0,3 кг см . Этим значительно снижается расход жидкости, уменьшается образование накипи, а также несколько повышается температура кипения воды (примерно до 105—108°).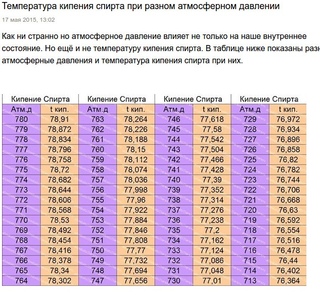 [c.35]
[c.35]
Термометр, работающий на принципе расширения вещества при нагревании, дает различные показания в зависимости от того, каким веществом он заполнен. На пример, если взять два одинаковых термометра, один из которых заполнен ртутью, а другой — спиртом, отметить на них две постоянных точки 0° — температуру таяния льда и 100° — температуру кипения воды при нормальном давлении, и промежуток между О и 100° разделить на 100 равных делений, каждое из которых будет соответствовать /=ГС, то в силу того, что коэффициенты объемного расширения этих веществ сами зависят от температуры и притом различным образом для разных, веществ, показания термометров будут, строго говоря, одинаковы лишь при 0° и при 100°, но не в интервале между этими температурами. Поэтому деления на шка л ах этих термометров должны быть различными.
[c.8]
Теплоотдача при кипении жидкости-Опыт показывает, что температура кипящей жидкости всегда несколько выше 1 . Она остается почти постоянной в направлении от свободного уровня к поверхности теплообмена (рис. 13.11, а) и лишь в слое толщиной 2 5 мм у самой стенки резко возрастает. Следовательно, в прилегающем к стенке слое жидкость перегрета на величину Д/=0—4 эта величина называется температурным напором. Экспериментальная зависимость ц и а от температурного напора Ц представлена на рис. 13.11,6 при кипении воды в большом объеме при атмосферном давлении. На участке АВ при Д/ = 0ч-5°С д= 100-ч-5600 Вт/м2 значение коэффициента теплоотдачи невелико и определяется условиями свободной конвекции однофазной жидкости. При дальнейшем повышении М
[c.171]
Она остается почти постоянной в направлении от свободного уровня к поверхности теплообмена (рис. 13.11, а) и лишь в слое толщиной 2 5 мм у самой стенки резко возрастает. Следовательно, в прилегающем к стенке слое жидкость перегрета на величину Д/=0—4 эта величина называется температурным напором. Экспериментальная зависимость ц и а от температурного напора Ц представлена на рис. 13.11,6 при кипении воды в большом объеме при атмосферном давлении. На участке АВ при Д/ = 0ч-5°С д= 100-ч-5600 Вт/м2 значение коэффициента теплоотдачи невелико и определяется условиями свободной конвекции однофазной жидкости. При дальнейшем повышении М
[c.171]
Растворимости кислорода, близкой к нулевой, можно достигнуть при разных температурах в зависимости от величины вакуума или избыточного давления (см. рис. 67). Однако для значительного уменьшения содержания кислорода в воде требуется довольно большое время. Скорость удаления кислорода из воды, нагретой до кипения, определяется уравнением
[c. 314]
314]
Как указывалось выше (п. 8.2.3), теплообмен при развитом пузырьковом кипении полностью управляется своими внутренними механизмами и не зависит от скорости вынужденного движения. Однако это не означает, что вынужденное движение вообще не влияет на закономерности кипения. Прежде всего с ростом скорости течения жидкости Wq возрастает коэффициент теплоотдачи однофазной конвекции и, следовательно, при неизменной плотности потока q уменьшается перегрев стенки относительно. Это приводит к тому, что начало кипения в потоке жидкости происходит при тем больших q, чем выше скорость жидкости. Эта закономерность хорошо видна из рис. 8.5, на котором представлены сглаженные опытные зависимости q(AT), полученные одним из авторов [17]. Теплообмен происходил на омываемой потоком воды плоской пластине при давлении 3,92 бар. Кривая 1 соответствует кипению при свободном движении (в большом объеме). В условиях обтекания пластины потоком воды до начала закипания коэффициент теплоотдачи не зависит от плотности теплового потока и целиком определяется скоростью жидкости (кривые 2, 3, 4).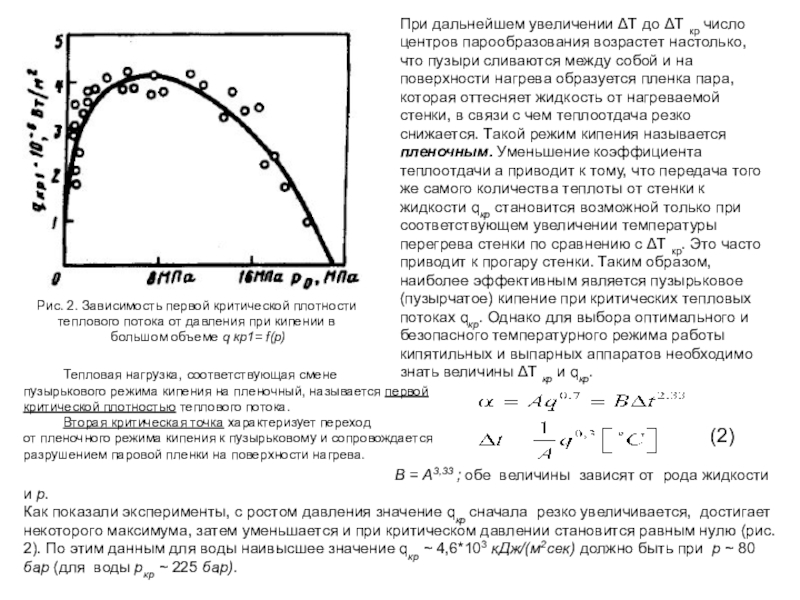 С ростом теплового потока при постоянном а, растет температура стенки, и при некотором значении
[c.355]
С ростом теплового потока при постоянном а, растет температура стенки, и при некотором значении
[c.355]
Вода обладает хорошей конвекционной теплопроводностью и слабо поглощает нейтроны. В мощных реакторах, имеющих температуру активной зоны около 300 °С, использование воды затрудняется ее закипанием. Чтобы избежать кипения, приходится сильно повышать давление в системе теплоотвода. А это требует использования больших количеств нержавеющей стали, которая сильно поглощает нейтроны. Кроме того, при высоких температурах вода становится химически активной. Интересной разновидностью водяного теплоносителя является система с кипящей водой, не требующая больших давлений. При этом получающийся пар можно направлять прямо в энергетическую турбину, что в перспективе дает возможность получать высокий к. п. д. в соответствующих энергетических установках. Недостатком реактора на кипящей воде является довольно сильная зависимость коэффициента размножения k от давления пара в активной зоне, что может привести к опасной нестабильности реактора. [c.580]
[c.580]
Для пленочного кипения характерно существование паровой пленки, покрывающей поверхность нагрева. Пленочное кипение происходит при большей разности температур между твердой поверхностью и жидкостью. Для воды (и большинства органических жидкостей) при атмосферном давлении этот температурный напор составляет > 100°. Пленочное кипение наблюдается в быстродействующих перегонных аппаратах, при кипении криогенных жидкостей, охлаждении двигателей на химическом топливе, охлаждении реакторов и др. При высоких давлениях коэффициент теплоотдачи при пленочном кипении может так возрасти, что пережога поверхности нагрева не наступает. При высоких температурах при пленочном кипении значительное количество теплоты передается излучением, поэтому коэффициент теплоотдачи при пленочном кипении зависит от излучательных свойств поверхности теплообмена, поверхности жидкости и самого пара. Расчетные зависимости для коэффициентов теплоотдачи при ламинарном движении паровой пленки могут быть получены теоретическим путем. В развернутой форме эта зависимость имеет вид
[c.202]
В развернутой форме эта зависимость имеет вид
[c.202]
При кипении воды, когда р = р ц р превращается в нуль, количество растворенных газов падает до нуля. На фиг. 107 показана зависимость содержания кислорода в воде от температуры при разных давлениях.
[c.140]
Теперь мы в состоянии установить количественное влияние примеси воздуха в конденсаторе на скорость конденсации. Предположим известным давление, температуры подводимого пара и охлаждающей воды Tq, а также отношение проводимостей. Найдем зависимость изменения скорости конденсации —т» от содержания воздуха в паре (1—/о). Уравнения (6-41) и (6-39) показывают, что —т» имеет наибольшее положительное значение при концентрации (1—/о), равной нулю. Скорость конденсации уменьшается линейно с ростом содержания воздуха в газовой фазе. Пропорциональное уменьшение скорости конденсации будет максимальным при температуре охладителя, лишь немного меньшей температуры кипения. Следующий пример служит количественной иллюстрацией этой тенденции.
[c.249]
Следующий пример служит количественной иллюстрацией этой тенденции.
[c.249]
Температура кипения воды в котлах составляет в зависимости от давления от 150 до 350° С, температура греющего тела (газов) доходит до 1 500° С и выше, а температура, при которой обычная трубная сталь еще сохраняет необходимую для сопротивлен1Ия внутреннему [c.193]
Цикл 1—2—3—4—I (см. рис. 97) представляет собой круговой процесс, совершаемый ртутью. Начальная точка цикла — точка I. Она характеризует состояние ртути при поступлении ее в ртутный котел. Линия ]—2 изображает нагрев жидкой ртути, причем точка 2 соответствует температуре кипения при данном давлении. Последнее выбирают таким, чтобы температура в точке 2 соответствовала наибольшей допустимой температуре. Уже при 1МПа для ртути температура кипения равна 515″ С. Линия 2—3 изображает парообразование в котле, 3—4 — адиабатное расширение ртутного пара в паро-ртутиой турбине и 4—I — копдеисацпю отработавшего пара в конденсаторе-испарителе. Точку 4 выбирают в зависимости от того, какое давление выбрано для второго рабочего тела — воды.
[c.242]
Точку 4 выбирают в зависимости от того, какое давление выбрано для второго рабочего тела — воды.
[c.242]
На рис. 8.12 приведена фазовая диаграмма воды, в которой тройная точка (нонвариантная система) обладает координатами 7 =273,15 К, /7=610,5 Па. Температура кипения при давлении 1,013 10 Па соответствует 373,15 К. Введение растворенного вещества (второй компонент) увеличивает число степеней свободы и константные точки растворителя начинают смещаться в зависимости от концентрации растворенного вещества. На этой же диаграмме штриховой линией нанесена кривая давления насыщенного пара над водным раствором некоторой постоянной концентрации С = onst. Пересечение штриховой кривой с изобарой р= 1,013 10 Па произойдет при температуре выше 373 К, а с кривой давления пара надо льдом — ниже 273,15 К. Все изменения константных точек могут быть вычислены или определены экспериментально. Для разбавленных растворов они прямо пропорциональны числу молей растворенного вещества. Расчетные уравнения, известные из курса химии [29], приведены ниже.
[c.282]
Расчетные уравнения, известные из курса химии [29], приведены ниже.
[c.282]
Как известно, в устойчивом равновесии всякая сйстема в зависимости от характера внешних условий имеет минимум одного из своих термодинамических потенциалов и при изменении этих условий переходит из одного устойчивого состояния в другое. Например, когда воде сообщается теплота при нормальном атмосферном давлении, то она или нагревается, или закипает и частично переходит в пар, как только ее температура достигает 100° С. Однако известно также, что путем очистки жидкости можно добиться ее перегрева и фазовый переход не наступит даже при температуре, заметно превышающей температуру кипения при данном давлении. Аналогично обстоит дело и в случае других фазовых переходов первого рода в чистом паре затягивается конденсация (переохлажденный пар), в чистой жидкости или растворе затягивается переход в кристаллическое состояние (пересыщение). [c.229]
Вода обладает многими специфическими свойствами, имеющими ярко выраженный аномальный характер. Все они — следствие особенностей структуры воды и развитости в ней водородных связей. Плавление твердой воды — льда — сопровождается не расширением, а сжатием, а при замерзании воды объем льда значительно увеличивается. Как известно, подавляющее большинство веществ при плавлении расширяется, а при затвердевании, наоборот, уменьшает свой объем. Аномально также влияние температуры на изменение плотности воды при росте температуры от 273 до 277 К плотность увеличивается, при 277 К она достигает максимальной величины, и только при дальнейшем повышении температуры плотность воды начинает уменьшаться. Зависимость теплоемкости воды от температуры имеет экстремальный характер. Минимальная теплоемкость достигается при температуре 308,5 К и вдвое превышает теплоемкость льда, а при плавлении других твердых тел тегаюемкость изменяется незначительно. Удельная теплоемкость воды аномально велика, она равна 4,2 Дж/(г К). Вязкость воды в отличие от вязкости других веществ растет с повьцнением давления в интервале температур от 273 до 303 К.
Все они — следствие особенностей структуры воды и развитости в ней водородных связей. Плавление твердой воды — льда — сопровождается не расширением, а сжатием, а при замерзании воды объем льда значительно увеличивается. Как известно, подавляющее большинство веществ при плавлении расширяется, а при затвердевании, наоборот, уменьшает свой объем. Аномально также влияние температуры на изменение плотности воды при росте температуры от 273 до 277 К плотность увеличивается, при 277 К она достигает максимальной величины, и только при дальнейшем повышении температуры плотность воды начинает уменьшаться. Зависимость теплоемкости воды от температуры имеет экстремальный характер. Минимальная теплоемкость достигается при температуре 308,5 К и вдвое превышает теплоемкость льда, а при плавлении других твердых тел тегаюемкость изменяется незначительно. Удельная теплоемкость воды аномально велика, она равна 4,2 Дж/(г К). Вязкость воды в отличие от вязкости других веществ растет с повьцнением давления в интервале температур от 273 до 303 К.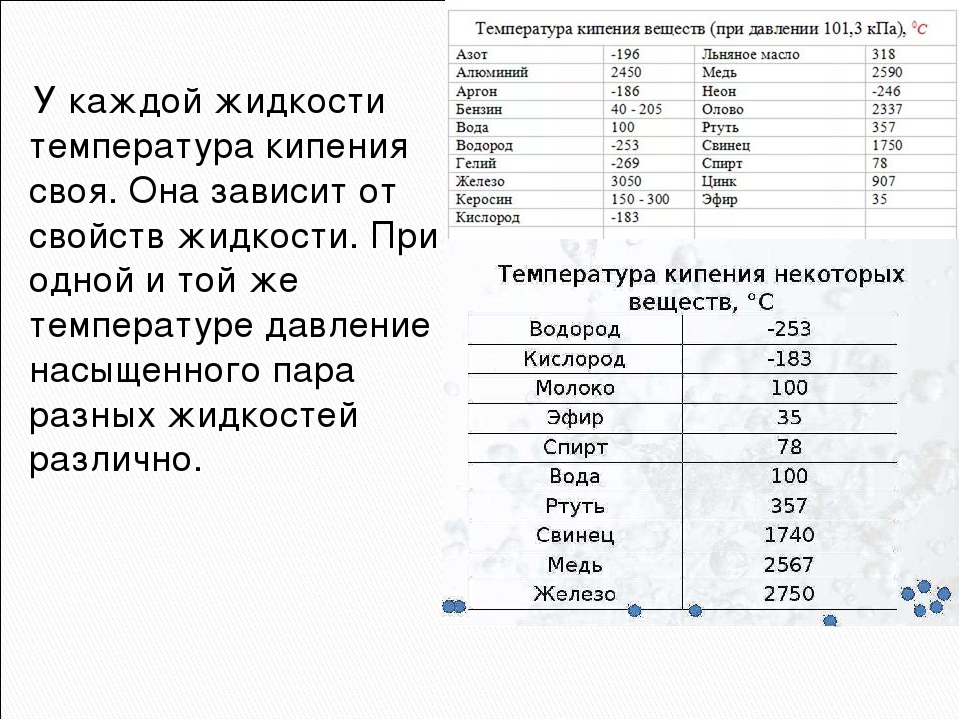 Вода имеет температуру плавления и кипения, значитель-
[c.186]
Вода имеет температуру плавления и кипения, значитель-
[c.186]
Работа термохимических трансформаторов теплоты основана на свойствах растворов. В исиол ,дуемых для этих целей растворах растворителем является вода, а растворенным веществом — гидрат окиси калия КОН или едкий натр NaOH. Темперагура кипения чистой воды ниже температуры кипения раствора при том же давлении. На рис. 65, б изображена зависимость температуры кипения водяного раствора КОН от концентраций лкои и хн о мри различных давлениях. При давлении 100 кПа чистая вода кипит при температуре 372,64 К, а 90%-пый раствор КОН — при 643 К. [c.353]
В зависимости от создаваемого вакуума, параметров охлаждающей воды и пара для ва-куум-кристаллизационных установок обычно используются двух-, трех- или черырехступен-чатые пароэжекторные блоки. При температуре охлаждающей воды 15…20 С и давлении пара 0,6…0,9 МПа такие блоки позволяют создать в системе вакуум, соответствующий остаточному давлению 5,3. ..3,3 кПа и температуре кипения воды 34…26 °С. При необходимости эту температуру можно понизить путем создания более глубокого вакуума.
[c.549]
..3,3 кПа и температуре кипения воды 34…26 °С. При необходимости эту температуру можно понизить путем создания более глубокого вакуума.
[c.549]
В зависимости от степени нагрева воды различают некнпящие и кипящие экономайзеры. В кекипящих экономайзерах нагрев питательной воды производится до температуры на 30—40 К ниже температуры кипения в котле в кипящих — происходит ке только подогрев, но и испарение 15—20% воды. Стальные зкономайзеры применяют в котельных агрегатах среднего и высокого давления чугунные — только в котельных агрегатах низкого давления (до 2,25 МПа). [c.191]
Величина а для каждого термометра определялась из данных, полученных при изучении зависимости температуры кипения воды от давления. Ошибка в значении а составляла примерно 0,000000025 при определении значений температуры кипения серы, соотв тствую-ш их давлению 660—880 мм рт. ст., по сравнению со значением, соответствующим 760 мм рт. ст., это приводило к ошибке, меньшей [c.291]
Характер зависимости коэффициента Грюнайэена от температуры для различных давлений показан на рис. 8.15 и 8.16. Из рис. 8.16 видно, что для воды, недогретой до кипения, коэффициент Грюнайзенав широком диапазоне давлений является функцией только температуры, а значение его при этом существенно больше, чем для пароводяной смеси. Этот факт можно объяснить из рассмотрения формулы для определения коэффициента Грюнайзена, из которой следует, что величина, обратная величине коэффициента Грюнайзена, характеризует степень энергоемкости тела. Другими словами, наиболее энергоемкие теплоносители должны иметь наименьшее значение коэффициента Грюнайзена. Для более точной характеристики физического смысла коэффициента Грюнайзена запишем его в виде [c.186]
На рис. 2 представлена зависимость коэффициента теплообмена при поверхностном кипении воды под давлением 1,5 ата, полученная автором К Экспериментальный участок опытной установки представлял собой латунную горизонтальную трубку с внутренним диаметром 7,95 мм длиной от 700 до 900 мм. Для измерения температуры стенки к трубке припаивались оловом медь-константановые термопары, которые располагались по боковой образующей. Приведенные на рис. 2 опытные данные относятся к двум разным режимам, отличающимся друг от друга скоростью циркуляции и удельной тепловой нагрузкой. Экспериментальные кривые экстраполированы до значений коэффициентов теплообмена, устанавливающихся в условиях развитого кипения при нулевом паро-содержании (3. Эти значения а определены по формуле Л. С. Стер-мана [2].
[c.115]
Парообразование в открытом и закрытом свсудах. Зависимость температуры кипения БОДЫ и конденсации пара от давления. Теплосодержание воды при температуре кипения. Понятие о насыщенном паре. Теплота парообразования. [c.612]
Температура кипения воды — Справочник химика 21
ТЕМПЕРАТУРЫ КИПЕНИЯ ВОДЫ ( С) ПРИ ДАВЛЕНИЯХ 700-780 мм рт. fin. [c.56]
Данные о температурах кипения воды прн давленияХ близких к атмосферному, см. стр. 55,. ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА РТУТИ I. Температура от —38 до 358° [c.725]
Тройная точка воды, в которой ее пары, жидкая и твердая фазы могут сосуществовать в равновесии, характеризуется температурой 0,0098°С и давлением 0,0060 атм. Поскольку нормальное атмосферное давление превышает указанную величину, мы привыкли видеть, что лед плавится, переходя в жидкую воду, а не сублимирует, подобно Oj- Пересечение горизонтальной прямой, соответствующей давлению Р = 1 атм, с кривой равновесия твердая фаза-жидкая фаза дает температуру плавления льда 0°С, а пересечение этой горизонтали с кривой равновесия жидкость-пар дает температуру кипения воды 100°С. Различие между жидкой и газообразной водой исчезает только при давлениях выше критического, которое равно 218 атм. [c.133]
С целью использования теплоты сгорания применяются аппараты погружного горения. Нагретые газы барботируются через слой жидкости, вода испаряется, а соли кристаллизуются. Коэффициент использования теплоты сгорания топлива достигает 95— 96%. Данный метод концентрирования применим для переработки стоков, содержащих соединения с температурой кипения в 2— 3 раза выше температуры кипения воды. В этом случае отходящие пары воды могут быть сконденсированы и использованы в системах оборотного водоснабжения. [c.490]
Температура кипения воды при различных давлениях [c.457]
Простая перегонка осуществляется путем постепенного испарения сточной воды. Образующиеся пары конденсируются и в виде жидкости — дистиллята — собираются в сборнике. В результате перегонки в кубе аппарата остается сточная вода с более низким содержанием вредных соединений, а в сборнике — дистилляте удаляемыми соединениями. Метод применяется для удаления из сточной воды соединений, имеющих температуру кипения ниже температуры кипения воды (ацетон, спирты и т. д.). С целью более полного удаления органических соединений и получения концентрированного дистиллята перегонку осуществляют с дефлегмацией. [c.489]
В табл. П.18 приведены данные о вязкости воды, в табл. П.19 — о температуре кипения воды при различных давлениях, в табд. П.20 — о поверхностном натяжении воды, в табл. П.21—о показателе преломления воды, в табл. П.22 — о теплоемкости воды, в табл. П.23 — о давлении паров воды при различных температурах, в табл. П.24 — 0 свойствах насыщенного водяного пара, в табл. П.25об энтальпии перегретого водяного пара, [c.456]
ТЕМПЕРАТУРЫ КИПЕНИЯ ВОДЫ (в «С) ПРИ ДАВЛЕНИЯХ Ш-Ш мм рт. ст. [c.55]
Температура кипения. При нормальном атмосферном давлении температура кипения воды равна примерно 100° С. С увеличением давления температура кипения повышается, как это видно из таблицы. Это означает, что определенной температуре кипения соответствует определенное давление. Если вода должна циркулировать в системе отопления, то вся система должна находиться под более высоким давлением, чем соответствующее температуре давление. Содержание некоторого количества пара в воде не мешает циркуляции воды, наоборот, оно ее увеличивает. Естественная циркуляция имеет, однако, определенные границы. Известно, что предельное давление при естественной циркуляции равно приблизительно, 180—200 ата. [c.290]
Ученые пользуются для измерения температуры стоградусной шкалой, или шкалой Цельсия. В этой шкале температуре замерзания воды соответствует иоль градусов — это пишется О «С. Комнатная температура — примерно 25 °С, а температура кипения воды — 100 «С. Температура кипения четыреххлористого углерода 77 С, так что он, как видите, закипает и превращается в пар легче, чем вода. Температуры более низкие, чем температура замерзания воды, пишутся со знаком минус. Например, метан кипит при температуре на 161 градус ниже, чем температура замерзания воды, это пишется — 161°С. В США для измерения температуры обычно. применяется шкала Фаренгейта. Кое-где автор приводит в скобках температуру по Фаренгейту. Например, температура кипения воды 100 С (212 F), а четыреххлористого углерода 77 «С (171″Р). [c.69]
Температуры кипения воды при высоких давлениях см. на стр. 725. [c.55]
Для поддержания противотока экстрактная фаза нагнетается из одной ступени в другую. Из экстрактора 9 рафинатная фаза направляется в перегонный куб высокого давления, где отгоняется ббльшая часть пропана, а затем идет в перегонный куб низкого давления, где от нее отделяются оставшийся пропан и ббльшая часть растворителя селекто. Окончательно рафинат отделяется от селекто перегонкой с водяным паром, в результате которой получается очищенное масло. Экстракт, выходящий из экстрактора Э , освобождается от растворителей таким же образом в отдельной группе перегонных кубов. Вода из пара, применяющегося для перегонки с водяным паром, отделяется от селекто в перегонном кубе, работающем при температуре, немного превышающей температуру кипения воды. [c.198]
В этом процессе максимальная температура катализатора всего на 10°С превышает температуру кипения воды, даже если отношение количества рециркулируемого газа к количеству исходного газа, подаваемого в реактор, составляет лишь 2,5—3,5. При этом срок службы катализатора превышает 5 лет. В зависимости от температуры воды, подаваемой из парового котла, при 40—50 атм может быть получено до 1,4 т пара на каждую тонну метанола. Постоянство температуры катализатора предотвращает образование побочных продуктов. Пар, получаемый в реакторе синтеза метанола, с успехом применяют для питания компрессора рециркуляции, выходящий из турбины пар— для дистилляции сырого метанола. Регулирование температуры в реакторе осуществляется чрезвычайно просто. На стадии дистилляции метанола пар экономят за счет его отвода сверху первой колонны чистого метанола к испарителям второй колон- [c.229]
Азеотропная перегонка основана на способности ряда органических соединений образовывать друг с другом или с водой нераздельно кипящие смеси, имеющие температуру кипения ниже температуры кипения воды. В этом случае извлекаемое соединение вместе с дистиллатом поступает на дальнейшую переработку. [c.489]
На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы СбН120б [c.121]
Р с ш с н II е. Кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода , Разрыв этих связен, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды. [c.71]
В США в повседневной жизни пока еще используется температурная шкала Фаренгейта. При этом температура кипения воды принята за 212°Р, а температура замерзания — за 32 Е интервал между этими температурами разделен на 180 градусов (рис. 1.9). [c.34]
Этот процесс может формально рассматриваться как химическая реакция, хотя он не сопровождается разрывом химических связей в молекулах или образованием новых химических связей. Представим себе, что показанный на рис. 4-2 цилиндр вместо СаСОз и СаО наполовину заполнен водой и что вначале поршень приведен в соприкосновение с поверхностью воды. Если поднять поршень на некоторую высоту, жидкость в цилиндре будет испаряться, но только до тех пор, пока давление паров воды не достигнет постоянного значения, зависящего только от температуры. Оно называется равновесным давлением насыщенных паров воды при данной температуре. При 25 С давление насыщенных паров воды равно 0,0313 атм. При 100°С давление насыщенных паров воды достигает 1 атм, и, как мы узнаем из гл. 18, этим и определяется нормальная температура кипения воды. Давление водяных паров над поверхностью жидкой воды в цилиндре не зависит от толщины слоя воды в нем единственным условием существования насыщенных паров (т.е. равновесия в системе жидкая вода-пары воды) является наличие любого количества воды, способного испаряться, чтобы [c.186]
Совместное влияние формы молекулы и ее полярности помогает объяснить многие из свойств воды, рассмотренные выше. Например, поскольку разноименные заряды притягиваются, противоположные концы соседних молекул слипаются друг с другом. Это приводит к высокой температуре кипения воды. (Для разделения молекул жидкости и образования пара необходимо затратить много тепловой энергии.) Высокое поверхностное натяжение и понижение плотности при кристаллизации льда также может быть объяснено формой молекул воды и их электрической полярностью. В добавление к этому из-за своей полярности молекула воды притягивается к молекулам других полярных веществ. Следовательно, вода способна растворять соединения самой разнообразной структуры. [c.44]
На больших высотах, где атмосферное давление ниже нормального (1 атм), температура кипения воды снижается. Бюро погоды США определяет изменения давления на разной высоте с помощью простого правила дюйм ртутного столба на каждые 1000 футов (приблизительно 25 мм рт. ст. на каждые 300 м). Нормальное (стандартное) атмосферное давление равно 29,9 дюйма ртутного столба (760 мм рт. ст.). [c.128]
Воспользуйтесь описанным выше приближением, чтобы вычислить температуру кипения воды на высоте 12000 футов в горах. [c.128]
Полагая, что энтальпия и энтропия испарения не зависят от температуры, вычислите температуру кипения воды в скороварке при давлении внутри нее 2 атм. Какое значение для приготовления пищи имеет повышенное давление внутри скороварки [c.152]
Так как площадь теплообменной поверхности аппарата Р = = 382 м=) выбрана ранее, тепловой расчет сводится к определению температуры кипения воды в межтрубном пространстве [c.288]
Температурой кипения жидкости является температура, при которой давление ее паров становится равным внешнему давлению (так, при 101 кПа температура кипения воды равна 100 ° j бензо ла 80Х). [c.241]
В некоторых случаях подобрать в качестве разделяющего агента органическую жидкость, изменяющую относительную летучесть компонентов заданной смеси в желательном направлении,— затруднительно или даже невозможно. Из-за этого, в частности, при получении безводного этанола методом азеотропной ректификации используются разделяющие агенты (например, углеводороды), увеличивающие относительную летучесть не этанола, а воды, хотя в системе этанол—вода она является высококипящим компонентом. Принимая во внимание значительную разницу температур кипения воды и этанола, несомненно, желательно было бы использовать разделяющие агенты, увеличивающие относительную летучесть последнего. Такие соображения заставили исследователей обратиться к изысканию мине- [c.66]
ТЕМПЕРАТУРА КИПЕНИЯ ВОДЫ ПРИ ВЫСОКИХ ДАВЛЕНИЯХ [c.725]
В настоящее время по международному соглашению основой температурной шкалы является не деление на 100 частей температурного интервала между нормальными точками плавления и кипения воды, а приравнивание нормальной температуры плавления воды величине 273,15° (точно) по абсолютной шкале температур. В соответствии с этой новой основой температурной шкалы нормальная температура кипения воды не равна 373,15° по абсолютной шкале, а может изменяться при совершенствовании измерительной техники, и в 1960 году была, например, равна 373,148°. Впрочем, в современной практической температурной шкале это небольшое отклонение нормальной температуры кипения (н. т. к.) воды от 100°С игнорируется и н. т. к. воды, как и раньше, приравнивается 373,15°К.— Прим. ред. [c.22]
Для получения алмазов необходимы сверхвысокие давления которые не были доступны в XIX в. Высокие давления в сочетании с высокими температурами позволяют атомам более или менее легко менять свои положения. Под действием высоких давлений различные элементы и соединения принимают новые формы, в которых атомы и молекулы упакованы необычайно плотно. Например, лед, становится значительно более плотным, чем вода, а температура его плавления превышает температуру кипения воды при обычных давлениях . И в 1955 г, по методу Бриджмена были получены наконец первые синтетические алмачы. [c.143]
Если внешнее давление при этом равно 760 мм рт. ст., то температура кипения воды будет 100° и она не изменится за все время кипения, пока останется хотя одна капля воды, независимо от того, как бы энергично ее не нагревали. Аналогичную картину можно наблюдать при кипении любого чистого (индивидуального)» вещества — бензола, толуола, спирта и др. [c.81]
Перегонка в токе водяного пара. Перегонка в токе водяного пара применяется с целью извлечения компонентов из смесей, компоненты которых имеют очень малую летучесть. В этих процессах отгоняемый компонент получается обычно в виде смеси с водой при температуре кипения, в условиях атмосферного давления меньшей, чем температура кипения воды. [c.317]
Температура кипения воды при 0,2 ат составляет 0=59,7 С. Температура кипения раствора [c.481]
В технике для измерения температуры обычно пользуются меж-дународь ой практической (стоградусной) шкалой Цельсия. Единицу измерения по этой шкале обозначают °С. Для построения шкалы Цельсия были выбраны две постоянные температурные точки температура таяния льда и температура кипения воды при нормальном атмосферном давлении (760 мм рт. ст.), а температурный промежуток между ними разделен на 100 равных частей. Температуру, игшеренную по этой шкале, принято обозначать [c.20]
Большое значение имеет и график подъёма температуры. Так как при давлении 5-7 кг/см температура кипения воды находится в интервале 180-197°С, то во избежание разрушения структуры носителя скорость подъёма температуры до 250°С не должна превышать 20°/час. Выпаренная из катализатора вода не сразу доходит до сепаратора. Вначале она накапливается в холодных участках теплообменной и захолаживающей аппаратуры, и только после её прогрева попадает в сепаратор. Обычно наиболее интенсивное дренирование воды из сепаратора (при этом необходимо сделать выдержку) наблюдается в интервале температур в реакторах [c.66]
Имеется множество формул для пересчета давления насыщен-HI.IX паров нефтяных фракций с одной температуры на другую, однако чаще пользуются графическими методами. Наиболее распространенным из предложенных графиков является график Кокса (рис. 4). График Кокса построен следующим образом. Ось абсцисс представляет собой логарифмическую шкалу, па которой отложены ве. [ичины логарифма давления (IgP), однако для удобства пользования на шкалу нанесеньс соответствующие им значения Р. На оси ординат отложены значения температуры. Под углом 30″ к оси абсцисс проведена прямая, обозначенная индексом НоО , которая характеризует зависимость давления насыщенных паров воды от температуры. При построении графика из ряда точек на оси абсцисс восстанавливали перпендикуляры до пересечения с прямой НоО и полученные точки сносили на ось ординат. На оси ординат получилась 1нкала, построенная по температурам кипения воды, соответствующим различным давлениям ее насыщенных паров. Затем для нескольких хорошо изученных углеводородов был взят ряд точек с заранее известными температурами кипения и соответствующими им значениями давления насыщенных паров. [c.41]
Такого рода перегонки у нас нринято производить с дефлегматором Глинского, общий вид которого и размеры даны на фиг. 23. При перегонке обращают внимание на барометрическое давление, вводя соответствующие поправки, а так как для большинства бензиновых компонентов они неизвестны, то по предложению Кисслинга и У ббелоде принимают известные поправки на давление для воды. Температура кипения воды, при изменении давления на 1 jmi в пределах давлений от 740 до 770 мм изменяется в среднем на 0,037°. Эта поправка по Уббелоде вводится и в случае перегонки бензина. Если папр., при давлении в 752 мм бензин начинает кипеть при 82,5°, то при 760 мм он должен кипеть выше на (76СК-752) X X 0,087 = 0,296 или Б круглых числах на 0,3°, т. е. при 32,5° -f + 0,3° =32,8°. [c.107]
Фракционную перегонку (см. рнс. 141) целесообразно применять для обезвоживания только тех жидкостей, температура кипения которых значительно отличается от температуры кипения воды или азеот-ропной смеси с водой, если они таковую образуют, [c.164]
Измерение и регулирование температуры. Для измерения температуры у нас в стране применяют термодинамическую и стоградусную щкалу. Нуль стоградусной щкалы соответствует температуре плавления льда при давлении 760 мм рт. ст., а 100 °С— температуре кипения воды при том же давлении. Измерение температуры основано на физических явлениях, происходящих при нагревании тел, — возникновении электродвижущей силы в месте спая двух разнородных проводников. Два спаянных конца проволоки из различных металлов называют термопарой. Величина электродвижущей силы термопары зависит от температуры спаянного конца. Электрический ток термопар является постоянным, поэтому один из ее свободных концов имеет положительный потенциал, а другой — отрицательный. Свободные концы термопар соединяют проводами, а затем с измерительным прибором. Действие прибора основано на компенсации электродвижущей силы термопары противоположно направленной разностью потенциалов, создаваемой током от батареи, включенной в цепь термопары. [c.87]
Электропроводность воды чрезвычайно мала. Кристаллы воды образуют решетку молекулярного типа. Давление пара при различных температурах см. табл. IV.2 Приложения. Сравнительно высокая температура кипения воды объясняется особенностями ее структуры в жидком состоянии, сильным межмолекуляриым взаимодействием, вызванным преимущественно водородными связями. Плотность большинстна растворителей с повышением температуры уменьшается, тогда как плотность воды при повышении темпера-ож0 дд увеличивается, достигает максимальной величины при 4°С (1,000 г/см ) и уменьшается прн дальпеп-и повышении температуры. Значения [c.170]
Температура кипения 70% раствора КН4К0з определяется при давлении в нейтрализаторе 1,2 атм при этом давлении температура насыщенного водяного нара ( п) равна 103° С. При атмосферном давлении температура кипения 70% раствора КН4К0з равна 120° С, а температура кипения воды 100° С. [c.437]
Термин «нервно-паралитические газы», строго говоря, не совсем верен, так как это жидкости с температурой кипения выше температуры кипения воды. Они, однако, достаточно летучи, чтобы представлять бльшую опасность для людей, находясь в пароной фазе. Именно поэтому и укоренилось название «нервно-паралитические газы». [c.398]
Для повышения глубины регенерации можно применять азеотропную перегонку, т.е. вводить низкокипящие вещества, образующие с водой азеотропные смеси бензол, толуол, ксилол и др. Их вводят в количестве не более 10 % от массы абсорбента через перфорированную трубу под уровень горячего раствора гликоля. Температура кипения образующегося азеот-ропа ниже температуры кипения воды, что позволяет повысить массовую долю регенерированного гликоля до 99,9 % и достигать точки росы осушенного газа минус 75 °С. [c.82]
Режим регенерации следующий. При снижении давления из раствора выделяется от /3 до /3 растворенной в нем двуокиси углерода и одновременно испаряется вода. На испарение воды и выделение СОа из раствора расходуется тепло. Для удаления оставшейся двуокиси углерода требуется довести парциальное давление СО2 над раствором до 0,014 МПа. Последнее достигается за счет дополнительного испарения воды из раствора при нагревании регенерированного раствора в кипятильнике. Температуру в регенераторе поддерживают выше 100 °С, так как температура кипения раствора К2СО3 при атмосферном давлении существенно выше температуры кипения воды. Связанная в бикарбонат двуокись углерода еще более повышает температуру кипения раствора. При более глубокой очистке газа растет расход пара на регенерацию. Расход пара также растет и с понижением парциального давления СОа в исходном газе. Горячий раствор карбоната калия обладает коррозионными свойствами, поэтому в раствор добавляют ингибиторы коррозии (0,1— 0,3% КаСгаО, или ааВ40, ЮНаО). Кроме того, в раствор вводят и кремнийорганические противопенные присадки. [c.121]
При низком вакууме уменьшение давления незначительно влияет на изменение температуры кипения, в области же глубокого вакуума то же изменение давления вызывает уже значительное понижение температуры. Например, снижение остаточного давления на 30 мм рт. ст. в области низкого вакуума (от 760 до 730 мм рт. ст.) вызывает снижение температуры кипения воды со 100° до 99°, т. е. всего на 1°. То же снижение давления на 30 мм, но с остаточного давлеппя от 50 до 20 мм рт. ст. вызывает снижение температуры кипения воды с 38° до 22°, т. е. на 16° уменьшение остаточного давления еще на 16 рт. ст. (от 20 до мм рт. ст.) снижает температуру кипения воды на 22°. [c.86]
Понятия и основы термодинамики (1962) — [
c.180
]
Курс физической химии Том 1 Издание 2 (1969) — [
c.83
]
Курс физической химии Том 1 Издание 2 (копия) (1970) — [
c.83
]
Краткий курс физической химии Издание 3 (1963) — [
c.196
]
Справочник химика Издание 2 Том 1 1963 (1963) — [
c.55
,
c.56
,
c.602
,
c.608
]
Справочник химика Том 1 Издание 2 1962 (1962) — [
c.55
,
c.56
,
c.602
,
c.608
]
Справочник химика Том 1 Издание 2 1966 (1966) — [
c.55
,
c.56
,
c.602
,
c.608
]
Справочник химика Изд.2 Том 1 (1962) — [
c.55
,
c.56
,
c.602
,
c.608
]
Свойства пара / Техническая информация / Темп-ресурс
Свойства пара
Что это такое и как им пользоваться
Численные значения параметров теплоты, а также взаимосвязь между температурой и давлением, приведенные в настоящем Руководстве, взять из Таблицы «Свойства насыщенного пара».
Определение применяемых терминов:
Насыщенный пар
Чистый пар, температура которого соответствует температуре кипения воды при данном давлении.
Абсолютное давление
Абсолютное давления пара в барах (избыточное плюс атмосферное).
Зависимость между температурой и давлением
Каждому значению давления чистого пара соответствует определенная температура. Например: температура чистого пара при давлении 10 бар всегда равна 180°С.
Удельный объём пара
Масса пара, приходящаяся на единицу его объёма, кг/м3.
Теплота кипящей жидкости
Количество тепла, которое требуется чтобы повысить температуру килограмма воды от 0°С до точки кипения при давлении и температуре, указанных в Таблице. Выражается в ккал/кг.
Скрытая температура парообразования
Количество тепла в ккал/кг, необходимое для превращения одного килограмма воды при температуре кипения в килограмм пара. При конденсации одного килограмма пара в килограмм воды высвобождает такое же самое количество теплоты. Как видно из Таблицы, для каждого сочетания давления и температуры величина этой теплоты будет разной.
Полная теплота насыщенного пара
Сумма теплоты кипящей жидкости и скрытой теплоты парообразования в ккал/кг. Она соответствует полной теплоте, содержащейся в паре с температурой выше 0°С.
Как пользоваться таблицей
Кроме определения зависимости между давлением и температурой пара, Вы, также, можете вычислить количество пара, которое превратится в конденсат в любом теплообменнике, если известно передаваемое им количество теплоты в ккал. И наоборот, Таблицу можно использовать для определения количества переданной теплообменником теплоты если известен расход образующегося конденсата.
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Абсолют. Давление бар | Температ пара °C | Уд.объем пара м3/кг | Плотность пара кг/м3 | Теплота жидкости ккал/кг | Скрытая теплота парообра- зования ккал/кг | Полная теплота пара |
P | t | V | 7 | q | r | X=q+r |
0,010 | 7,0 | 129,20 | 0,007739 | 7,0 | 593,5 | 600,5 |
0,020 | 17,5 | 67,01 | 0,01492 | 17,5 | 587,6 | 605,1 |
0,030 | 24,1 | 45,67 | 0,02190 | 24,1 | 583,9 | 608,0 |
0,040 | 29,0 | 34,80 | 0,02873 | 28,9 | 581,2 | 610,1 |
0,050 | 32,9 | 28,19 | 0,03547 | 32,9 | 578,9 | 611,8 |
0,060 | 36,2 | 23,47 | 0,04212 | 36,2 | 577,0 | 613,2 |
0,070 | 39,0 | 20,53 | 0,04871 | 39,0 | 575,5 | 614,5 |
0,080 | 41,5 | 18,10 | 0,05523 | 41,5 | 574,0 | 615,5 |
0,090 | 43,8 | 16,20 | 0,06171 | 43,7 | 572,8 | 616,5 |
0,10 | 45,8 | 14,67 | 0,06814 | 45,8 | 571,8 | 617,6 |
0,20 | 60,1 | 7,650 | 0,1307 | 60,1 | 563,3 | 623,4 |
0,30 | 69,1 | 5,229 | 0,1912 | 69,1 | 558,0 | 627.1 |
0,40 | 75,9 | 3,993 | 0,2504 | 75,8 | 554,0 | 629,8 |
0,50 | 81,3 | 3,240 | 0,3086 | 81,3 | 550,7 | 632,0 |
0,60 | 86,0 | 2,732 | 0,3661 | 85,9 | 547,9 | 633,8 |
0,70 | 90,0 | 2,365 | 0,4229 | 89,9 | 545,5 | 635,4 |
0,80 | 93,5 | 2,087 | 0,4792 | 93,5 | 543,2 | 636,7 |
0,90 | 96,7 | 1,869 | 0,5350 | 96,7 | 541,2 | 637,9 |
1,00 | 99,6 | 1,694 | 0,5904 | 99,7 | 539,3 | 639,0 |
1,5 | 111,4 | 1,159 | 0,8628 | 111,5 | 531,8 | 643,3 |
2,0 | 120,2 | 0,8854 | 1,129 | 120,5 | 525,9 | 646,4 |
2,5 | 127,4 | 0,7184 | 1,392 | 127,8 | 521,0 | 648,8 |
3,0 | 133,5 | 0,6056 | 1,651 | 134,1 | 516,7 | 650,8 |
3,5 | 138,9 | 0,5240 | 1,908 | 139,5 | 512,9 | 652,4 |
4,0 | 143,6 | 0,4622 | 2,163 | 144,4 | 509,5 | 653,9 |
4,5 | 147,9 | 0,4138 | 2,417 | 148,8 | 506,3 | 655,1 |
5,0 | 151,8 | 0,3747 | 2,669 | 152,8 | 503,4 | 656,2 |
6,0 | 158,8 | 0,3155 | 3,170 | 160,1 | 498,0 | 658,1 |
7,0 | 164,9 | 0,2727 | 3,667 | 166,4 | 493,3 | 659,7 |
8,0 | 170,4 | 0,2403 | 4,162 | 172,2 | 488,8 | 661,0 |
9,0 | 175,4 | 0,2148 | 4,655 | 177,3 | 484,8 | 662,1 |
10 | 179,9 | 0,1943 | 5,147 | 182,1 | 481,0 | 663,1 |
11 | 184,1 | 0,1774 | 5,637 | 186,5 | 477,4 | 663,9 |
12 | 188,0 | 0,1632 | 6,127 | 190,7 | 473,9 | 664,6 |
13 | 191,6 | 0,1511 | 6,617 | 194,5 | 470,8 | 665,3 |
14 | 195,0 | 0,1407 | 7,106 | 198,2 | 467,7 | 665,9 |
15 | 198,3 | 0,1317 | 7,596 | 201,7 | 464,7 | 666,4 |
16 | 201,4 | 0,1237 | 8,085 | 205,1 | 461,7 | 666,8 |
17 | 204,3 | 0,1166 | 8,575 | 208,2 | 459,0 | 667,2 |
18 | 207,1 | 0,1103 | 9,065 | 211,2 | 456,3 | 667,5 |
19 | 209,8 | 0,1047 | 9,555 | 214,2 | 453,6 | 667,8 |
20 | 212,4 | 0,09954 | 10,05 | 217,0 | 451,1 | 668,1 |
25 | 223,9 | 0,07991 | 12,51 | 229,7 | 439,3 | 669,0 |
30 | 233,8 | 0,06663 | 15,01 | 240,8 | 428,5 | 669,3 |
40 | 250,3 | 0,04975 | 20,10 | 259,7 | 409,1 | 668,8 |
50 | 263,9 | 0,03943 | 25,36 | 275,7 | 391,7 | 667,4 |
60 | 275,6 | 0,03244 | 30,83 | 289,8 | 375,4 | 665,2 |
70 | 285,8 | 0,02737 | 36,53 | 302,7 | 359,7 | 662,4 |
80 | 295,0 | 0,02353 | 42,51 | 314,6 | 344,6 | 659,2 |
90 | 303,3 | 0,02050 | 48,79 | 325,7 | 329,8 | 655,5 |
100 | 311,0 | 0,01804 | 55,43 | 336,3 | 315,2 | 651,5 |
110 | 318,1 | 0,01601 | 62,48 | 346,5 | 300,6 | 647,1 |
120 | 324,7 | 0,01428 | 70,01 | 356,3 | 286,0 | 642,3 |
130 | 330,8 | 0,01280 | 78,14 | 365,9 | 271,1 | 637,0 |
140 | 336,6 | 0,01150 | 86,99 | 375,4 | 255,7 | 631,1 |
150 | 342,1 | 0,01034 | 96,71 | 384,7 | 239,9 | 624,6 |
200 | 365,7 | 0,005877 | 170,2 | 436,2 | 141,4 | 577,6 |
1 ккал = 4,186 кдж
1 кдж = 0,24 ккал
1 бар = 0,102 МПа
ПАР ВТОРИЧНОГО ВСКИПАНИЯ
Что такое пар вторичного вскипания:
Когда горячий конденсат или вода
из котла, находящиеся под определенным давлением, выпускают в пространство, где
действует меньшее давление, часть жидкости вскипает и превращается в так
называемый пар вторичного вскипания.
Почему он имеет важное значение :
Этот пар важен потому, что в нем
содержится определенное количество теплоты, которая может быть использована для
повышения экономичности работы предприятия, т.к. в противном случае она будет
безвозвратно потеряна. Однако, чтобы получить пользу от пара вторичного
вскипания, нужно знать как в каком количестве он образуется в конкретных
условиях.
Как он образуется :
Если воду нагревать при атмосферном давлении, ее
температура будет повышаться пока не достигнет 100°С – самой высокой
температуры, при которой вода может существовать при данном давлении в виде
жидкости. Дальнейшее добавление теплоты не повышает температуру воды, а
превращает ее в пар.
Теплота, поглощенная водой в
процессе повышения температуры до точки кипения, называется физической теплотой
или тепло-содержанием. Теплота, необходимая для превращения воды в пар, при
температуре точки кипения, называется скрытой теплотой парообразования.
Единицей теплоты, в общем случае, является килокалория (ккал), которая равна
количеству тепла, необходимому для повышения температуры одного килограмма воды
на 1°С при атмосферном давлении.
Однако, если воду нагревать при
давлении выше атмосферного, ее точка кипения будет выше 100°С, в силу чего
увеличится также и количество требуемой физической теплоты. Чем выше давление,
тем выше температура кипения воды и ее теплосодержание. Если давление
понижается, то теплосодержание также уменьшается и температура кипения воды
падает до температуры, соответствующей новому значению давления. Это значит,
что определенное количество физической теплоты высвобождается. Эта избыточная
теплота будет поглощаться в форме скрытой теплоты парообразования, вызывая
вскипание части воды и превращение ее в пар. Примером может служить выпуск
конденсата из конденсатоотводчика или выпуск воды из котла при продувке.
Количество образующегося при этом пара можно вычислить.
Конденсат при температуре пара 179,9
°C
и
давлении 10 бар обладает теплотой в количестве 182, 1ккал/кг. См. Колонку 5
таблицы параметров пара. Если его выпускать в атмосферу, т.е. при абсолютном
давлении 1 бар, теплосодержание конденсата сразу же упадет до 99,7 ккал/кг.
Избыток теплоты в количестве 82,3 ккал/кг вызовет вторичное вскипание части
конденсата. Величину части конденсата в %, которая превратится в пар вторичного
вскипания, определяют следующим образом :
Разделите разницу между
теплосодержанием конденсата при большем и при меньшем давлениях на величину
скрытой теплоты парообразования при меньшем давлением значении давления и
умножьте результат на 100.
Выразив это в виде формулы,
получим :
% пар вторичного вскипания
q1 = теплота конденсата при
большем значении давления до его выпуска
q2 = теплота конденсата при
меньшем значении давления, т.е. в пространстве, куда производится выпуск
r =
скрытая теплота парообразования пара при меньшем значении давления, при
котором производится выпуск конденсата
% пара вторичного вскипания =
График 1.
График 2.
Объем пара вторичного вскипания при выпуске
одного кубического метра конденсата в систему с атмосферным давлением.
Для упрощения
расчетов, на графике показано количество пара вторичного вскипания, которое
будет образовываться, если выпуск конденсата будет производится при разных
давлениях на выходе
Влияние присутствия воздуха на температуру пара
Рис. 1 поясняет, к чему приводит
присутствие воздуха в паропроводах, а в
Таблице 1 и на Графике 1 показана зависимость снижения температуры пара от
процентного содержания в нем воздуха при различных давлениях.
Влияние присутствия воздуха на теплопередачу
Воздух, обладая отличными
изоляционными свойствами, может образовать, по мере конденсации пара,
своеобразное «покрытие» на поверхностях теплопередачи и значительно
понизить ее эффективность.
При определенных условиях, даже
такое незначительное количество воздуха в паре как 0,5% по объему может
уменьшить эффективность тепло — передачи
на 50%. См. Рис.1
СО2 в газообразной
форме, образовавшись в котле и перемещаясь вместе с паром, может растворится в
конденсате, охлажденном ниже температуры пара, и образовать угольную кислоту.
Эта кислота весьма агрессивна и, в конечном итоге «проест»
трубопроводы и теплообменное оборудование. См. Рис.2. Если в систему попадает
кислород, он может вызвать питтинговую
коррозию чугунных и стальных поверхностей. См. Рис. 3.
Паровая камера со 100%
содержанием пара. Общее давление 10 бар.
Давления пара 10 бар температура пара 180°С
Рис.1. Камера, в которой
находится смесь пара и воздуха, передает только ту часть теплоты, которая
соответствует парциальному давлению пара, а не полному давлению в ее полости.
Паровая камера с содержанием
пара 90%
И воздуха 10%. Полное давление
10 бар. Давление
Пара 9 бар, температура пара 175,4°С
Таблица 1.
Снижение температуры паро-воздушной | ||||
Давление | Температура насыщ. пара | Температура паро-воздушной смеси от | ||
бар | °C | 10% | 20% | 30% |
2 | 120,2 | 116.7 | 113.0 | 110.0 |
4 | 143.6 | 140.0 | 135.5 | 131.1 |
6 | 158.8 | 154.5 | 150.3 | 145.1 |
8 | 170.4 | 165.9 | 161.3 | 155.9 |
10 | 179.9 | 175.4 | 170.4 | 165.0 |
Свойства пара
Теплофизические свойства воды и водяного пара (программа расчета)
Методические указания по очистке и контролю возвратного конденсата (РД 34.37.515-93)
точек кипения при давлении вакуума
Точка кипения вещества — это температура, при которой давление пара жидкости равно давлению, окружающему жидкость, и жидкость превращается в пар. Температура кипения жидкости варьируется в зависимости от окружающего давления.
Жидкость в частичном вакууме имеет более низкую точку кипения, чем когда жидкость находится при атмосферном давлении.
Онлайн-калькулятор точки кипения воды
Калькулятор, представленный ниже, можно использовать для расчета точки кипения воды при заданном абсолютном давлении .
Температура на выходе указывается в ° C, ° F, K и ° R.
Примечание! Давление должно находиться в пределах 0–1000 мбар, 0–14,7 фунта на кв. Дюйм, 0–760 мм рт. Ст. Или 0–30 дюймов рт. Ст.
На рисунках и в таблицах ниже показана точка кипения воды при переменном вакууме .
См. Термодинамические свойства воды и тяжелой воды при стандартных условиях.
См. Также другие свойства Water при изменяющейся температуре и давлении : Точки кипения при высоком давлении, плотность и удельный вес, динамическая и кинематическая вязкость, энтальпия и энтропия, теплота испарения, константа ионизации, pK w , нормальной и тяжелой воды, точки плавления при высоком давлении, число Прандтля, свойства в условиях равновесия газ-жидкость, давление насыщения, удельный вес, удельная теплоемкость (теплоемкость), удельный объем, теплопроводность, температуропроводность и давление пара в газе. жидкое равновесие.
Точка кипения как функция давления, выраженная как «мм рт. Ст. Ниже стандартного атмосферного давления»:
(= вакуум, например, 100 мм рт. Ст., Такой же, как [760-100] = 660 мм рт. Ст. абсолютное давление )
В таблице указана температура кипения воды при разном давлении вакуума.
Вакуум задается как абсолютное давление и давление «ниже стандартного атмосферного давления» (1 бар = 0 вакуума):
Для полного стола с вакуумом и точкой кипения воды — поверните экран!
| Абсолютное давление | Вакуум (ниже стандартного атмосферного давления) | Температура кипения воды | ||||||||
| [микроны] [мкм рт. ] | [psia] | [мбар] [100 * Па] | [дюйм рт. Ст.] | [мм рт. Ст.] [торр] | [мбар] [100 * Па] | [° C] | [° F] | |||
| 760000 | 29.92 | 14,696 | 1013,3 | 0 | 0 | 0 | 100 | 212 | ||
| 635000 | 25,00 | 12,279 | 846,6 | 4,92 | 125,0 | 167 | 96963 | 125,0 | 167 | 205 |
| 525526 | 20,69 | 10,162 | 700,6 | 9,23 | 234,4 | 313 | 90 | 194 | ||
| 500000 | 19.69 | 9,668 | 666,6 | 10,24 | 260,1 | 347 | 89 | 192 | ||
| 355092 | 13,98 | 6,866 | 473,4 | 15,94 | 176 | |||||
| 233680 | 9.200 | 4,519 | 311,5 | 20,72 | 526,3 | 702 | 70 | 158 | ||
| 200000 | 7.874 | 3,867 | 266,6 | 22,05 | 560,1 | 747 | 67 | 152 | ||
| 149352 | 5,880 | 2,888 | 199,1 | 24,04 | 610,6 | 914 | 140 | |||
| 100000 | 3,937 | 1,934 | 133,3 | 25,98 | 659,9 | 880 | 52 | 125 | ||
| 3.640 | 1,788 | 123,3 | 26,28 | 667,5 | 890 | 50 | 122 | |||
| 55118 | 2,170 | 1,066 | 73,48 | 27,75 | 704,9 | 4063 | 104 | |||
| 31750 | 1,250 | 0,614 | 42,33 | 28,67 | 728,2 | 971 | 30 | 86 | ||
| 25400 | 1.000 | 0,491 | 33,86 | 28,92 | 734,6 | 979 | 27 | 80 | ||
| 22860 | 0,900 | 0,442 | 30,48 | 29,02 | 737,1 | 983 | 76 | |||
| 20320 | 0,800 | 0,393 | 27,09 | 29,12 | 739,6 | 986 | 22 | 72 | ||
| 17780 | 0.700 | 0,344 | 23,71 | 29,22 | 742,2 | 990 | 21 | 69 | ||
| 15240 | 0,600 | 0,295 | 20,32 | 29,32 | 744,7 | 993 | 1844,7 | 993 | 64 | |
| 12700 | 0,500 | 0,246 | 16,93 | 29,42 | 747,3 | 996 | 15 | 59 | ||
| 10160 | 0.400 | 0,196 | 13,55 | 29,52 | 749,8 | 1000 | 12 | 53 | ||
| 7620 | 0,300 | 0,147 | 10,16 | 29,62 | 752,3 | 1003 | 7 45 | |||
| 4572 | 0,180 | 0,088 | 6,10 | 29,74 | 755,4 | 1007 | 0 | 32 | ||
| 2540 | 0.100 | 0,049 | 3,39 | 29,82 | 757,4 | 1009,82 | -6 | 21 | ||
| 1270 | 0,050 | 0,025 | 1,69 | 29,87 | 758,7 | 1011,51 | 6 | |||
| 1000 | 0,039 | 0,019 | 1,33 | 29,88 | 759,0 | 1011,85 | -17 | 1 | ||
| 500 | 0.020 | 0,0097 | 0,67 | 29,90 | 759,5 | 1012,53 | -24 | -12 | ||
| 300 | 0,012 | 0,0058 | 0,40 | 29,91 | 759,7 | 1012,87 29 | -21 | |||
| 254 | 0,010 | 0,0049 | 0,34 | 29,91 | 759,7 | 1012,87 | -31 | -24 | ||
| 127 | 0.005 | 0,0025 | 0,17 | 29,92 | 759,8 | 1013,04 | -37 | -35 | ||
| 100 | 0,0039 | 0,0019 | 0,13 | 29,92 | 760,0 | 1013,21 900,21 | 760,0 | 1013,21 40 | -40 | |
| 50 | 0,0020 | 0,0010 | 0,07 | 29,92 | 760,0 | 1013,21 | -46 | -50 | ||
| 25.4 | 0,0010 | 0,0005 | 0,03 | 29,919 | 759,9 | 1013,17 | -51 | -60 | ||
| 12,7 | 0,0005 | 0,00025 | 0,017 | 29.9195 | 7907 | 29.9195 | -57 | -70 | ||
| 2,54 | 0,0001 | 0,00005 | 0,003 | 29,9199 | 760,0 | 1013.20 | -68 | -90 | ||
- 0% вакуума = 760 торр = 14,7 фунта / кв. Дюйм = 29,92 дюйма абс. = 101,4 кПа абс.
- 50% вакуума = 380 торр = 7,3 фунта / кв. абс. ртути = 50,8 кПа абс.
- Вакуум 99,9% = 1 торр = 0,01934 фунт / кв. дюйм абс. = 0,03937 дюйм ртути абс. = 1,3 кПа абс.
Температура кипения воды в зависимости от давления
- Детали
- Раздел: химия
Справочные таблицы содержат значения точки кипения воды при различных давлениях (в разных единицах измерения).
Обозначения: P- давление, мбар, бар, торр. Изобразительное искусство. или атом; t — температура, ° С.
Температура кипения воды при давлении в мбар
-П | т, ° С | -П | т, ° С | -П | т, ° С |
900 | 96.7 | 960 | 98,5 | 1020 | 100,2 |
910 | 97,0 | 970 | 98,8 | 1030 | 100.5 |
920 | 97,3 | 980 | 99,1 | 1040 | 100,7 |
930 | 97,6 | 990 | 99.4 | 1050 | 101,0 |
940 | 97,9 | 1000 | 99,6 | 1060 | 101,3 |
950 | 98.2 | 1010 | 99,9 | 1070 | 101,6 |
Температура кипения воды при давлении, бар
-П | т, ° С | -П | т, ° С | -П | т, ° С |
1 | 99.7 | 15 | 198,2 | 65 | 283 |
2 | 120,3 | 16 | 201,3 | 70 | 288 |
3 | 133.4 | 17 | 204,2 | 75 | 293 |
4 | 143,5 | 18 | 207,0 | 80 | 297 |
5 | 151.7 | 19 | 210,2 | 85 | 301 |
6 | 158,7 | 20 | 212,3 | 90 | 305 |
7 | 164.8 | 25 | 224 | 95 | 309 |
8 | 170,3 | 30 | 236 | 100 | 313 |
9 | 175.2 | 35 | 244 | 110 | 320 |
10 | 179,7 | 40 | 252 | 120 | 327 |
11 | 183.8 | 45 | 259 | 130 | 333 |
12 | 187,8 | 50 | 266 | 140 | 339 |
13 | 191.5 | 55 | 272 | 150 | 344 |
14 | 195,0 | 60 | 277 | 160 | 350 |
Температура кипения воды при давлении в мм рт.Изобразительное искусство.
-П | т, ° С | -П | т, ° С | -П | т, ° С |
680 | 96,9 | 720 | 98.5 | 760 | 100,0 |
685 | 97,1 | 725 | 98,7 | 765 | 100,2 |
690 | 97.3 | 730 | 98,9 | 770 | 100,4 |
695 | 97,5 | 735 | 99,1 | 775 | 100.6 |
700 | 97,7 | 740 | 99,3 | 780 | 100,7 |
705 | 97,9 | 745 | 99.5 | 785 | 100,9 |
710 | 98,1 | 750 | 99,6 | 790 | 101,1 |
715 | 98.3 | 755 | 99,8 | 800 | 101,5 |
Температура кипения воды при давлении
-П | т, ° С | -П | т, ° С | -П | т, ° С | -П | т, ° С |
1 | 99.1 | 8 | 169,6 | 18 | 206,1 | 70 | 287 |
2 | 119,6 | 9 | 174.5 | 19 | 208,9 | 80 | 296 |
3 | 132,9 | 10 | 179,0 | 20 | 211.4 | 90 | 304 |
4 | 142,9 | 12 | 187,1 | 30 | 235 | 100 | 312 |
5 | 151.1 | 14 | 194,1 | 40 | 251 | 120 | 326 |
6 | 158,1 | 15 | 197.4 | 50 | 265 | 140 | 338 |
7 | 164,2 | 16 | 200,4 | 60 | 276 | 160 | 348 |
Калькулятор точки кипения на высоте
Этот калькулятор точки кипения на высоте поможет вам определить точку кипения воды.Неудивительно, что температура, при которой вода начинает кипеть, непостоянна и зависит от давления, которое, в свою очередь, зависит от высоты. В этой статье мы представим вам уравнение высоты точки кипения и объясним, как рассчитать точку кипения воды на любой высоте.
Какая точка кипения?
Это просто температура, при которой вода начинает кипеть, другими словами, она меняет свое состояние с жидкого на газообразное. Эта температура зависит от давления и типа вещества.Следовательно, вы можете быть уверены, что каждая проба чистой воды начнет кипеть при одинаковой температуре на заданной высоте над уровнем моря.
Температура кипения воды на уровне моря
Вам не нужно использовать наш калькулятор точки кипения на высоте, чтобы определить точку кипения воды на уровне моря. Он всегда один и тот же — 100 ° C или 212 ° F. Собственно, формула точки кипения использует это значение как основу расчетов.
Точно так же точка замерзания воды на уровне моря имеет постоянное значение — 0 ° C или 32 ° F.
Уравнение повышения точки кипения
Помните, что температура кипения воды зависит исключительно от давления. Этот калькулятор точки кипения находит давление на высоте при условии, что давление на уровне моря постоянно и равно 1013 гПа (1,013 бар). Этого приближения достаточно для такого рода расчетов. Если вы хотите получить более точные результаты, воспользуйтесь нашим калькулятором атмосферного давления на высоте.
Формулы для определения температуры кипения:
точка кипения = 49.5,2559
Обратите внимание, что в этих формулах используются определенные единицы:
- точка кипения находится в градусах Фаренгейта (° F),
- давление выражается в дюймах ртутного столба (inHg),
- Высота следует ввести в уравнение в британских единицах измерения — футах (ft).
Как рассчитать точку кипения
Предположим, вы отправились в поход в Мачу-Пикчу. Вам интересно, какой температуры вам нужно будет кипятить там воду.5,2559 = 22,25 дюйма рт. Ст.
- Теперь введите это давление в уравнение точки кипения:
точка кипения = 49,161 * ln (22,25) + 44,932 = 197,44 ° F
- Поздравляем! Теперь вы знаете температуру кипения воды в Мачу-Пикчу.
Калькулятор точки кипения
Калькулятор точки кипения
| ||||||||||||||||
Использование калькулятора
Предположим, вы собираетесь провести дистилляцию при пониженном давлении.Ты
знайте, что ваше вещество закипает при температуре 89 ° C под давлением
1 торр. К сожалению, ваша помпа не может опуститься так низко. Это может только
достичь 5 Торр вакуума. Какая будет точка кипения вашего
соединение под этим давлением? Калькулятор может помочь. Обычно три
корпусов можно выделить:
1. Вы знаете только одно значение точки кипения для вашего
вещество. В этом случае просто заполните два верхних поля
с ценностями, которые вы знаете. Теперь вы можете примерно
оценить его температуру кипения.Возьмем, к примеру, воду. Введите 760 (миллиметры
ртути, или 1013 гПа — ед.
не имеет значения) как значение давления и 100 как точка кипения.
Теперь вы можете рассчитать его температуру кипения при любом давлении. Введите 15 в
второе левое поле и 18 появится во втором правом
поле. Это ответ. Вода закипает при
18 ° C при давлении менее 15 миллиметров ртутного столба. Просто, не правда ли? Вы можете сделать обратное
расчет тоже. Вы хотите знать, какое давление необходимо для получения воды
кипятить при 50 ° C. Введите 50 во втором правом поле и
отобразится результат (89).
2. Если вам известна теплота испарения вашего вещества , вы можете
введите его в соответствующее поле. Это должно помочь получить
более точные результаты. Если вам неизвестна теплота испарения, нажмите кнопку ВЫБРАТЬ и попробуйте
выберите ваше (или подобное) соединение из списка.
3. Вы знаете как минимум две точки кипения при двух разных давлениях.
значения. Иногда их можно найти в журнале или в таблицах. Ты
тогда повезло. Нажмите кнопку КАЛИБРОВКА и заполните
форма.Теплота испарения вашего вещества будет рассчитана, когда
ВЫ ПРИНИМАЕТЕ эти данные. Это означает, что вы можете получить очень точные
результаты сейчас. Возьмем, к примеру, кротоновую кислоту: она кипит при 185 ° C и ниже 760 ° C.
мм рт. ст. (атмосферное давление) и при 80 ° C ниже 10 мм рт. Введите эти данные
в форму калибровки и примите их. Теплота испарения будет
рассчитано и отображено (55,5 кДж / моль). Вы можете оценить температуру кипения
кротоновой кислоты довольно точно сейчас.
ADVAMACS.COM — Расширенные строительные блоки
Давление пара
Почти все мы нагревали кастрюлю с водой с закрытой крышкой и вскоре после этого услышали стук крышки и проливание горячей воды на плиту. Когда жидкость нагревается, ее молекулы получают достаточную кинетическую энергию, чтобы преодолеть силы, удерживающие их в жидкости, и уходят в газовую фазу. Поступая таким образом, они генерируют совокупность молекул в паровой фазе над жидкостью, которая создает давление — давление пара. Давление, создаваемое над жидкостью молекулами жидкого вещества, которые обладают достаточной кинетической энергией, чтобы уйти в паровую фазу.жидкости. В описанной нами ситуации было создано достаточное давление, чтобы сдвинуть крышку, что позволило парам уйти. Однако, если пар содержится в запечатанном сосуде, таком как невентилируемая колба, и давление пара становится слишком высоким, колба взрывается (как, к сожалению, обнаружили многие студенты). В этом разделе мы более подробно описываем давление пара и объясняем, как количественно определить давление пара жидкости.
Испарение и конденсация
Поскольку молекулы жидкости находятся в постоянном движении, мы можем построить график доли молекул с заданной кинетической энергией ( KE ) в зависимости от их кинетической энергии, чтобы получить распределение кинетической энергии молекул в жидкости (Рисунок 11.13 «Распределение кинетических энергий молекул жидкости при двух температурах»), как и для газа (рис. 10.19 «Широкое изменение молекулярных скоростей, наблюдаемое при 298 K для газов с разными молярными массами»). Что касается газов, увеличение температуры увеличивает как среднюю кинетическую энергию частиц в жидкости, так и диапазон кинетической энергии отдельных молекул. Если мы предположим, что минимальное количество энергии ( E 0 ) необходимо для преодоления межмолекулярных сил притяжения, которые удерживают жидкость вместе, тогда некоторая часть молекул в жидкости всегда имеет кинетическую энергию больше, чем E 0 .Доля молекул с кинетической энергией, превышающей это минимальное значение, увеличивается с повышением температуры. Любая молекула с кинетической энергией более E 0 имеет достаточно энергии, чтобы преодолеть силы, удерживающие ее в жидкости, и уйти в паровую фазу. Однако, прежде чем он сможет это сделать, молекула также должна быть на поверхности жидкости, где она физически может покинуть поверхность жидкости; то есть только молекулы на поверхности могут подвергаться испарению (или испарению). Физический процесс, посредством которого атомы или молекулы в жидкой фазе переходят в газовую или паровую фазу., где молекулы получают достаточно энергии для перехода в газообразное состояние над поверхностью жидкости, тем самым создавая давление пара.
Рисунок 11.13 Распределение кинетических энергий молекул жидкости при двух температурах
Как и в случае с газами, повышение температуры смещает пик в сторону более высокой энергии и расширяет кривую. Только молекулы с кинетической энергией более E 0 могут выйти из жидкости и перейти в паровую фазу, а доля молекул с KE > E 0 тем выше при более высокой температуре.
Чтобы понять причины давления пара, рассмотрим устройство, показанное на Рисунке 11.14 «Давление пара». Когда жидкость вводится в откачанную камеру (часть (a) на рисунке 11.14 «Давление пара»), начальное давление над жидкостью приблизительно равно нулю, поскольку в паровой фазе еще нет молекул. Однако некоторые молекулы на поверхности будут обладать достаточной кинетической энергией, чтобы покинуть жидкость и образовать пар, увеличивая, таким образом, давление внутри контейнера.Пока температура жидкости поддерживается постоянной, доля молекул с KE > E 0 не изменится, а скорость, с которой молекулы уходят из жидкости в паровую фазу, будет зависеть только от площадь поверхности жидкой фазы.
Рисунок 11.14 Давление пара
(a) Когда жидкость вводится в откачанную камеру, молекулы с достаточной кинетической энергией уходят с поверхности и переходят в паровую фазу, вызывая повышение давления в камере.(b) Когда достаточное количество молекул находится в паровой фазе для данной температуры, скорость конденсации равна скорости испарения (достигается установившееся состояние), и давление в контейнере становится постоянным.
Как только образуется некоторое количество пара, часть молекул в паровой фазе сталкивается с поверхностью жидкости и снова входит в жидкую фазу в процессе, известном как конденсация — физический процесс, посредством которого атомы или молекулы в паровой фазе попадают в жидкую фазу. жидкая фаза.(часть (b) на рисунке 11.14 «Давление пара»). По мере увеличения количества молекул в паровой фазе количество столкновений между молекулами паровой фазы и поверхностью также будет увеличиваться. В конце концов, будет достигнуто стационарное состояние , в котором ровно столько молекул в единицу времени покидают поверхность жидкости (испаряются), сколько сталкиваются с ней (конденсируются). В этот момент давление над жидкостью перестает расти и остается постоянным на определенном значении, которое характерно для жидкости при данной температуре.Скорость испарения и конденсации с течением времени для такой системы, как эта, показана графически на рисунке 11.15 «Относительные скорости испарения и конденсации как функция времени после того, как жидкость попадает в герметичную камеру».
Рисунок 11.15 Относительные скорости испарения и конденсации как функция времени после того, как жидкость попала в герметичную камеру
Скорость испарения зависит только от площади поверхности жидкости и практически постоянна.Скорость конденсации зависит от количества молекул в паровой фазе и постоянно увеличивается, пока не сравняется со скоростью испарения.
Равновесное давление пара
Два противоположных процесса (например, испарение и конденсация), которые происходят с одинаковой скоростью и, таким образом, не производят чистых изменений в системе, составляют динамическое равновесие — состояние, в котором два противоположных процесса происходят с одинаковой скоростью, таким образом, не производя чистых изменений. в системе.. В случае жидкости, заключенной в камеру, молекулы непрерывно испаряются и конденсируются, но количества жидкости и пара не меняются со временем. Давление, оказываемое паром в динамическом равновесии с жидкостью, является равновесным давлением пара — давлением пара, находящегося в динамическом равновесии с жидкостью. жидкости.
Если жидкость находится в открытом контейнере , то большинство молекул, которые уходят в паровую фазу, , а не , столкнутся с поверхностью жидкости и вернутся в жидкую фазу.Вместо этого они будут диффундировать через газовую фазу от контейнера, и равновесие никогда не установится. В этих условиях жидкость будет продолжать испаряться, пока не «исчезнет». Скорость, с которой это происходит, зависит от давления пара жидкости и температуры. Летучие жидкости Жидкость с относительно высоким давлением пара. имеют относительно высокое давление пара и легко испаряются; нелетучие жидкости Жидкость с относительно низким давлением пара.имеют низкое давление пара и испаряются медленнее. Хотя разделительная линия между летучими и нелетучими жидкостями не является четкой, в качестве общего ориентира мы можем сказать, что вещества с давлением пара выше, чем у воды (Таблица 11.4 «Поверхностное натяжение, вязкость, давление пара (при 25 ° C, если только В противном случае указано) и «Нормальные точки кипения обычных жидкостей») относительно летучие, тогда как те, у которых давление пара меньше, чем у воды, относительно нелетучие. Таким образом, диэтиловый эфир (этиловый эфир), ацетон и бензин являются летучими, а ртуть, этиленгликоль и моторное масло — нелетучими.
Равновесное давление пара вещества при определенной температуре является характеристикой материала, такой как его молекулярная масса, точка плавления и точка кипения (Таблица 11.4 «Поверхностное натяжение, вязкость, давление пара (при 25 ° C, если не указано иное)» , и нормальные точки кипения обычных жидкостей »). , а не , зависит от количества жидкости, если хотя бы небольшое количество жидкости находится в равновесии с паром. Однако равновесное давление пара очень сильно зависит от температуры и присутствующих межмолекулярных сил, как показано для некоторых веществ на рисунке 11.16 «Давление паров некоторых жидкостей в зависимости от температуры». Молекулы, которые могут связывать водород, такие как этиленгликоль, имеют гораздо более низкое равновесное давление пара, чем те, которые не могут, например, октан. Нелинейное увеличение давления пара с повышением температуры на намного круче, чем увеличение давления, ожидаемое для идеального газа в соответствующем диапазоне температур. Температурная зависимость настолько сильна, потому что давление пара зависит от доли молекул, кинетическая энергия которых превышает энергию, необходимую для выхода из жидкости, и эта доля экспоненциально увеличивается с температурой.В результате запечатанные контейнеры с летучими жидкостями могут стать настоящей бомбой, если они подвергаются значительному повышению температуры. Например, бензобаки автомобилей вентилируются, чтобы автомобиль не взорвался, если он припаркован на солнце. Аналогичным образом, небольшие канистры (1–5 галлонов), используемые для перевозки бензина, по закону должны иметь выпускной клапан для сброса давления.
Рисунок 11.16. Давление паров некоторых жидкостей в зависимости от температуры
Точка, в которой кривая давления пара пересекает линию P = 1 атм (пунктирная линия), является нормальной точкой кипения жидкости.
Обратите внимание на узор
Летучие вещества имеют низкие температуры кипения и относительно слабые межмолекулярные взаимодействия; нелетучие вещества имеют высокие температуры кипения и относительно сильные межмолекулярные взаимодействия.
Экспоненциальный рост давления пара с увеличением температуры на рисунке 11.16 «Давление пара нескольких жидкостей как функция температуры» позволяет нам использовать натуральные логарифмы для выражения нелинейной зависимости как линейной.
Уравнение 11.1
ln P = −ΔHvapR (1T) + CE Уравнение для прямой: y = mx + b
где ln P — натуральный логарифм давления пара, Δ H vap — энтальпия парообразования , R — универсальная газовая постоянная [8,314 Дж / (моль · K )], T — температура в кельвинах, а C — интервал пересечения y , который является константой для любой данной линии.График ln P в зависимости от обратной абсолютной температуры (1/ T ) представляет собой прямую линию с наклоном −Δ H vap / R . Уравнение 11.1, называемое уравнением Клаузиуса-Клапейрона Линейное соотношение, которое выражает нелинейную зависимость между давлением пара жидкости и температурой: ln P = −ΔHvap / RT + C, где P — давление, ΔHvap — теплота испарения, R — универсальная газовая постоянная, T — абсолютная температура, C — постоянная.Уравнение Клаузиуса-Клапейрона можно использовать для расчета теплоты испарения жидкости по измеренному давлению пара при двух или более температурах., Можно использовать для расчета Δ H vap жидкости по измеренному давлению пара. при двух и более температурах. Самый простой способ определить Δ H vap — измерить давление пара жидкости при двух температурах и вставить значения P и T для этих точек в уравнение 11.2, полученное из уравнения Клаузиуса – Клапейрона:
Уравнение 11.2
ln (P2P1) = — ΔHvapR (1T2−1T1)
И наоборот, если мы знаем Δ H vap и давление пара P 1 при любой температуре T 1 , мы можем использовать уравнение 11.2 для расчета давления пара P 2 при любая другая температура T 2 , как показано в Примере 6.
Пример 6
Экспериментально измеренные значения давления пара жидкой Hg при четырех температурах приведены в следующей таблице:
| т (° С) | 80,0 | 100 | 120 | 140 |
| П (торр) | 0.0888 | 0,2729 | 0,7457 | 1,845 |
По этим данным рассчитайте энтальпию испарения (Δ H vap ) ртути и спрогнозируйте давление пара жидкости при 160 ° C. (Примечание по безопасности: ртуть очень токсична; при разливе из-за давления ее паров образуется опасный уровень паров ртути.)
Дано: Давление паров при четырех температурах
Запрошено: Δ H пар ртути и давление паров при 160 ° C
Стратегия:
A Используйте уравнение 11.2, чтобы получить Δ H vap непосредственно из двух пар значений в таблице, убедившись, что преобразовали все значения в соответствующие единицы.
B Подставьте вычисленное значение Δ H vap в уравнение 11.2, чтобы получить неизвестное давление ( P 2 ).
Решение:
A В таблице приведены измеренные значения давления пара жидкой Hg для четырех температур. Хотя одним из способов продолжения было бы построить график данных с использованием уравнения 11.1 и найти значение Δ H vap по наклону линии, альтернативным подходом является использование уравнения 11.2, чтобы получить Δ H vap непосредственно из двух пар значений, перечисленных в таблице, при условии отсутствия ошибок в наших измерениях. Поэтому мы выбираем два набора значений из таблицы и переводим температуры из градусов Цельсия в Кельвины, потому что уравнение требует абсолютных температур. Подстановка значений, измеренных при 80,0 ° C ( T 1 ) и 120,0 ° C ( T 2 ) в уравнение 11.2, дает
ln (0.7457 торр0,0888 торр) = — ΔHvap8,314 Дж / (моль · К) [1 (120 + 273) K − 1 (80,0 + 273) K] ln (8,398) = — ΔHvap8,314 Дж · моль − 1 · K − 1 (−2,88 × 10−4K − 1) 2,13 = −ΔHvap (−0,346 × 10−4) J − 1 · мольΔHvap = 61,400 Дж / моль = 61,4 кДж / моль
B Теперь мы можем использовать это значение Δ H vap для расчета давления пара жидкости ( P 2 ) при 160,0 ° C ( T 2 ):
ln (P20.0888 торр) = — 61 400 Дж · моль − 18.314 Дж · моль − 1 · K − 1 [1 (160 + 273) K − 1 (80,0 + 273) K] = 3,86
Используя соотношение e ln x = x , получаем
ln (P20.0888 торр) = 3,86 P20.0888 торр = e3,86 = 47,5 P2 = 4,21 торр
При 160 ° C давление пара жидкой Hg составляет 4,21 торр, что, как и следовало ожидать, значительно выше, чем давление при 80,0 ° C.
Упражнение
Давление паров жидкого никеля при 1606 ° C равно 0.100 торр, тогда как при 1805 ° C давление пара составляет 1.000 торр. При какой температуре жидкость имеет давление пара 2,500 торр?
Ответ: 1896 ° C
Точки кипения
По мере увеличения температуры жидкости давление пара жидкости увеличивается до тех пор, пока не сравняется с внешним давлением или атмосферным давлением в случае открытого контейнера. По всей жидкости начинают образовываться пузырьки пара, и жидкость начинает закипать.Температура, при которой жидкость закипает при давлении ровно 1 атм, является нормальной точкой кипения. Температура, при которой вещество закипает при давлении 1 атм. жидкости. Для воды нормальная температура кипения составляет ровно 100 ° C. Нормальные точки кипения других жидкостей на рисунке 11.16 «Давление пара некоторых жидкостей как функция температуры» представлены точками, в которых кривые давления пара пересекают линию, соответствующую давлению 1 атм. Хотя мы обычно указываем нормальную точку кипения жидкости, фактическая точка кипения зависит от давления.При давлении более 1 атм вода закипает при температуре более 100 ° C, поскольку повышенное давление заставляет молекулы пара над поверхностью конденсироваться. Следовательно, молекулы должны обладать большей кинетической энергией, чтобы покинуть поверхность. И наоборот, при давлении менее 1 атм вода кипит ниже 100 ° C.
Типичные колебания атмосферного давления на уровне моря относительно невелики, вызывая лишь незначительные изменения температуры кипения воды. Например, самое высокое зарегистрированное атмосферное давление на уровне моря составляет 813 мм рт. Ст., Зарегистрированное в течение сибирской зимы; самое низкое давление на уровне моря, когда-либо измеренное, составило 658 мм рт.ст. во время тихоокеанского тайфуна.При таком давлении температура кипения воды изменяется минимально, до 102 ° C и 96 ° C соответственно. С другой стороны, на больших высотах зависимость температуры кипения воды от давления становится значительной. В Таблице 11.5 «Точки кипения воды в различных местах на Земле» перечислены точки кипения воды в нескольких местах с разной высотой. Например, на высоте всего 5000 футов точка кипения воды уже ниже самого низкого уровня, когда-либо зарегистрированного на уровне моря.Низкая температура кипения воды имеет серьезные последствия для приготовления всего, от яиц всмятку («трехминутное яйцо» может занять четыре или более минут в Скалистых горах и даже дольше в Гималаях) до тортов (часто продаются смеси для пирогов. с отдельными высотными инструкциями). Напротив, скороварки, у которых есть уплотнение, которое позволяет давлению внутри них превышать 1 атм, используются для более быстрого приготовления пищи за счет повышения температуры кипения воды и, следовательно, температуры, при которой пища готовится.
Обратите внимание на узор
По мере увеличения давления температура кипения жидкости увеличивается и наоборот.
Таблица 11.5 Температура кипения воды в различных местах на Земле
| Место | Высота над уровнем моря (футы) | Атмосферное давление (мм рт. Ст.) | Температура кипения воды (° C) |
|---|---|---|---|
| Mt.Эверест, Непал / Тибет | 29 028 | 240 | 70 |
| Богота, Колумбия | 11 490 | 495 | 88 |
| Денвер, Колорадо | 5280 | 633 | 95 |
| Вашингтон, округ Колумбия | 25 | 759 | 100 |
| Мертвое море, Израиль / Иордания | −1312 | 799 | 101.4 |
Сводка
Поскольку молекулы жидкости находятся в постоянном движении и обладают широким диапазоном кинетических энергий, в любой момент их часть имеет достаточно энергии, чтобы вырваться с поверхности жидкости и войти в газовую или паровую фазу. Этот процесс, называемый испарением или испарением , создает давление пара над жидкостью. Молекулы в газовой фазе могут сталкиваться с поверхностью жидкости и повторно входить в жидкость посредством конденсации .В конце концов, достигается установившегося состояния , в котором количество молекул, испаряющихся и конденсирующихся в единицу времени, одинаково, и система находится в состоянии динамического равновесия . В этих условиях жидкость демонстрирует характерное равновесное давление пара , которое зависит только от температуры. Мы можем выразить нелинейную зависимость между давлением пара и температурой как линейную зависимость, используя уравнение Клаузиуса – Клапейрона .Это уравнение можно использовать для расчета энтальпии испарения жидкости по измеренному давлению пара при двух или более температурах. Летучие жидкости — это жидкости с высоким давлением пара, которые легко испаряются из открытого контейнера; нелетучие жидкости имеют низкое давление пара. Когда давление пара равно внешнему давлению, внутри жидкости образуются пузырьки пара, и она закипает. Температура, при которой вещество закипает при давлении 1 атм, равна его нормальной точке кипения .
Основные выводы
- Равновесное давление пара жидкости зависит от температуры и присутствующих межмолекулярных сил.
- Связь между давлением, энтальпией испарения и температурой дается уравнением Клаузиуса-Клапейрона.
Ключевые уравнения
Уравнение Клаузиуса – Клапейрона
Уравнение 11.1: ln P = −ΔHvapR (1T) + C
Использование давления пара при двух температурах для расчета Δ
H
vap
Уравнение 11.2: ln (P2P1) = — ΔHvapR (1T2−1T1)
Концептуальные проблемы
Какова связь между точкой кипения, давлением пара, температурой вещества и атмосферным давлением?
В чем разница между летучей жидкостью и нелетучей жидкостью? Предположим, что два жидких вещества имеют одинаковую молекулярную массу, но одно летучее, а другое нелетучее.Какие различия в молекулярных структурах этих двух веществ могут объяснить различия в летучести?
В «сказке старушек» говорится, что нанесение этанола на запястья ребенка с очень высокой температурой помогает снизить температуру, потому что кровеносные сосуды на запястьях расположены близко к коже. Есть ли научное обоснование этой рекомендации? Будет ли вода так же эффективна, как этанол?
Почему воздух над полосой травы значительно холоднее, чем над песчаным пляжем всего в нескольких футах от вас?
Если бензин находится в открытом контейнере, он часто оказывается намного холоднее, чем окружающий воздух.Объясните это наблюдение. Опишите поток тепла в систему или из нее, а также любой происходящий перенос массы. Будет ли температура запечатанной канистры с бензином выше, ниже или такой же, как у открытой канистры? Поясните свой ответ.
Какая связь между давлением пара жидкости и
- его температура?
- площадь поверхности жидкости?
- давление других газов на жидкость?
- его вязкость?
Давление паров бензола при 25 ° C составляет 12.5 кПа, тогда как давление паров уксусной кислоты составляет 2,1 кПа. Что более изменчиво? Основываясь на межмолекулярных взаимодействиях в двух жидкостях, объясните, почему уксусная кислота имеет более низкое давление пара.
Численные задачи
Ацетилен (C 2 H 2 ), который используется для промышленной сварки, транспортируется в баллонах под давлением.Давление его паров при различных температурах указано в следующей таблице. Постройте данные и используйте свой график, чтобы оценить давление паров ацетилена при 293 К. Затем используйте свой график, чтобы определить значение Δ H vap для ацетилена. Сколько энергии требуется для испарения 2,00 г ацетилена при 250 К?
т
(К)145 155 175 200 225 250 300 П
(мм рт. Ст.)1.3 7,8 32,2 190 579 1370 5093 В следующей таблице указано давление пара воды при различных температурах.Постройте данные и используйте свой график, чтобы оценить давление пара воды при 25 ° C и 75 ° C. Какое давление пара у воды при 110 ° C? Используйте эти данные, чтобы определить значение Δ H vap для воды.
т
(° С)0 10 30 50 60 80 100 П
(мм рт. Ст.)4.6 9,2 31,8 92,6 150 355 760 Δ H vap тетрахлорметана равно 29.8 кДж / моль, а его нормальная температура кипения составляет 76,8 ° C. Какова его температура кипения при 0,100 атм?
Нормальная температура кипения натрия составляет 883 ° C. Если Δ H vap составляет 97,4 кДж / моль, каково давление пара (в миллиметрах ртутного столба) жидкого натрия при 300 ° C?
Если давление пара жидкости равно 0.850 атм при 20 ° C и 0,897 атм при 25 ° C, какова нормальная температура кипения жидкости?
Если давление пара жидкости составляет 0,799 атм при 99,0 ° C и 0,842 атм при 111 ° C, какова нормальная точка кипения жидкости?
Давление паров жидкости SO 2 равно 33.4 торр при -63,4 ° C и 100,0 торр при -47,7 К.
- Что такое Δ H vap SO 2 ?
- Каково давление его пара при −24,5 К?
- При какой температуре давление пара равно 220 торр?
Давление паров CO 2 при различных температурах приведено в следующей таблице:
т
(° С)-120 -110 −100 −90 П
(торр)9.81 34,63 104,81 279,5 - Что такое Δ H vap в этом диапазоне температур?
- Какое давление паров CO 2 при −70 ° C?
- При какой температуре CO 2 имеет давление пара 310 торр?
ответы
Давление паров
при 273 К составляет 3050 мм рт. Δ H пар = 18.7 кДж / моль, 1,44 кДж
Δ H пар = 28,9 кДж / моль, n -гексан
Δ H пар = 7.81 кДж / моль, 36 ° C
Давление пара — обзор
Перенос загрязняющих веществ в атмосферу
Давление пара — это давление пара в замкнутом пространстве. 5 Термин «испарение» часто используется как синоним давления пара, но на самом деле это переход жидкости или твердого вещества в паровую фазу.Улетучивание является функцией концентрации загрязнителя в растворе и парциального давления загрязнителя. То есть пропорциональность между растворимостью и давлением пара может быть установлена для любого химического вещества. Это означает, что улетучивание — это обычное средство, с помощью которого загрязнитель воздуха достигает атмосферы. Закон Генри выражает эту пропорциональность, то есть утверждает, что концентрация растворенного газа прямо пропорциональна парциальному давлению этого газа над раствором [7]:
(5.4) pa = KH [c]
, где K H = постоянная закона Генри; p a = парциальное давление газа; [ c ] = молярная концентрация газа.
Если вещество улетучивается из воды, соотношение закона Генри можно переформулировать следующим образом:
(5.5) pA = KHCW
, где C W — концентрация газа в воде.
Хороший способ оценить вероятность перемещения химического вещества в атмосферу — объединить концентрацию растворенного загрязнителя и его парциальное давление в воздухе непосредственно над местом нахождения химического вещества, то есть над свободным пространством, когда концентрации в обоих местоположения находятся в равновесии.Во многих ситуациях свободное пространство на самом деле является открытой атмосферой.
Эти отношения в состоянии равновесия известны как разделение. Значения распределения рассчитываются и публикуются, чтобы дать относительное сродство к химическим соединениям к воздуху по сравнению с сродством к другим веществам, например, воде, почве, ткани и т. Д. Безразмерная версия K H разбиения аналогична сорбции, за исключением того, что вместо разделения между твердой и водной фазами она находится между воздушной и водной фазами ( K AW ):
(5.6) KAW = CACW
, где C A — концентрация газа A в воздухе.
Нередко закон Генри и коэффициенты разделения воздух / вода используются как взаимозаменяемые. Однако соотношение между K AW и K H для вещества составляет:
(5,7) KAW = KHRT
, где R — газовая постоянная (8,21 × 10 −2 л атм моль −1 ° K −1 ) и T — температура (° K).
Соотношения закона Генри часто предпочтительнее, чем давление пара, потому что первое учитывает как парциальное давление, так и растворимость вещества, тогда как давление пара просто отражает парциальное давление. Соотношения закона Генри, таким образом, важны для большинства экологических соображений, например, представляя ограничивающий фактор для систем, в которых парциальное давление вещества приближается к нулю. При очень высоких парциальных давлениях (например, 30 Па) или при очень высоких концентрациях загрязняющих веществ (например,g.,> 1000 ppm), предположения закона Генри не могут быть выполнены. Такое давление и концентрация паров редко наблюдаются в условиях окружающей среды, но могут наблюдаться в ситуациях, связанных с промышленными и другими источниками. Таким образом, при моделировании и оценке тенденции к выделению вещества в виде пара, закон Генри и коэффициенты разделения воздух / вода являются полезными показателями и часто используются в моделях компартментного переноса для определения летучести из воды в атмосферу.
Константы закона Генри сильно зависят от температуры, потому что и давление пара, и растворимость зависят от температуры.Таким образом, приложение опубликованных данных K H требует изотермического (при постоянной температуре) сравнения. Поскольку температурная зависимость является нелинейной, идеальная база данных должна включать значения K H во всем температурном диапазоне, представляющем интерес для создаваемой базы знаний [28] (например, очень разные для общих условий окружающей среды, чем для проектирования реактор). Кроме того, комбинации различных коэффициентов разделения в модели или исследовании требуют либо исключительного использования значений, полученных при одной и той же температуре (например,g., сорбция, растворимость и улетучивание при 20 ° C) или нормализация и корректировка всех коэффициентов.
Ряд баз данных предоставляет физико-химическую информацию, включая коэффициенты разделения. Некоторые из них приведены в Приложении 1.
Что касается границы раздела между воздухом и водой, сорбированная или иным образом связанная фракция загрязнителя не будет оказывать парциальное давление, поэтому эту фракцию не следует включать в расчеты разделения воды и воздуха.Например, важно различать массу загрязняющего вещества в растворе (доступно для расчета K AW ) и во взвешенных твердых частицах (недоступно для расчета K AW ). Для многих гидрофобных органических загрязнителей некоторая часть массы соединения, вероятно, не будет растворена в водном столбе (за исключением сорастворенных веществ), при этом наибольшая массовая доля в водном столбе сорбируется на частицы.
Связь между K H и разделением между водой и липидами (выражается как коэффициент распределения октанол-вода, K ow ) — еще одно экологически важное явление. Например, организмы содержат в тканях различные пропорции воды и жиров. Это означает, что соотношение может использоваться для оценки стойкости в окружающей среде, что отражается в периоде полураспада химического вещества ( т 1/2 ) загрязнителя.Однако многие другие переменные определяют фактическую стойкость соединения после его высвобождения. Например, соединения бензол и хлороформ имеют почти идентичные значения: K H и K ow , но бензол гораздо менее стойкий в окружающей среде.
Однако, имея в виду эти предостережения, относительное сродство вещества к пребыванию в воздухе и воде можно использовать для оценки способности вещества разделяться не только между водой и воздухом, но и в более общем плане между атмосферой и биосферой, особенно при рассмотрении переноса загрязняющих веществ на большие расстояния (например,г., через континенты и океаны). В таких оценках переноса на большие расстояния используются как атмосферные т 1/2 , так и K H . Кроме того, взаимосвязь между коэффициентами октанол-вода и воздух-вода может быть важной частью прогнозирования переноса загрязняющих веществ. Например, на рис. 5.8 представлены некоторые общие классификации согласно отношениям различных веществ K AW и K ow .В общем, химические вещества в верхней левой группе имеют большое сродство с атмосферой, поэтому, если нет противоречащих факторов, их можно искать здесь. И наоборот, вещества с относительно низкими значениями K AW и K ow с меньшей вероятностью будут переноситься по воздуху на большие расстояния. Поскольку K AW пропорционально K H , , эти группировки также применимы к константам закона Генри.
Рисунок 5.8. Взаимосвязь между разделением воздух-вода и разделением октанол-вода и сродством классов загрязнителей к определенным средам окружающей среды при стандартных условиях окружающей среды.
От кого: van de Meent D, McKone T, Parkerton T, Matthies M, Scheringer M, Wania F и др. Стойкость и транспортный потенциал химических веществ в мультимедийной среде. Британская Колумбия, Канада: Мастерская SETAC в Пеллстоне, Фэрмаунт Хот Спрингс; 1998. с. 14–8.
МЕТОДОВ РАСЧЕТА ТЕМПЕРАТУРЫ КИПЕНИЯ ВОДЫ ПРИ РАЗЛИЧНЫХ ДАВЛЕНИЯХ на JSTOR
Abstract
Abstract Кипение — это крайняя форма испарения, которая возникает, когда давление насыщенного пара равно общему атмосферному давлению.В этой статье вычисляется температура кипения четырьмя различными методами и сравниваются результаты с данными, приведенными в CRC Handbook of Physics and Chemistry. Первый метод использует постоянное значение скрытой теплоты парообразования (lυ) в уравнении Клаузиуса-Клапейрона, а второй метод использует ранее опубликованную зависящую от температуры линейную функцию для lυ. Предлагается третий метод, который начинается с получения новой функции второго порядка для lυ, а затем применяется эта функция в цикле уменьшения ошибок для определения температуры кипения как функции давления.Этот метод расчета температуры кипения показывает среднее отклонение 0,31 ° C между средним давлением на уровне моря и 100 гПа и среднюю ошибку менее десятой доли процента, что является значительным улучшением по сравнению с обоими первыми двумя методами. Четвертый метод использует полином пятого порядка, исключая lυ и делая давление независимой переменной, которая используется для вычисления температуры кипения со средним смещением 0,25 ° C и средней ошибкой 0,09% для давлений между средним давлением на уровне моря и 100 ° C. гПа.
Информация о журнале
Бюллетень Американского метеорологического общества (BAMS) является ведущим журналом AMS и публикует статьи, представляющие интерес и значение для сообщества по погоде, воде и климату, а также новости, редакционные статьи и обзоры для членов AMS.
Информация для издателей
Основанное в 1919 году Американское метеорологическое общество (AMS) является ведущей национальной научной и профессиональной организацией, продвигающей и распространяющей информацию об атмосферных, океанических и гидрологических науках.В число наших более 13 000 членов входят ученые, исследователи, преподаватели, метеорологи, студенты, энтузиасты погоды и другие профессионалы в области погоды, воды и климата.
AMS — это некоммерческая членская организация 501 (c) 3 со штаб-квартирой в историческом доме Харрисона Грея Отиса в районе Бикон-Хилл в Бостоне. У нас также есть офис в Вашингтоне, округ Колумбия, где мы проводим наши образовательные и политические программы.
AMS стремится усилить невероятную работу, проводимую в государственном, частном и академическом секторах.Наше сообщество знает, что сотрудничество и обмен информацией имеют решающее значение для обеспечения того, чтобы общество извлекало выгоду из лучших, самых современных научных знаний и понимания.
.

 01
01 88
88 ст. = mmHg
ст. = mmHg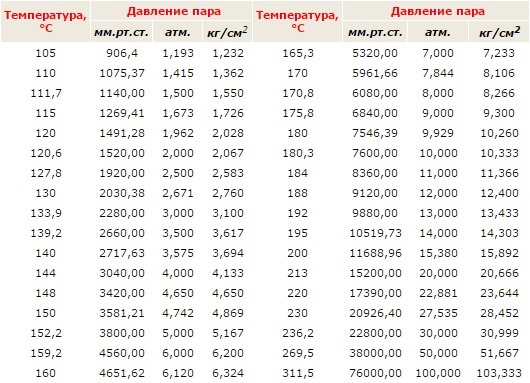 379
379 344
344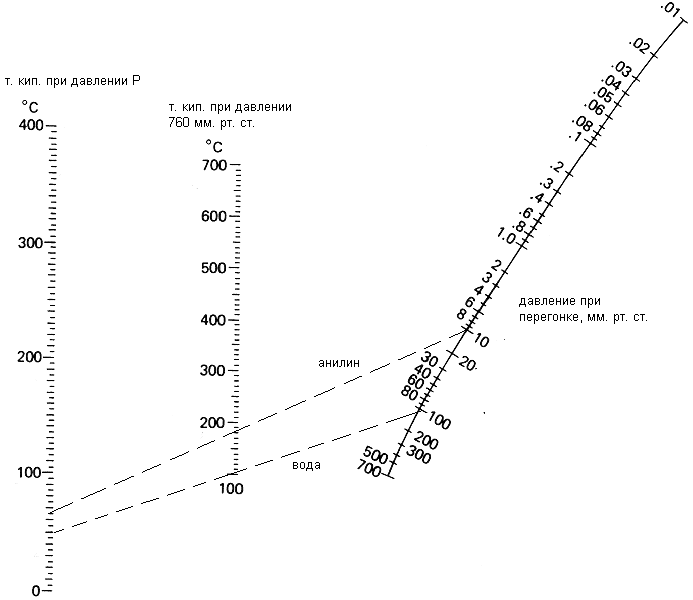 309
309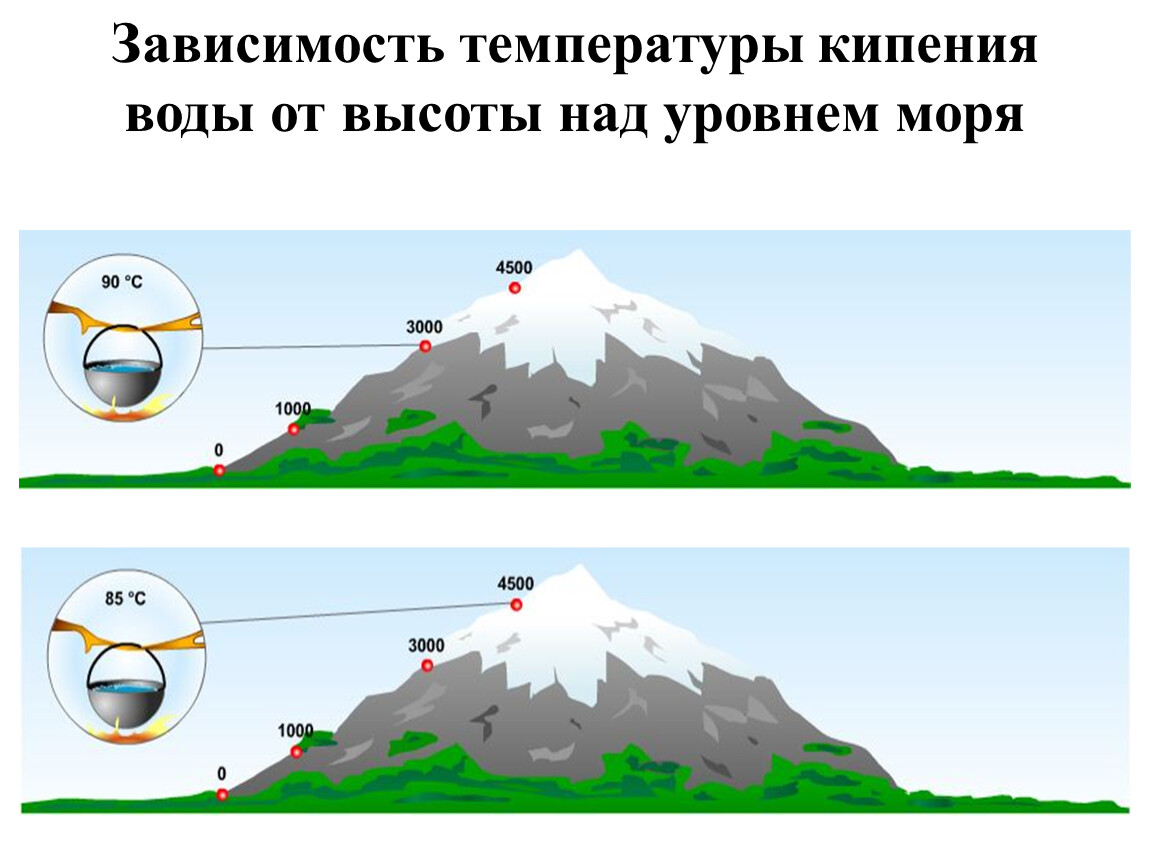 826
826 792
792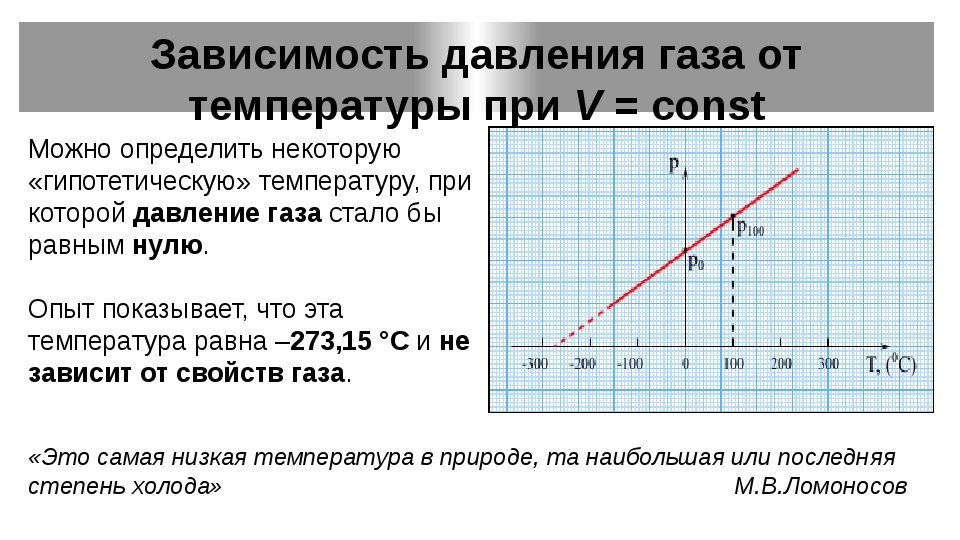 757
757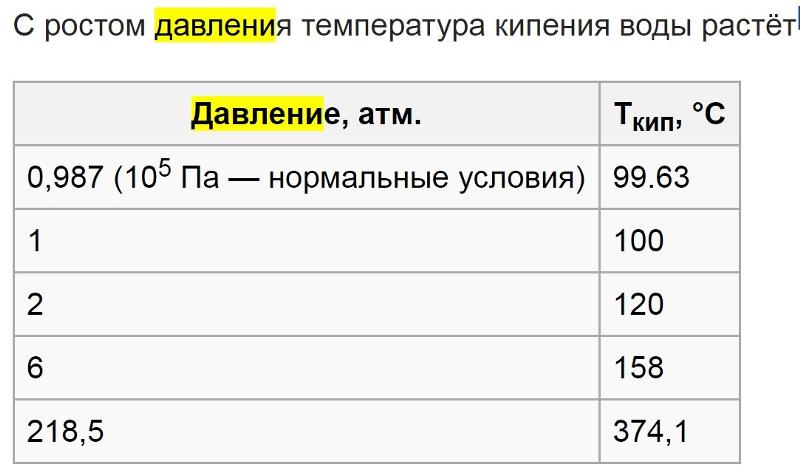 ст. = mmHg
ст. = mmHg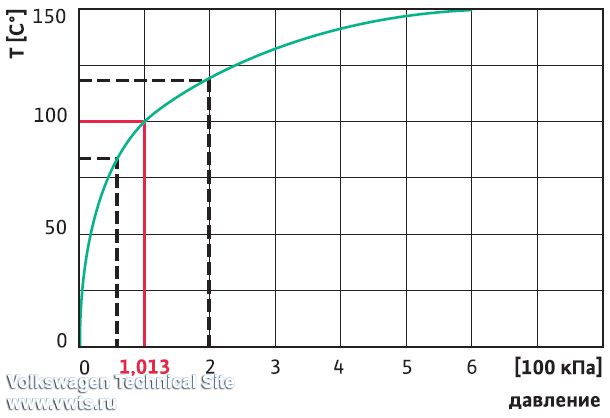 96
96 03
03 09
09 ст. = mmHg
ст. = mmHg 05
05 9
9 Введите свой запрос:
Введите свой запрос: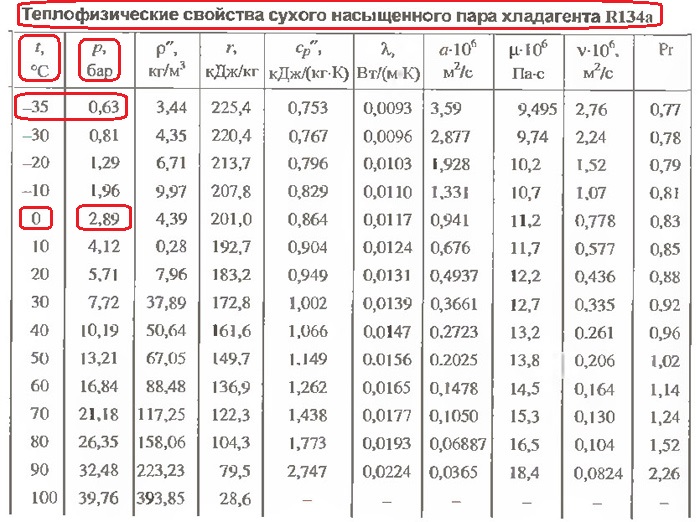 7- 310°C, 0,01-100 кгс/см2
7- 310°C, 0,01-100 кгс/см2 1
1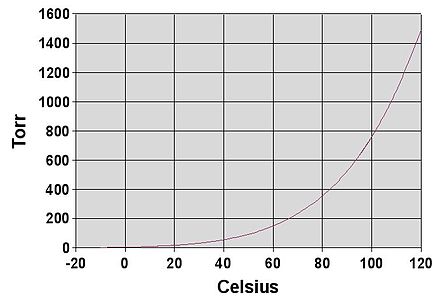 0
0