Электролит это: Электролит – кратко о соединениях с примерами
Содержание
Электролит: основа свинцово-кислотных автомобильных аккумуляторов
В качестве стартерных батарей в автотранспорте используются свинцово-кислотные аккумуляторы. Функционирование аккумулятора обеспечивается специальным раствором серной кислоты — электролитом. О том, что такое аккумуляторный электролит, каких типов он бывает, и как его использовать — читайте в статье.
Что такое электролит?
Аккумуляторный электролит — водный раствор серной кислоты, предназначенный для использования в свинцово-кислотных аккумуляторных батареях (АКБ). Электролит готовится путем растворения концентрированной серной кислоты в дистиллированной воде, молекулы кислоты в данном растворе диссоциируют (распадаются) на ионы — это явление наделяет электролит электропроводящими свойствами.
Аккумуляторный электролит имеет следующее назначение:
- Изготовление аккумуляторных батарей;
- Ввод в эксплуатацию сухозаряженных батарей;
- Восстановление АКБ при загрязнении или утечке электролита, коротких замыканиях между пластинами и других неисправностях.

Но прежде, чем применять электролит для той или иной цели, необходимо разобраться в его характеристиках и особенностях применения.
Зачем в аккумуляторе электролит?
Электролит, свинцовые пластины и пористый диоксид свинца (PbO2) — три основных компонента свинцово-кислотного аккумулятора. Именно в присутствии кислотного электролита протекают электрохимические реакции, делающие возможным накопление и отдачу аккумулятором электрического заряда.
Во время разряда АКБ металлический свинец и оксид свинца вступают в реакцию с серной кислотой (точнее — с ее отрицательными ионами SO4 и положительными ионами H), образуя сульфат свинца (PbSO4) и воду, при этом на анодных пластинах выделяются избыточные электроны. На катодных пластинах, напротив, наблюдается недостаток электронов, благодаря этому при замыкании анода и катода между ними возникает электрический ток. Во время заряда АКБ проходят обратные реакции — под действием тока от стороннего источника из сульфата свинца образуются чистый свинец, диоксид свинца и кислота.
В ходе данных реакций количество серной кислоты и воды в электролите изменяется, что приводит к изменению его плотности и объема. При разряде АКБ концентрация кислоты понижается, а концентрация воды немного увеличивается, что приводит к падению плотности и к некоторому увеличению объема электролита. В процессе заряда плотность повышается, а объем несколько понижается.
Типы и характеристики электролитов
Электролит изготавливается смешиванием концентрированной серной кислоты и дистиллированной воды в строго определенных пропорциях. Для изготовления электролита используется специальная аккумуляторная серная кислота (по ГОСТ 667-73) и дистиллированная вода (по ГОСТ 6709-72). Данный раствор используется во всех типах современных свинцово-кислотных аккумуляторов.
Главная характеристика электролита — плотность. Для нормальной работы АКБ плотность электролита должна лежать в пределах 1,23-1,4 г/куб. см, так как именно при такой плотности раствор имеет максимальную электропроводность. Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой.
Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой.
Плотность электролита в значительной степени зависит от двух параметров: температуры и степени заряда аккумулятора.
О зависимости плотности электролита в зависимости от заряда АКБ мы сказали выше: при заряде плотность повышается, при разряде — понижается. Зависимость плотности электролита от температуры простая: при снижении температуры плотность падает, при повышении — возрастает. Поэтому нормальная плотность определяет при температуре +25°C, а чтобы верно измерять плотность при любой температуре, используют таблицу поправок к показаниям ареометра:
| Температура электролита, °C | Поправка к показаниям ареометра, г/куб. см |
|---|---|
| -55 … -41 | -0,05 |
| -40 … -26 | -0,04 |
| -25 … -11 | -0,03 |
| -10 … +4 | -0,02 |
| +5 … +19 | -0,01 |
| +20 … +30 | 0 |
| +31 … +45 | +0,01 |
| +46 … +60 | +0,02 |
Например, если электролит при температуре +25°C имеет плотность 1,28 г/куб. см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см.
см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см.
Чтобы компенсировать изменение плотности электролита в АКБ транспортных средств, эксплуатируемых в различных климатических поясах, применяются электролиты большей или меньшей плотности:
- Летние и для жаркого климата — плотностью 1,23-1,24 г/куб.см;
- Для умеренного и холодного климата — 1,27-1,28 г/куб.см;
- Зимние и для холодного климата — 1,3-1,34 г/куб.см.
Кроме того, при повышении плотности электролита повышается его морозоустойчивость — более плотные электролиты устойчивы к замерзанию, поэтому они лучше подходят для эксплуатации в холодное время года и в холодных климатических поясах.
Сегодня можно купить электролит необходимой плотности, освободив себя от непростой процедуры приготовления правильного по характеристикам электролита из кислоты и воды. Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем.
Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем.
Использование аккумуляторного электролита
Сразу нужно отметить, что электролит не используется для текущего обслуживания аккумулятора. Наиболее часто в АКБ снижается уровень электролита и падает его уровень, в этом случае обслуживание выполняется добавлением воды. Дело в том, что в процессе работы аккумулятора из электролита испаряется вода, а кислота остается на месте. Также потеря воды может возникать в случае перезаряда аккумулятора — при достижении определенной плотности концентрация серной кислоты в электролите снижается и ее уже не хватает для нормального протекания указанных выше электролитических реакций. В этих условиях начинается процесс электрохимического разложения воды на водород и кислород — это проявляется «кипением» электролита, а образовавшиеся газы улетучиваются. В обоих случаях — при испарении и разложении воды — плотность электролита повышается, для ее восстановления необходимо использовать воду.
Наиболее часто электролит применяется для восстановления работы аккумулятора в случае замерзания электролита с последующей потерей его характеристик. Если электролит в АКБ замерз, то, прежде всего, необходимо занести его в теплое помещение и дождаться оттаивания. После этого аккумулятор следует поставить на зарядку с малым током — рекомендуется ток около 1 ампера и срок зарядки до 2 суток. В ходе зарядки нужно измерять плотность электролита, если она начнет повышаться, то его можно нормально зарядить и эксплуатировать.
Если же ни при каких условиях плотность не повышается, то следует произвести замену электролита. Это выполняется следующим образом:
- Слить электролит из всех банок батареи;
- Промыть банки дистиллированной водой;
- Добавить новый электролит до указанного уровня;
- Оставить аккумулятор на 2-3 часа для пропитки пластин электролитов;
- Зарядить АКБ малым током 0,5-1 ампер в течение 2 суток.
Зарядку следует остановить, когда плотность электролита и напряжение на клеммах будут стабильными в течение хотя бы двух часов.
Но если замерзание аккумулятора вызвало деформацию или разрушение пластин, то менять электролит уже бесполезно — нужно покупать новую батарею.
Аналогично устраняются и другие проблемы с аккумулятором — утечка или загрязнение электролита, ремонт АКБ после короткого замыкания и т.д. Но в этих случаях прежде нужно проверить аккумулятор на целостность и ремонтопригодность, при обнаружении трещин и других физических повреждений батарея ремонту не подлежит, ее нужно утилизировать.
Особый случай — ввод в эксплуатацию сухозаряженных аккумуляторов, которые поставляются без электролита. Обычно для подготовки такого аккумулятора его нужно заполнить электролитом и дождаться достижения необходимой плотности — все эти действия обязательно прописаны в инструкции к аккумулятору. Предварительную зарядку сухозаряженного АКБ проводить не нужно!
Во всех случаях необходимо правильно рассчитывать объем электролита, чтобы сделать правильную покупку. Объем электролита в АКБ зависит от его напряжения и электрической емкости. Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки.
Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки.
ЭЛЕКТРОЛИТ — это… Что такое ЭЛЕКТРОЛИТ?
электролит — электролит … Орфографический словарь-справочник
ЭЛЕКТРОЛИТ — (греч.). Жидкое тело, разлагаемое при помощи электрического (гальванического) тока. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭЛЕКТРОЛИТ Жидкость, подверженная разложению посредством гальванического тока.… … Словарь иностранных слов русского языка
электролит — а, м. électrolyte m. < électro + гр. lytos разлагаемый. спец. Химическое вещество (в расплаве или растворе), способное разлагаться на составные части при прохождении через него электрического тока.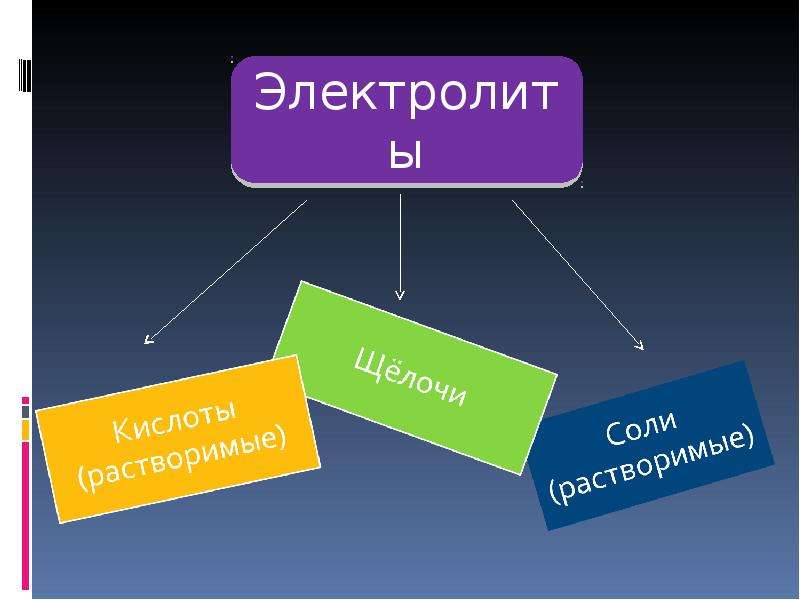 Электролит аккумулятора. БАС 1. Швыряло… … Исторический словарь галлицизмов русского языка
Электролит аккумулятора. БАС 1. Швыряло… … Исторический словарь галлицизмов русского языка
электролит — Раствор, в котором при прохождении через него электрического тока происходит разложение вещества, которое приводит к появлению электрического тока. Электролит является основой аккумуляторов и батарей. [Гипертекстовый энциклопедический словарь по… … Справочник технического переводчика
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, электролита, муж. (от слова электрический и греч. lytos растворенный) (физ.). Раствор какого нибудь вещества, способного разлагаться на составные части при электролизе. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
электролит — сущ., кол во синонимов: 1 • католит (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Электролит — Электролитами называют вещества, растворы и сплавыкоторых с другими веществами электролитически проводят гальваническийток. Признаком электролитической проводимости в отличие от металлическойдолжно считать возможность наблюдать химическое… … Энциклопедия Брокгауза и Ефрона
Признаком электролитической проводимости в отличие от металлическойдолжно считать возможность наблюдать химическое… … Энциклопедия Брокгауза и Ефрона
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ЭЛЕКТРОЛИТ — вещество, водный раствор или расплав которого проводит электрический ток (см.), образующимися в результате электролитической (см.). Этим Э., называемые также (см.) второго рода, отличаются от металлов (проводников первого рода), в которых перенос … Большая политехническая энциклопедия
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Электролиты – это важно!
Уважаемые коневладельцы!
Лето обещает быть жарким, позаботьтесь о своих лошадях и не забудьте про электролиты!
Что такое электролиты?
Электролиты — это минеральные вещества (натрий, хлор, калий, кальций, магний) необходимые для регуляции водно-солевого обмена и кислотно-щелочного баланса, передачи нервных и мышечных импульсов, а так же полноценного транспорта питательных веществ. Недостаточность электролитов может привести к снижению работоспособности, обезвоживанию, мышечным судорогам и/или тепловому удару.
Недостаточность электролитов может привести к снижению работоспособности, обезвоживанию, мышечным судорогам и/или тепловому удару.
Зачем нужны электролиты?
Электролиты необходимы при длительных нагрузках, когда пот выделяется часами и параллельно восполняются потери воды. Это длительная работа, особенно в жаркую погоду, пробеги или перевозка, когда лошадь сильно потеет от стресса или духоты или комплекса факторов. Связано это с тем, что с потом теряются соли, а вода в достаточном объеме выпивается пресная. У лошадей, работающих периодически или короткое время, ионы, теряемые с потом, легко восполняются обычным кормом, с этим здоровый организм справляется сам за счет внутренних резервов. Однако, лошади, работающие (а значит и потеющие) несколько дней в неделю, и подверженные высоким и длительным нагрузкам во время соревнований, могут развить хронический дефицит электролитов, поскольку их содержание в корме может быть не достаточно высоким для компенсации таких больших потерь. Лошади, находящиеся в процессе интенсивной тренировки, излишне возбудимые или страдающие заболеваниями, сопровождающимися большими потерями жидкости (при поносах, например), могут терять электролиты очень быстро (от 10 до 15 литров пота в час), а резкое снижение содержания электролитов может вызвать мышечные проблемы и тепловой удар.
Лошади, находящиеся в процессе интенсивной тренировки, излишне возбудимые или страдающие заболеваниями, сопровождающимися большими потерями жидкости (при поносах, например), могут терять электролиты очень быстро (от 10 до 15 литров пота в час), а резкое снижение содержания электролитов может вызвать мышечные проблемы и тепловой удар.
Много и мало – плохо!
Опасен как недостаток, так и избыток электролитов. Необоснованное введение чрезмерного количества электролитов, без учета общего содержания минералов в составе кормов и индивидуальных особенностей лошади, может привести к нарушению минерального баланса. Нужно периодически делать биохимический анализ крови и смотреть баланс по основным элементам Ca, K, Na, Mg (это основные электролиты, с потом в основном теряются именно они) и корректировать рацион, если есть заметные отклонения.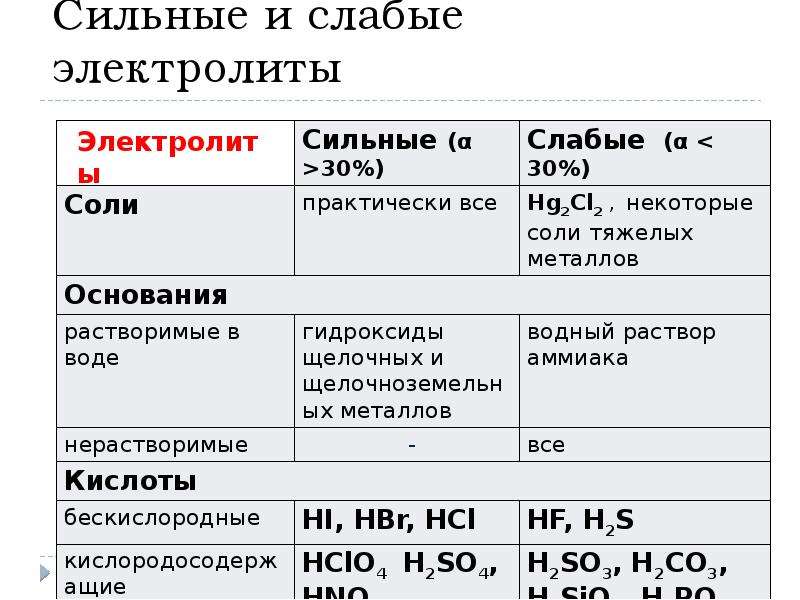
Добавки с электролитами должны даваться не как большинство витаминно-минеральных добавок — курсами или постоянно — а только в тот период, когда лошади действительно необходимо дополнительное введение электролитов. Например: ваша лошадь готовится к выступлениям (активно потея) — вы начинаете давать ей добавку с электролитами (согласно рекомендациям производителя), вдруг случилось несчастье и она захромала и вы вынуждены шагать или перевести ее на легкую работу. Добавку с электролитами следует из рациона тут же исключить, даже если вы ее давали всего несколько дней. Т.е. это не та добавка, которая может включаться в рацион «впрок» или для профилактики. Помните, что электролиты нельзя «накопить про запас» в организме лошади, излишки электролитов выводятся с мочой.
Электролитно-солевой баланс
Чтобы правильно поддерживать электролитный баланс, нужно в первую очередь обеспечить потребность лошади в электролитах без нагрузки и в комфортной температуре окружающей среды.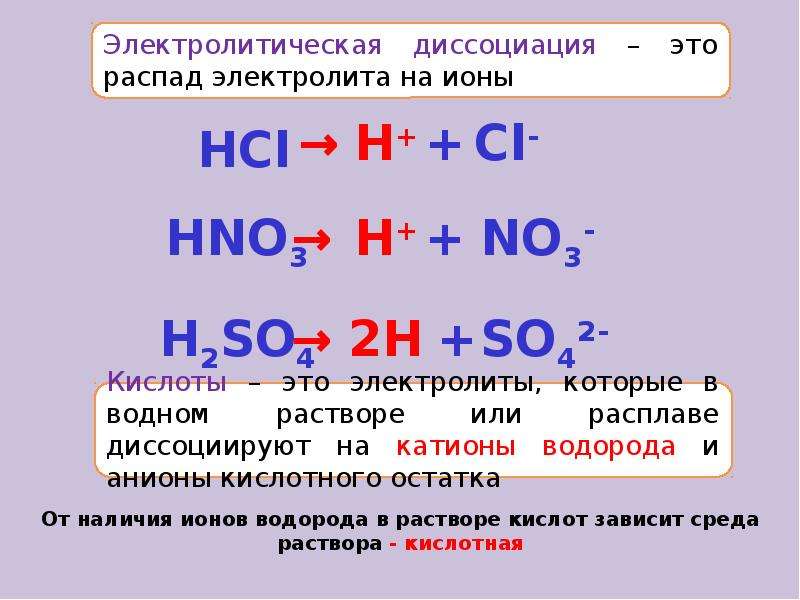 Для среднестатистической лошади это означает примерно 30 грамм соли (2 столовых ложки с горкой) в день. Это ежедневное количество соли необходимо лошади в течение всего года, даже в самые холодные зимние месяцы. У лошади всегда должен быть доступ к соли. Иногда рекомендуется разбивать соль на более мелкие куски и класть их в кормушку для овса. Плоский кусок белой соли тоже может быть полезен, но многие лошади не употребляют ее в таком виде в достаточной мере. Если ваша лошадь работает несколько часов подряд, вы можете добавить в ее рацион подкормку с электролитами, но она должна предлагаться вдобавок к соли, чтобы восполнить потери лошади при потении.
Для среднестатистической лошади это означает примерно 30 грамм соли (2 столовых ложки с горкой) в день. Это ежедневное количество соли необходимо лошади в течение всего года, даже в самые холодные зимние месяцы. У лошади всегда должен быть доступ к соли. Иногда рекомендуется разбивать соль на более мелкие куски и класть их в кормушку для овса. Плоский кусок белой соли тоже может быть полезен, но многие лошади не употребляют ее в таком виде в достаточной мере. Если ваша лошадь работает несколько часов подряд, вы можете добавить в ее рацион подкормку с электролитами, но она должна предлагаться вдобавок к соли, чтобы восполнить потери лошади при потении.
Как давать электролиты?
Не давайте электролиты лошади, которая уже обезвожена. Высокая концентрация электролита в кишечнике приведет к тому, что вода начнет извлекаться из крови, тем самым еще больше повышая обезвоживание организма. Если погода жаркая, не дожидайтесь признаков обезвоживания, начинайте давать электролиты еще до того, как нужда в них будет заметна. Пищевые добавки лучше давать часто и понемногу, а не за один-два приема. По возможности, дайте лошади доступ к воде и электролитам каждые два часа. Порошок электролитов можно примешивать к воде или давать с яблочным пюре, используя 60-кубовый шприц с отрезанным носиком. Или подмешайте электролиты к «каше», которой вы кормите лошадь. Если вы даете лошади жидко разбавленную смесь с добавлением электролитов, убедитесь, что за час до приема пищи и через час после него лошадь выпила такое же количество воды. Кроме того, если электролиты даются без достаточного количества воды (около 15 литров), высокая концентрация ионов может «оттянуть» воду к желудку, забрав ее из крови, что еще сильнее обезводит лошадь.
Пищевые добавки лучше давать часто и понемногу, а не за один-два приема. По возможности, дайте лошади доступ к воде и электролитам каждые два часа. Порошок электролитов можно примешивать к воде или давать с яблочным пюре, используя 60-кубовый шприц с отрезанным носиком. Или подмешайте электролиты к «каше», которой вы кормите лошадь. Если вы даете лошади жидко разбавленную смесь с добавлением электролитов, убедитесь, что за час до приема пищи и через час после него лошадь выпила такое же количество воды. Кроме того, если электролиты даются без достаточного количества воды (около 15 литров), высокая концентрация ионов может «оттянуть» воду к желудку, забрав ее из крови, что еще сильнее обезводит лошадь.
Прием электролитов помогает восстановить объем клеток и плазмы, и тем самым помогает охлаждению и сокращает работу сердца, требуемую для поддержания высокого объема крови. Если лошадь не получает достаточного количества воды во время приема электролитов, к кишечнику поступает меньше крови для его нормального функционирования, это приводит к проблемам с пищеварением и коликам.
Какие бывают электролиты?
Электролиты бывают разные по составу и концентрации солей в них. Сухие (в виде порошка), как правило, требуют последующего растворения в воде или же обязательного контроля за потреблением воды во время их приема. Жидкие – быстрее всасываются, не требуют предварительной подготовки, но имеют меньший срок хранения. Порошок хорошо подойдет для ежедневного введения в зависимости от нагрузки: легкая – даете постоянно и по чуть-чуть, увеличивается интенсивность нагрузок – увеличиваете дозу на этот период. Жидкие хороши во время стартов. Например, лошадь прыгает два гита и в перерыве между ними ее надо «взбодрить», восполнить запас того, что потеряно с потом за первый гит. Вот тут и помогут жидкие электролиты — их не нужно ни подмешивать в корм, ни разводить в воде. Дайте лошади дозу электролита за один-два часа до соревнования (или пробега), чтобы создать запас влаги в кишечнике.
Регулярное возмещение потерь электролитов, особенно в послесоревновательный период, жизненно важно для здоровья лошадей и достижения ими высоких показателей.
Более полную консультацию по вопросам приема электролитов можно получить у наших специалистов, в клинике MAXIMA VET.
Приобрести электролиты можно в нашей ветеринарной аптеке.
Звоните: +7(495)995-16-83 и приходите!
Твердые оксидные электролиты — горизонты электрохимии — Энергетика и промышленность России — № 5 (33) май 2003 года — WWW.EPRUSSIA.RU
Газета «Энергетика и промышленность России» | № 5 (33) май 2003 года
Электролиты
В конце прошлого века Вальтер Нернст, известный немецкий исследователь, много сделавший для развития электрохимии, использовал в осветительных лампах спресованную смесь оксидов циркония и кальция. Электрический ток, проходя через стерженек из этой «массы Нернста», нагревал его до белого каления. Так нашел свое первое практическое применение твердый электролит.
Как известно, в металлах электрический ток создают покинувшие свои атомы, то есть свободные, электроны. В электролитах это делают другие заряженные частицы — ионы — целые атомы с недостающими электронами (положительные ионы, катионы) или с лишними (отрицательные ионы, анионы).
Если в жидкий электролит погрузить два электрода и приложить напряжение, то в электролите возникнет ток, направленное движение ионов: катионы пойдут к отрицательному («-») электроду, к катоду; анионы — к положительному («+»), к аноду.
Возможен и обратный процесс: если погрузить в жидкий электролит два электрода из определенным образом подобранных металлов, то на одном из них в результате химических реакций появится избыток электронов («-»), а на другом — недостаток («+»). Между электродами будет действовать электродвижущая сила, и, значит, вся система электроды -электролит превратится в химический генератор электрического тока. Так работал первый химический источник тока — гальванический элемент из медной и цинковой пластин, погруженных в раствор поваренной соли или серной кислоты. Так работают все нынешние гальванические элементы, батарейки и аккумуляторы.
Так работают все нынешние гальванические элементы, батарейки и аккумуляторы.
В принципе то же самое происходит в химических электрогенераторах с твердыми электролитами.
Особенности твердых электролитов
Твердых электролитов известно великое множество — это оксиды, соли, кислоты и даже полимеры. В твердых растворах оксидов металлов разной валентности ток создается отрицательными ионами (анионами) кислорода.
Большинство этих твердых растворов — ионные кристаллы: в узлах кристаллической решетки находятся не нейтральные атомы, а заряженные ионы. Они образуют две подрешетки — катионную и анионную. Ионы совершают колебательные движения, но перемещаться по кристаллу, как в жидкости, не могут. Как же тогда в твердых электролитах возникает ток — движение заряженных частиц?
Ситуация меняется, если основное вещество «разбавить» другим похожим соединением, в котором анионов меньше, а катионов — столько же. Тогда катионная решетка этого твердого раствора остается прежней, а в анионной появляются свободные места — вакансии. Пустые места в отрицательно заряженной решетке можно рассматривать как положительные заряды. Под действием внешнего напряжения в них начнут переходить анионы с достаточно большой энергией, а вакансии «побегут» в противоположном направлении — к катоду. Возникнет электрический ток, обусловленный движением ионов только одного сорта. Это одна из особенностей твердых электролитов.
Пустые места в отрицательно заряженной решетке можно рассматривать как положительные заряды. Под действием внешнего напряжения в них начнут переходить анионы с достаточно большой энергией, а вакансии «побегут» в противоположном направлении — к катоду. Возникнет электрический ток, обусловленный движением ионов только одного сорта. Это одна из особенностей твердых электролитов.
Ионная проводимость тем выше, чем больше в кристалле вакансий. Однако с ростом их количества уменьшается подвижность анионов, причем довольно быстро, поэтому проводимость сначала достигает максимума, а потом начинает падать. Для твердых оксидных электролитов на основе ZrO2, например, максимум электропроводности соответствует концентрации катионов 10-15 %.
Свойства твердых оксидных электролитов
Анионы с достаточной кинетической энергией есть всегда, но при комнатной температуре их очень мало, и твердые оксидные электролиты ведут себя как хороший изолятор. По мере нагрева подвижность анионов увеличивается очень быстро, и при 150 °С проводимость электролитов становится уже вполне ощутимой.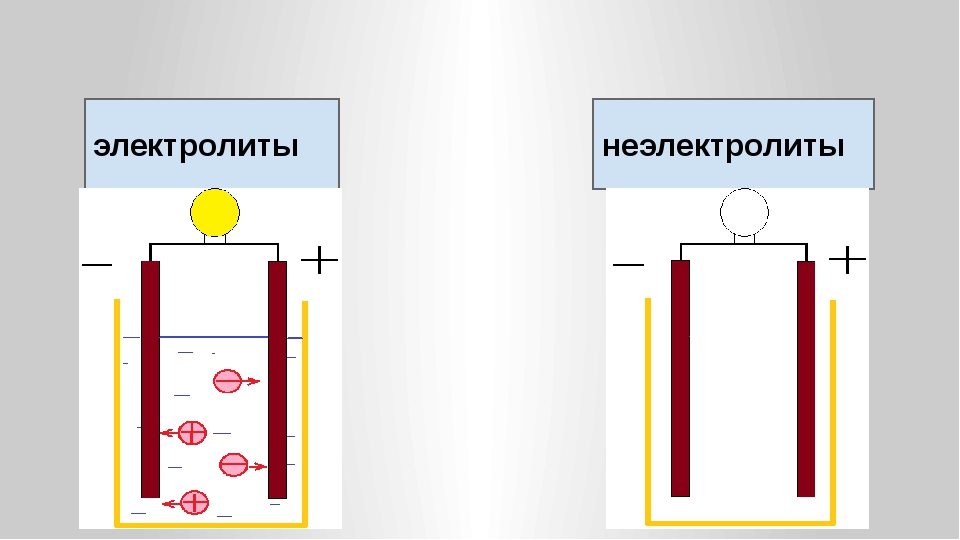 Но основная их рабочая температура лежит между 700 и 1000 °С, в связи с чем они и называются высокотемпературными электролитами.
Но основная их рабочая температура лежит между 700 и 1000 °С, в связи с чем они и называются высокотемпературными электролитами.
Твердые электролиты всегда находятся в атмосфере определенных газов, состав которой меняет их свойства. Чтобы понять, в чем тут дело, вспомним, что такое динамическое равновесие. В жидкости, например, всегда есть «быстрые» молекулы, которые с ее поверхности переходят в пар. Но и из пара молекулы возвращаются в жидкость — между ними происходит непрерывный обмен молекулами. Пар находится в равновесии с жидкостью, и, чтобы подчеркнуть, что оно сопряжено с движением на молекулярном уровне, его называют динамическим.
Характер обмена между твердым телом и газом сложнее. Ион кислорода в поверхностном слое превращается в нейтральный атом. Два атома соединяются в молекулу кислорода, которая отрывается от поверхности и переходит в газ. Возвращение кислорода из газа в твердое тело происходит в обратном порядке. Обе эти реакции идут одновременно: между электролитом и газом, содержащим определенное количество кислорода, существует динамическое равновесие. Оно нарушается, когда концентрация кислорода в газе меняется.
Оно нарушается, когда концентрация кислорода в газе меняется.
Немного истории
Итак, твердый электролит в виде смеси оксидов циркония и кальция проводит ток только при высоких температурах. Поэтому лампы Нернста включали, предварительно сильно прогрев их стержень. И появление в 1905 году лампы «немедленного действия» с вольфрамовой нитью предопределило ее абсолютный успех. Однако известно, что кое-где и сегодня можно встретить странный электрический фонарь, который нужно поджигать спичкой. Это, судя по всему, лампы Нернста, дожившие до наших дней: твердые растворы на основе диоксида циркония — исключительно стойкие вещества, они могут работать на воздухе десятилетиями, не окисляясь. Кстати, вполне современные печи с такими нагревателями были разработаны в свердловском Восточном институте огнеупоров в начале 80-х годов.
Главное предназначение твердых оксидных электролитов виделось в создании топливных элементов — химических источников тока, в которых энергия газа непосредственно превращается в электрическую.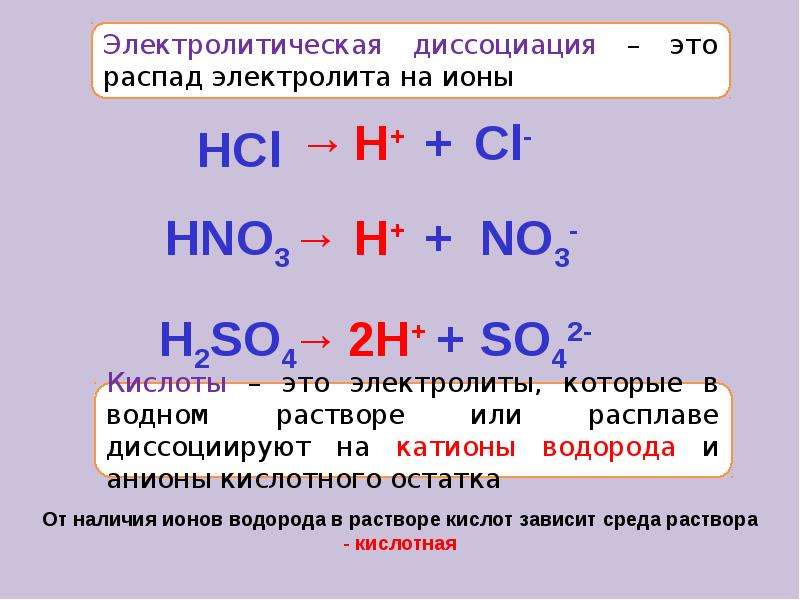 Топливные элементы — близкие родственники гальванических элементов. Но те служат, пока в их электролите и электродах есть активные вещества, а топливные элементы могут работать сколь угодно долго, пока к ним подводится горючее. Систематические исследования твердых оксидных электролитов начались в Германии в начале 50-х годов, а с конца 50-х развернулись в СССР, США и Канаде. В нашей стране эти работы с самого начала вел Институт химии Уральского филиала АН СССР (Свердловск, ныне Екатеринбург), и школа высокотемпературной электрохимии твердых электролитов, созданная на Урале, стала уникальной по широте охвата проблемы и глубине ее изучения.
Топливные элементы — близкие родственники гальванических элементов. Но те служат, пока в их электролите и электродах есть активные вещества, а топливные элементы могут работать сколь угодно долго, пока к ним подводится горючее. Систематические исследования твердых оксидных электролитов начались в Германии в начале 50-х годов, а с конца 50-х развернулись в СССР, США и Канаде. В нашей стране эти работы с самого начала вел Институт химии Уральского филиала АН СССР (Свердловск, ныне Екатеринбург), и школа высокотемпературной электрохимии твердых электролитов, созданная на Урале, стала уникальной по широте охвата проблемы и глубине ее изучения.
Устройства с твердыми оксидными электролитами
Конструкций, в основе которых лежат твердые оксидные электролиты, запатентовано очень много, но принцип их действия одинаков и довольно прост. Это пробирка с парой электродов на стенке, снаружи и внутри. Она помещена в нагреватель; внутрь пробирки и в пространство, ее окружающее, можно подводить газ. Посмотрим, какие функции могут выполнять такие устройства.
Посмотрим, какие функции могут выполнять такие устройства.
Потенциометрические датчики состава газа. Наверное, они наиболее просты. Мы уже знаем, что электроды в разных газах приобретают разные потенциалы. Если, скажем, внутри пробирки находится чистый кислород, а снаружи — газ с неизвестной его концентрацией, то по разности потенциалов электродов можно эту концентрацию определить.
Потенциометрические датчики позволяют определять состав и более сложных газовых смесей, содержащих углекислый и угарный газы, водород и водяной пар. Если стерженек из твердого электролита с электродами на торцах нагрет неравномерно, он начнет терять кислород и между электродами возникнет разность потенциалов. По ее величине можно определить, например, состав выхлопных газов автомобильного двигателя. На Западе, где требования к чистоте выхлопных газов очень строги, такие датчики выпускаются миллионами. У нас же на такие «пустяки» пока не обращают внимания.
Кислородные датчики пока единственные устройства с твердыми оксидными электролитами, нашедшие практическое применение.
Кислородные насосы. Пусть во внешнее пространство пробирки подается воздух или газ, содержащий кислород. Если внешний электрод стал анодом, а внутренний — катодом, то из газа в пробирку пойдет чистый кислород. Подобные устройства — кислородные насосы — могут найти применение там, где потребление кислорода невелико или требуется его высокая чистота.
В медицине, например, используется и чистый кислород, и воздух с пониженным содержанием кислорода — так называемая «гипоксическая смесь», или «горный воздух». Электрохимические насосы наряду с мембранными оксигенаторами (см. «Наука и жизнь» № 2, 1999 г.) позволят решить массу проблем, особенно в медицинских учреждениях, удаленных от промышленных центров. В атмосфере с пониженным содержанием кислорода значительно дольше хранятся продукты питания, и устройства с кислородными насосами могут стать экономичней привычных холодильников.
Электролизеры. Теперь к внешнему электроду — катоду — подводят водяной пар или углекислый газ. На катоде будет происходить разложение пара или углекислого газа, а на аноде в обоих случаях выделяется кислород. Уникальная способность этого высокотемпературного электролизера одновременно разлагать водяной пар и углекислый газ позволяет создать систему жизнеобеспечения, скажем, на космических объектах.
На катоде будет происходить разложение пара или углекислого газа, а на аноде в обоих случаях выделяется кислород. Уникальная способность этого высокотемпературного электролизера одновременно разлагать водяной пар и углекислый газ позволяет создать систему жизнеобеспечения, скажем, на космических объектах.
Теплоэлектрогенераторы. Человек сделал первый шаг к независимости от природы, научившись сохранять огонь, поистине универсальный источник энергии. Костер давал тепло и свет, на нем готовили пищу, он расходовал ровно столько топлива, сколько было необходимо. Костер тысячелетиями оставался главной энергетической установкой человека, и неудивительно, что мы испытываем какую-то ностальгию по очагу с горящими дровами.
Еще в конце прошлого века свет давали свечи и керосиновые лампы, а тепло — печи. Лишь немногим более ста лет назад на человека начало работать электричество, которое могло давать свет, тепло, механическую работу. Одно время казалось, что достаточно подвести к жилищу только электрическую энергию, а уж там преобразовывать ее во что угодно.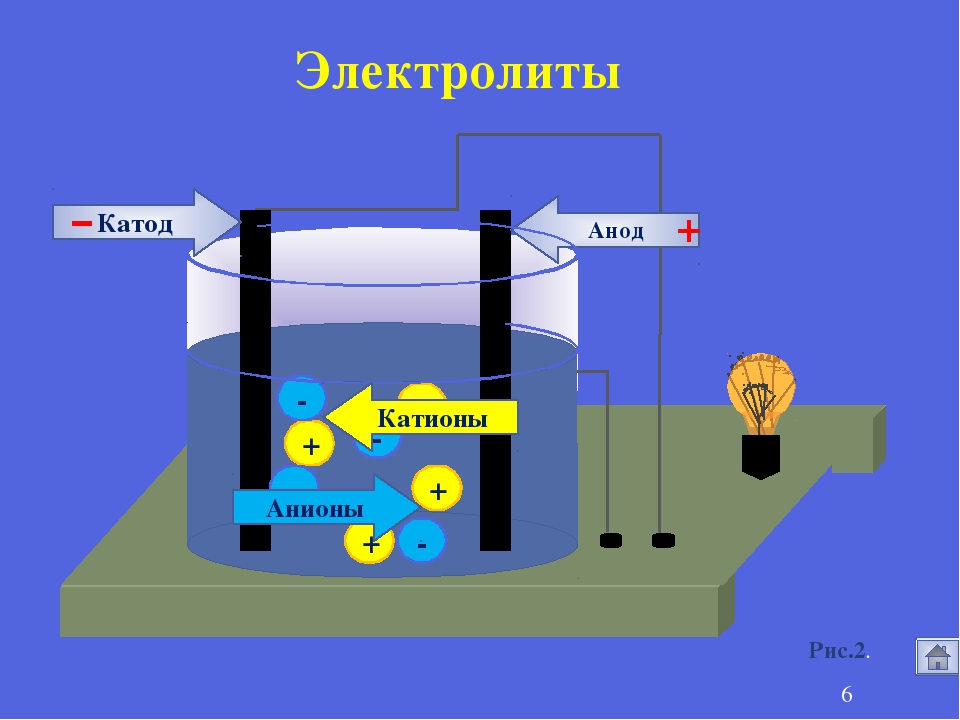 Но сказала свое слово экономика: кпд электростанции менее 40%, потери при передаче и обратном превращении электричества в другие виды энергии тоже значительны. Ясно, что там, где нужно только тепло, его целесообразно получать прямо из топлива. И не случайно сегодня обсуждается простая идея: вернуть «очаг» в дом в виде электрохимического генератора с топливным элементом, преобразующим энергию топлива в электричество и тепло.
Но сказала свое слово экономика: кпд электростанции менее 40%, потери при передаче и обратном превращении электричества в другие виды энергии тоже значительны. Ясно, что там, где нужно только тепло, его целесообразно получать прямо из топлива. И не случайно сегодня обсуждается простая идея: вернуть «очаг» в дом в виде электрохимического генератора с топливным элементом, преобразующим энергию топлива в электричество и тепло.
Топливные элементы. Пусть к внешним стенкам пробирки подается водород, а внутрь ее — кислород. Между электродами возникнет напряжение около вольта, по соединяющей их цепи потечет ток, и на электродах пойдут реакции, обратные тем, что проходят в электролизере. Внешний электрод станет анодом, внутренний — катодом, а устройство превратится в источник тока — твердооксидный топливный элемент.
Одно и то же устройство может служить и топливным элементом, и электролизером, позволяя аккумулировать электрическую энергию. В период низкого ее потребления невостребованная мощность электростанций используется для получения водорода. В пике потребления электролизер начинает работать как топливный элемент, производя электричество из водорода.
В пике потребления электролизер начинает работать как топливный элемент, производя электричество из водорода.
Топливом в элементе может быть и угарный газ. В него нетрудно превратить уголь, нефть, различные газы и спирты (которые, например, в Бразилии используют как горючее для автомобилей). Элемент послужит основой электрохимического генератора, способного существенно изменить концепцию снабжения жилища энергией. Наиболее прост в техническом отношении генератор на природном газе — метане или пропане.
Как показывают исследования, его электрический кпд достигает 70%. Остальные 30% энергии топлива выделяются в виде тепла, которое можно использовать в паровых турбинах. Кпд такой комбинированной установки способно превысить 80% — столь высокой эффективности нет ни у одного генератора.
Восемь лет назад в Институте высокотемпературной электрохимии Уральского отделения РАН был изготовлен демонстрационный генератор на метане мощностью один киловатт. Но до практической реализации дело никак не дойдет. Опытно-конструкторские работы, которые уже начинались, до конца так и не доведены. Задача очень сложна, ее необходимо решать в рамках национальной программы, попытки разработать которую оказались пока безуспешными.
Опытно-конструкторские работы, которые уже начинались, до конца так и не доведены. Задача очень сложна, ее необходимо решать в рамках национальной программы, попытки разработать которую оказались пока безуспешными.
Электроды и полимерные электролиты для металл-ионных аккумуляторов « Образование
Научный руководитель: к.х.н. Олег Александрович Семенихин
Хорошо известно, что электролит или, в более общем виде, ион-проводящий материал — необходимая часть любой электрохимической системы. Именно на границе раздела электронный/ионный проводник происходит превращение электрической энергии в химическую, и наоборот. В том числе, электролит необходим и для таких важных электрохимических систем, как аккумуляторы и прочие электрохимические накопители энергии. Самый простой ионный проводник — это вода или другой полярный растворитель, в который добавлена соль. Соль диссоциирует на ионы, ионы двигаются в жидком ионном проводнике под влиянием электрического поля и переносят электрический ток. Но системы с жидким электролитом, как правило, весьма неудобны для практических электрохимических устройств. При любом повреждении электролит вытекает. Кроме того, многие электролиты — органические горючие жидкости, которые могут воспламениться. Поэтому жидкие электролиты в таких системах стремятся заменить на твердые или гелеобразные. Но возникает проблема, что проводимость таких систем значительно ниже, чем у жидких электролитах, потому что ионам сложнее двигаться в твердом теле по сравнению с жидкостью. Низкая проводимость электролита приводит к большим потерям.
Но системы с жидким электролитом, как правило, весьма неудобны для практических электрохимических устройств. При любом повреждении электролит вытекает. Кроме того, многие электролиты — органические горючие жидкости, которые могут воспламениться. Поэтому жидкие электролиты в таких системах стремятся заменить на твердые или гелеобразные. Но возникает проблема, что проводимость таких систем значительно ниже, чем у жидких электролитах, потому что ионам сложнее двигаться в твердом теле по сравнению с жидкостью. Низкая проводимость электролита приводит к большим потерям.
Повысить проводимость твердых электролитов можно за счет оптимизации их структуры и механизма проводимости. В неорганических ионных кристаллах основной механизм ионной проводимости — это перескок ионов между различными вакантными местами в кристаллической решетке. Этот процесс требует активации и при комнатных температурах проводимость таких систем недостаточна. В полимерных электролитах, которыми мы занимаемся, проводимость выше, потому что появляются другие механизмы переноса ионов. Одним из таких механизмов является движение полимерных цепей. Если на полимерных цепях имеются полярные группы, они могут координироваться с ионами электролита. Далее, поскольку полимерные цепи могут быть гибкими (и именно такие полимеры мы рассматриваем), конфигурация полимерных цепей все время меняется, и за счет этого ионы могут быть перенесены с одного места на другое. Подвижные полимерные цепи при этом работают как своеобразные роботы-манипуляторы. Очевидно, что подвижность и гибкость полимерных цепей будут зависеть от структуры полимера, степени его кристалличности, наличия пластификатора, и прочих факторов. С одной стороны это делает наши системы сложнее для изучения, а с другой — открывает новые возможности оптимизации их структуры и повышения проводимости.
Одним из таких механизмов является движение полимерных цепей. Если на полимерных цепях имеются полярные группы, они могут координироваться с ионами электролита. Далее, поскольку полимерные цепи могут быть гибкими (и именно такие полимеры мы рассматриваем), конфигурация полимерных цепей все время меняется, и за счет этого ионы могут быть перенесены с одного места на другое. Подвижные полимерные цепи при этом работают как своеобразные роботы-манипуляторы. Очевидно, что подвижность и гибкость полимерных цепей будут зависеть от структуры полимера, степени его кристалличности, наличия пластификатора, и прочих факторов. С одной стороны это делает наши системы сложнее для изучения, а с другой — открывает новые возможности оптимизации их структуры и повышения проводимости.
В рамках указанной общей проблемы сейчас в нашей группе решаются следующие типы задач:
1. Разработка и оптимизация полимерных электролитов на основе полиакрилонитрила с высокой проводимостью по ионам натрия;
2. Фундаментальные исследования кинетики электрохимических процессов на границе раздела электронный проводник/полимерный ионный проводник;
Фундаментальные исследования кинетики электрохимических процессов на границе раздела электронный проводник/полимерный ионный проводник;
3. Использование ионпроводящих полимерных связующих для оптимизация структуры электродов для метал-ионных аккумуляторов, имеющих наноразмерную архитектуру.
Возможные темы курсовых работ
1. Неорганическая химия. Повышение проводимости полимерного электролита введением наноразмерных неорганических наполнителей на основе диоксида титана.
2. Аналитическая химия. Разработка метода определения концентрации ионов натрия в полимерных ионных проводниках на основе полиакрилонитрила; определение характера их связывания в полимерной матрице.
3. Физическая химия. По физической химии возможны самые разнообразные курсовые работы в общих рамках изложенных выше направлений. Конкретные тематики будут определены в зависимости от интересов студента и научных потребностей группы в данный момент времени.
4. Дипломные работы. Углубленные комплексные исследования в рамках перечисленных выше научных проблем. Могут «вырастать» и вырастают из выполненных ранее курсовых работ. Конкретные тематики будут определены в зависимости от интересов студента и научных потребностей группы в данный момент времени.
Что представляет собой электролит и насколько он опасен
Электролит в автомобильных аккумуляторах, представленных в продаже, — та среда, в которой происходят химические реакции, в результате которой происходит накопление и отдача электроэнергии для питания электрооборудования транспортного средства при выключенном двигателе.
Электролит, присутствующий в автомобильных и мотоаккумуляторах, представлен разбавленной серной кислотой. Это – агрессивная химическая среда, требующая осторожного обращения. Попадание брызг электролита на кожу или в глаза вызывает очень болезненные ощущения и ожоги. Вылечить их трудно.
Свинцово-кислотный АКБ — один из самых распространенных типов аккумуляторных батарей, использующийся как источник электроэнергии в автомобилях, мотоциклах, мопедах и прочих ТС. Необходимость купить автомобильные аккумуляторы этого типа возникает у большинства авто-мото-любителей. Вот почему с электролитом приходится иметь дело многим владельцам транспортных средств.
Необходимость купить автомобильные аккумуляторы этого типа возникает у большинства авто-мото-любителей. Вот почему с электролитом приходится иметь дело многим владельцам транспортных средств.
Меры предосторожности при обращении с электролитом:
- Серная кислота (h3SO4) – ядовитое вещество, поэтому, работая с АКБ, обязательно надевайте специальные очки, резиновые перчатки и фартук. Они защитят от ожогов, порчи кузова машины, мотоцикла и т.д., одежды.
- На этот случай всегда имейте под рукой нейтрализующие аккумуляторную кислоту средства – раствор нашатырного спирта или соду. При попадании электролита на тело и проч. сразу же нейтрализуйте ее действие, потом смойте струей воды. При попадании в глаза промывайте их не менее четверти часа, после чего сразу же обращайтесь к врачу.
- Если Вы предпочитаете не покупку готового электролита для АКБ своего автомобиля или мототехники, а готовите самостоятельно, то советуем вливать концентрированную h3SO4 в воду тонкой струей (только в не металлическую емкость), постоянно помешивая раствор.
 Поступать наоборот — вливать воду в кислоту — недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны.
Поступать наоборот — вливать воду в кислоту — недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны. - При постановке свинцово-кислотных автоаккумуляторов на зарядку, не закручивайте пробки заливочных емкостей. Дайте образующимся в процессе зарядки батареи газам свободный выход иначе корпус АКБ взорвется.
- При постановке кислотных обслуживаемых аккумуляторов обязательно выкручиваются пробки заливочных отверстий для свободного выхода образующихся в процессе зарядки газов. В противном случае скопившийся в корпусе водород взорвет аккумулятор.
Выбирая автомобильный аккумулятор в Балашихе или Реутове, можно остановиться на современной необслуживаемой модели. Если же Вы предпочитаете обслуживаемую АКБ, то при работе с ней не пренебрегайте общими мерами предосторожности.
Поблизости от заряжающейся батареи нельзя допускать открытого огня, искр (проводить сварные работы, например), короткого замыкания, курить.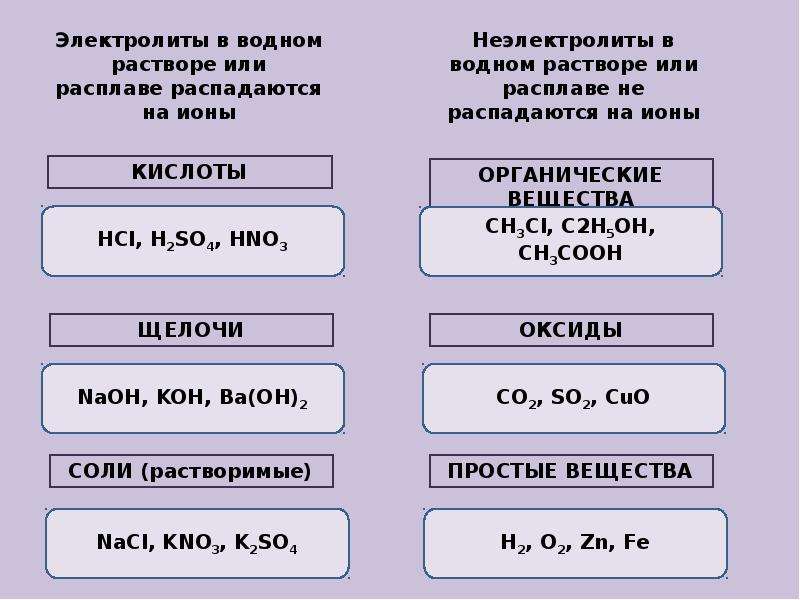 Помещение, где происходит зарядка, должно хорошо проветриваться. Если есть необходимость в проверке токопроводящих кабелей автомобиля, то обесточьте электрическую систему и не включайте зажигание. Присоединяя и отсоединяя провода зарядного устройства к АКБ, тоже сначала обесточьте его. И последняя предосторожность, которую нужно строго соблюдать автолюбителю: первым при отключении автоаккумулятора отсоединяйте провод массы, а при подключении он подсоединяется последним.
Помещение, где происходит зарядка, должно хорошо проветриваться. Если есть необходимость в проверке токопроводящих кабелей автомобиля, то обесточьте электрическую систему и не включайте зажигание. Присоединяя и отсоединяя провода зарядного устройства к АКБ, тоже сначала обесточьте его. И последняя предосторожность, которую нужно строго соблюдать автолюбителю: первым при отключении автоаккумулятора отсоединяйте провод массы, а при подключении он подсоединяется последним.
Что нельзя делать с аккумулятором летом, чтобы он не «умер» зимой
Когда ваш автомобильный аккумулятор подводит и машина не заводится, это крайне неприятно. Между тем нередко виноват сам водитель, не выполнявший ряд простых правил. Разберемся, какие именно ошибки могут сократить жизнь АКБ даже летом.
Как можно убить аккумулятор быстрее всего
Самый простой путь вывести из строя аккумулятор — это долить в электролит обычную воду — электроды в таком случае выйдут из строя.
Жизнь АКБ может радикально сократить также заряд током чрезмерно большой силы, перегрев электролита и его повышенная плотность, повышенное и пониженное напряжение в бортовой сети автомобиля, загрязнение электролита и короткое замыкание (возможно при неосторожном обращении с инструментом вблизи контактов батареи, или при повреждения изоляции силового кабеля). Однако существуют и менее явные огрехи, которые также вредны для АКБ. Читайте о них ниже.
Однако существуют и менее явные огрехи, которые также вредны для АКБ. Читайте о них ниже.
Не поддерживать чистоту
При эксплуатации автомобиля в особенности в условиях повышенной загрязненности (пыль, песок, пыльца деревьев и т.п.) следует уделять особое внимание чистоте корпуса АКБ. Ведь если грязь просочится в электролит, печальная судьба батареи по сути предрешена.
Загрязнения на корпусе следует регулярно устранять мягкой тряпкой, смоченной в растворе нашатырного спирта или кальцинированной соды.
Используйте зубную щетку или мелкую шкурку, чтобы удалить любые следы коррозии, если вы обнаружите их на клеммах аккумулятора. Лишняя грязь и следы окисления на клеммах провоцируют замыкание и разрядку АКБ. Не забывайте также проверять надежность крепления как самого аккумулятора, так и его клемм.
Игнорировать температурный режим
Не секрет, что аккумуляторы постепенно подсаживаются от скачков температуры в межсезонье и долгого отсутствия нагрузки. При падении плотности электролит замерзает — это вызывая деформации и осыпание пластин, равно как прожоги от коротких замыканий. Поэтому не следует оставлять ваш автомобиль на недели и месяцы на улице в мороз.
Поэтому не следует оставлять ваш автомобиль на недели и месяцы на улице в мороз.
Регулярно заводите ваш автомобиль зимой, а еще лучше — совершайте хотя бы короткие поездки, чтобы батарея могла подзарядиться. Гаражное хранение — идеальный вариант, но даже в этом случае следует замерять тестером уровень заряда АКБ на заглушенном двигателе хотя бы раз в месяц. При полном заряде показания стремятся к значению 12.7 вольт. При почти полной разрядке будет примерно 12 вольт. При нормальной плотности электролита, которая должно составлять 1,27 г/см куб., образование льда начнется только при температуре ниже -65 град.
Перегружать батарею
Прежде всего, не перегружайте сеть. Различные усилители, доп.оборудование и девайсы типа видеорегистратора, радар-детектора и просто несколько подключенных к «мультимедийке» гаджетов — это, конечно, замечательно. Но такая прорва потребителей неизбежно повысит нагрузку на сеть.
Нередки также случаи запредельных разрядов, например, после пуска двигателя стартером.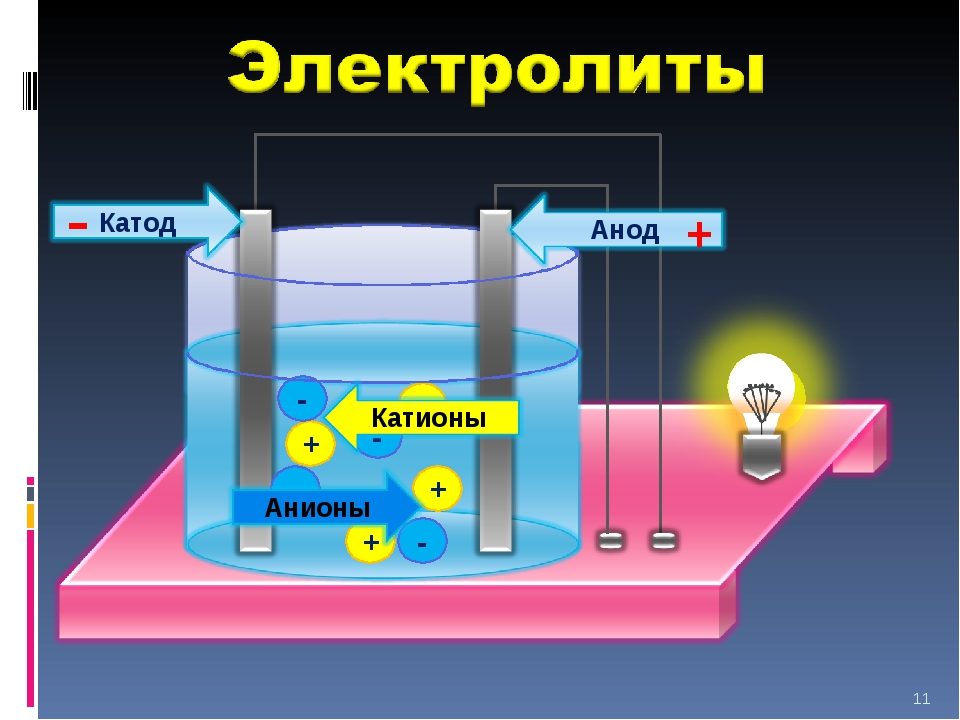 Или, скажем, если вы регулярно даете «прикурить» друзьям и соседям (особенно если потенциал их АКБ больше, чем у вашего), это также не идет на пользу батарее. Кроме того, помогая такому аккумулятору, который уже «дышит на ладан», донор может еще и спалить бортовую электронику.
Или, скажем, если вы регулярно даете «прикурить» друзьям и соседям (особенно если потенциал их АКБ больше, чем у вашего), это также не идет на пользу батарее. Кроме того, помогая такому аккумулятору, который уже «дышит на ладан», донор может еще и спалить бортовую электронику.
Неправильное обслуживание
Если ваш аккумулятор обслуживаемый, то в рамках самостоятельного «ТО» следует долить нужное количество смести дистиллированной воды и электролита (у автомобильных аккумуляторов принято считать нормальным уровень заливки на 10-15 мм выше верхней кромки пластин) и убедиться в том что раствор имеют оптимальную плотность (1.27 г/см3).
Если в АКБ пониженная плотность смеси, то это может привести к быстрому разряду и замерзанию раствора. Если плотность повышенная — тоже плохо: чревато «обезвоживанием», и, как следствие, разъеданием пластин. Плотность состава измеряется специальным прибором — ареометром (денсиметром).
Совет «подснежникам» — отнесите аккумулятор домой зимой
Есть категория водителей, которые по тем или иным причинам не ездят зимой.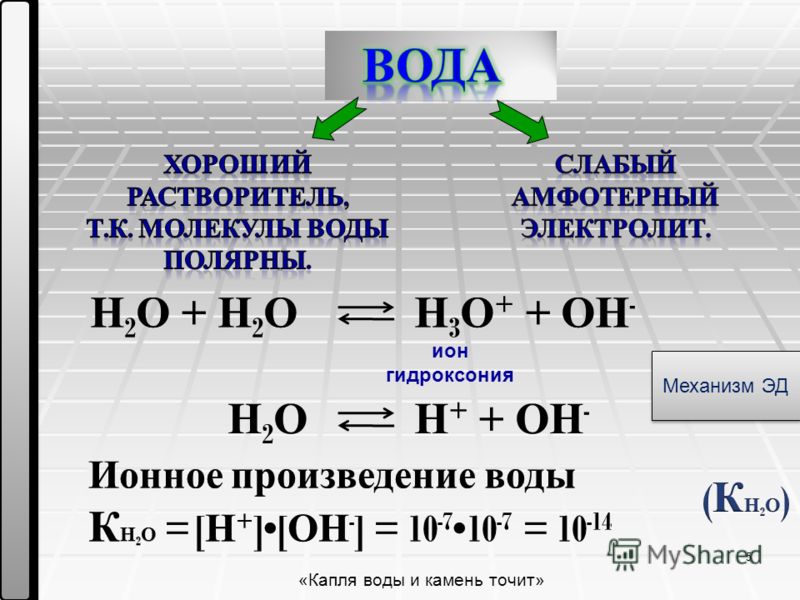 Для таких людей имеет прямой смысл позаботится об аккумуляторе. АКБ необходимо снять и отнести домой или в теплый гараж. Хранить батарею рекомендуется при комнатной температуре. При этом каждые два — три месяца аккумулятор рекомендуется подзаряжать, предварительно проверяя уровень зарядки с помощью вольтметра.
Для таких людей имеет прямой смысл позаботится об аккумуляторе. АКБ необходимо снять и отнести домой или в теплый гараж. Хранить батарею рекомендуется при комнатной температуре. При этом каждые два — три месяца аккумулятор рекомендуется подзаряжать, предварительно проверяя уровень зарядки с помощью вольтметра.
Что такое электролит?
Электролит — это медицинский термин, обозначающий соль или ион в крови или другой жидкости организма, несущие заряд.
Растворение некоторых биологических полимеров, таких как ДНК, или синтетических полимеров, таких как полистиролсульфонат, дает раствор электролитов, которые называются полиэлектролитами, и они содержат заряженные функциональные группы. Помещение соли в растворитель (например, воду) также приводит к получению раствора электролита, поскольку компоненты в соли диссоциируют в процессе, называемом сольватацией.Когда, например, в воду добавляют хлорид натрия или поваренную соль, соль растворяется и распадается на составляющие ионы натрия (Na +) и хлорид (Cl-).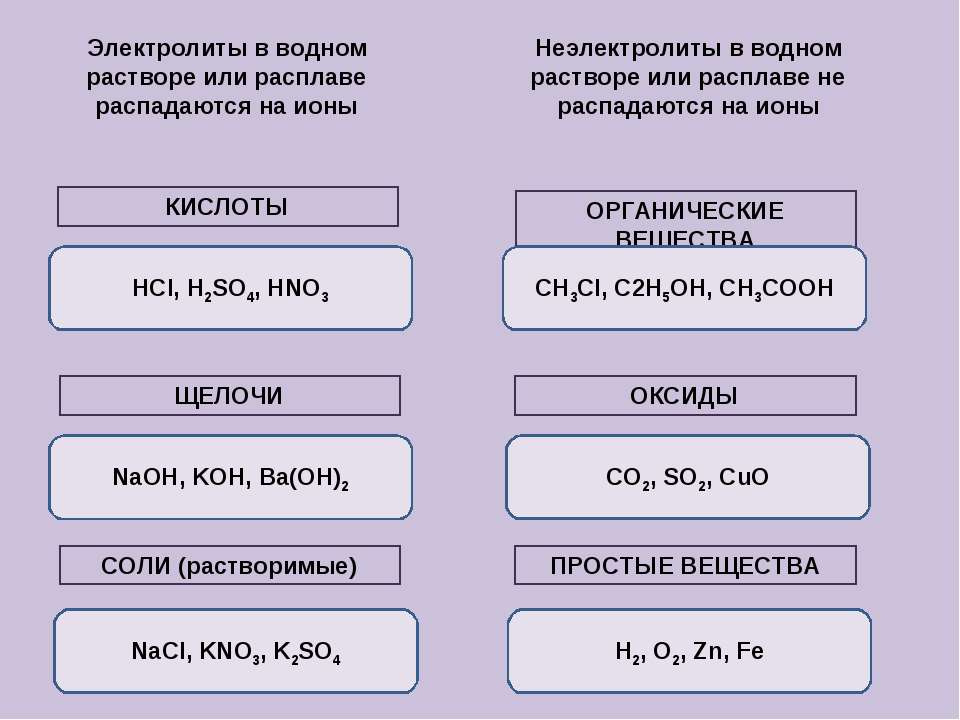 Точно так же, когда углекислый газ растворяется в воде, он производит ионы карбоната, ионы гидрокарбоната и ионы гидроксония. Расплавленные соли также могут быть электролитами. Например, расплавленный хлорид натрия становится жидкостью, которая может проводить электричество.
Точно так же, когда углекислый газ растворяется в воде, он производит ионы карбоната, ионы гидрокарбоната и ионы гидроксония. Расплавленные соли также могут быть электролитами. Например, расплавленный хлорид натрия становится жидкостью, которая может проводить электричество.
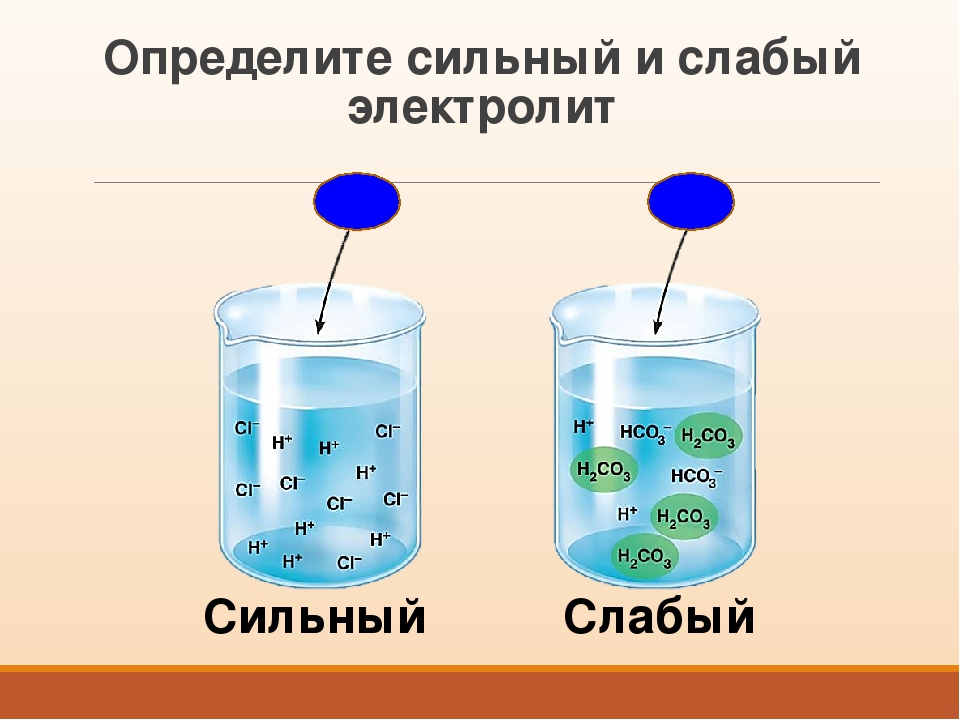
Электролит в растворе называется концентрированным, если он содержит большое количество ионов, и разбавленным, если он имеет низкое количество.Следовательно, если большое количество растворенного вещества диссоциирует с образованием свободных ионов, электролит является сильным, тогда как если небольшая часть растворенного вещества диссоциирует, электролит является слабым. Электролиты обладают несколькими свойствами, которые можно использовать в процессе электролиза как средство разделения и извлечения элементов и соединений, присутствующих в растворе.
В биологических системах основными электролитами являются:
- Натрий (Na +)
- Калий (K +)
- Кальций (Ca2 +)
- Магний (Mg2 +)
- Хлорид (Cl-)
- Фосфат водорода (HPO42-)
- Карбонат водорода (HCO3-).

Символ «плюс» или «минус» указывает на ионную природу вещества: его положительный или отрицательный заряд в результате диссокации. Эти электролиты необходимы для различных функций организма, и дисбаланс электролитов может быть опасным и даже опасным для жизни, в зависимости от клинического сценария. Таким образом, в организме тщательно поддерживается баланс уровней электролитов, и его можно проверить с помощью крови или мочи как показателя здоровья. Потеря электролитов обычна в случаях чрезмерной рвоты, диареи или потоотделения, но ее можно восполнить с помощью изотонических напитков или, в некоторых случаях, раствора для пероральной регидратации (ПРС).
Дополнительная литература
Электролиты — Химия LibreTexts
Одним из наиболее важных свойств воды является ее способность растворять самые разные вещества. Растворы, в которых вода является растворяющей средой, называются водными растворами . Для электролитов вода является наиболее важным растворителем.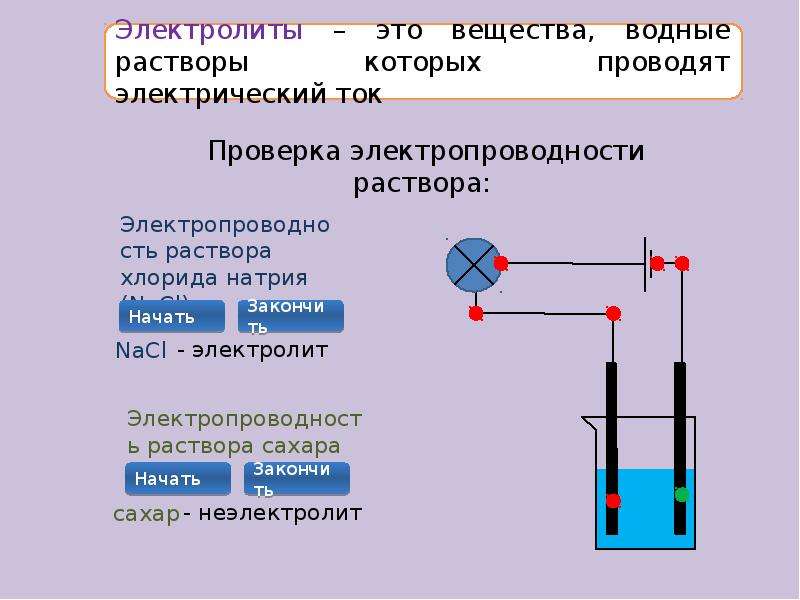 Этанол, аммиак и уксусная кислота являются одними из неводных растворителей, способных растворять электролиты.
Этанол, аммиак и уксусная кислота являются одними из неводных растворителей, способных растворять электролиты.
Электролиты
Вещества, которые при растворении в воде выделяют ионы, называются электролитами .Их можно разделить на кислоты, основания и соли, потому что все они при растворении в воде дают ионы. Эти растворы проводят электричество благодаря подвижности положительных и отрицательных ионов, которые называются катионами , и анионами , соответственно. Сильные электролиты полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы.
Например, \ (\ ce {NaCl} \), \ (\ ce {HNO3} \), \ (\ ce {HClO3} \), \ (\ ce {CaCl2} \) и т. Д. Являются сильными электролитами.-_ {\ large {(aq)}}} \)
Поскольку \ (\ ce {NaCl} \) является твердым ионным веществом (s), которое состоит из катионов \ (\ ce {Na +} \) и анионов \ (\ ce {Cl -} \), молекулы \ (\ ce {NaCl} \) присутствуют в \ (\ ce {NaCl} \) твердом или \ (\ ce {NaCl} \) растворе. -]} {[H_2O]}} \)
-]} {[H_2O]}} \)
Для чистой воды \ (\ ce {[h3O]} \) — постоянная величина (1000/18 = 55.+] = 7} \).
Обратите внимание, что только при 298 K pH воды равен 7. При более высоких температурах pH немного меньше 7, а при более низких температурах pH больше 7.
Электролиты в жидкостях организма
Жидкости нашего организма — это растворы электролитов и многое другое. Комбинация крови и кровеносной системы — это река жизни , потому что она координирует все жизненные функции. Когда сердце перестает биться при сердечном приступе, жизнь быстро заканчивается.Чтобы сохранить жизнь, крайне важно перезапустить сердце как можно скорее.
Основными электролитами, необходимыми в жидкости организма, являются катионы (кальция, калия, натрия и магния) и анионы (хлоридов, карбонатов, аминоацетатов, фосфатов и йодида). Эти вещества называются макроминералами .
Баланс электролитов имеет решающее значение для многих функций организма. Вот несколько крайних примеров того, что может случиться при дисбалансе электролитов: повышенный уровень калия может привести к сердечной аритмии; снижение внеклеточного калия вызывает паралич; чрезмерное количество внеклеточного натрия вызывает задержку жидкости; снижение содержания кальция и магния в плазме может вызвать мышечные спазмы конечностей.
Вот несколько крайних примеров того, что может случиться при дисбалансе электролитов: повышенный уровень калия может привести к сердечной аритмии; снижение внеклеточного калия вызывает паралич; чрезмерное количество внеклеточного натрия вызывает задержку жидкости; снижение содержания кальция и магния в плазме может вызвать мышечные спазмы конечностей.
При обезвоживании пациента для поддержания здоровья и благополучия требуется тщательно приготовленный (имеющийся в продаже) раствор электролита. С точки зрения здоровья ребенка пероральный электролит необходим, когда ребенок обезвоживается из-за диареи. Использование растворов для поддержания перорального электролита, благодаря которым за последние 25 лет были спасены миллионы жизней во всем мире, является одним из самых важных медицинских достижений в защите здоровья детей в этом веке, — объясняет Джуилус Г.К. Гепп, доктор медицины, помощник директора отделения неотложной помощи детского центра при больнице Джона Хопкинса. Если родитель дает поддерживающий раствор электролита для приема внутрь в самом начале болезни, обезвоживание можно предотвратить. Функциональность растворов электролитов связана с их свойствами, и интерес к растворам электролитов выходит далеко за рамки химии.
Функциональность растворов электролитов связана с их свойствами, и интерес к растворам электролитов выходит далеко за рамки химии.
Электролиты и батареи
Растворы электролитов всегда требуются в батареях, даже в сухих элементах .- \ rightarrow Cu _ {\ large {(s)}}} \)
В сухих ячейках раствор заменяют пастой, чтобы раствор не вытек из упаковки. В этой ячейке электроды \ (\ ce {Zn} \) и \ (\ ce {Cu} \) имеют напряжение 1,10 В, если концентрации ионов соответствуют указанным.
Химические реакции электролитов
При объединении растворов электролитов катионы и анионы встретятся друг с другом. Когда ионы безразличны друг к другу, реакции нет.Однако некоторые катионы и анионы могут образовывать молекулы или твердые тела, и, таким образом, катионы и анионы меняют партнеров. Это так называемые реакции метатезиса, которые включают:
- Образование твердого вещества Реакции (или осаждения): катионы и анионы образуют менее растворимое твердое вещество, в результате чего появляется осадок.

- Нейтрализация реакции: \ (\ ce {H +} \) кислоты и \ (\ ce {OH -} \) основания объединяются с образованием нейтральной молекулы воды.
- Образование газа реакции: Когда в результате реакции образуются нейтральные газообразные молекулы, они покидают раствор, образуя газ.2 +} \)
- \ (\ ce {Na +} \)
- любой анион
- Движутся ли положительные ионы в солевом мостике?
- Какой раствор следует использовать для электрода \ (\ ce {Cu} \) ?
- любая соль цинка
- любая медная соль
- любой хлорид
- любая соль
- кислота
- основание
- Что из следующего вы будете использовать в качестве соляного моста?
- твердый \ (\ ce {NaCl} \)
- концентрированный \ (\ ce {NaCl} \) раствор
- \ (\ ce {HNO3} \) раствор
- концентрированный \ (\ ce {h3SO4} \) раствор
- деионизированная вода
- любая твердая соль
- Какой из следующих растворов лучше всего проводит электричество? Все растворы имеют одинаковую концентрацию в М.
- спирт
- аммиак
- сахар
- уксусная кислота
- соль поваренная
- Какой из следующих растворов имеет самый высокий pH?
- 0,10 M \ (\ ce {NaCl} \) раствор
- 0,10 M \ (\ ce {HCl} \) раствор
- Вода при 273 K (точка замерзания воды)
- Вода при 293 К (комнатная температура)
- Вода при 373 K (температура кипения воды)
- При объединении растворов электролитов катионы и анионы обмениваются партнерами. Эти реакции называются:
- реакции горения
- окислительно-восстановительные реакции
- реакции окисления
- реакции восстановления
- реакции метатезиса
- Распознавать свойства раствора электролита.
- Электролиты — это соли или молекулы, которые полностью ионизируются в растворе. В результате растворы электролитов легко проводят электричество.

- В растворе неэлектролиты не диссоциируют на ионы; поэтому растворы неэлектролитов не проводят электричество.
- неэлектролит Вещество, не диссоциирующее на ионы в растворе.
- раствор Гомогенная смесь, которая может быть жидкостью, газом или твердым телом, образованная растворением одного или нескольких веществ.
- растворенное вещество: Любое вещество, растворенное в жидком растворителе для создания раствора.
- электролит: Вещество, которое в растворе диссоциирует на ионы.
- соль — ионное соединение, состоящее из катионов и анионов, которые удерживаются вместе за счет электростатического притяжения.
- Определите электролит.
- Определите неэлектролит.
- Перечислить общие электролиты и неэлектролиты.
- кальций — в костях и зубах.Также важен для сокращения мышц, свертывания крови и работы нервов.
- натрия — находится вне камеры. В основном участвует в водном балансе, а также в передаче нервных сигналов.
- калий — главный катион внутри клетки. Важен для правильного функционирования сердца, мышц, почек и нервов.
- магний — в костях и клетках. Участвует в мышцах, костях, нервной системе, участвует во многих биохимических реакциях.
- Электролиты проводят электрический ток в растворе или расплавленном состоянии.
- Неэлектролиты не проводят электрический ток в растворе или расплаве.
- Некоторые электролиты играют важную роль в организме.
- Как инструктор проверил наличие электролитов?
- Дистиллированная вода — это электролит?
- Раствор соли электролит
- Сахар — это электролит?
- Уксус — это электролит?
- Что такое электролит?
- Что такое неэлектролит?
- Приведите два примера электролитов.

- Приведите два примера неэлектролитов.
- электролит: Соединение, проводящее электрический ток, когда оно находится в водном растворе или расплавлено.
- неэлектролит: Соединение, которое не проводит электрический ток ни в водном растворе, ни в расплавленном состоянии.
- проводимость: Способность образовывать электрический ток.
- Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы.
 Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов.
Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.Это то, чего жаждут растения. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки).
Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.Это то, чего жаждут растения. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такое решение нейтрально, но может включать продажу младенцев. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток.Это включает большинство растворимых солей, кислот и оснований. Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы.
Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такое решение нейтрально, но может включать продажу младенцев. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток.Это включает большинство растворимых солей, кислот и оснований. Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество.Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора будут притягиваться к электроду, который имеет большое количество электронов, в то время как анионы притягиваются к электроду, который имеет дефицит электронов.
Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество.Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора будут притягиваться к электроду, который имеет большое количество электронов, в то время как анионы притягиваются к электроду, который имеет дефицит электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки).
Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. == Этимология == پپپ Слово электролит происходит от древнегреческого ήλεκτρο- (ēlectro-), приставки, относящейся к электричеству, и λυτός (lytos), что означает «способный развязываться или ослаблять» بپپپپپپاپ.منم و م
Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. == Этимология == پپپ Слово электролит происходит от древнегреческого ήλεκτρο- (ēlectro-), приставки, относящейся к электричеству, и λυτός (lytos), что означает «способный развязываться или ослаблять» بپپپپپپاپ.منم و م - Электролит — это твердое или жидкое химическое вещество, которое принимает ионы, выделяет их и может переносить ионы. Аккумуляторы с твердым электролитом могут использоваться как батареи из абсорбирующего стекломата или гелевые батареи.
- Связанные термины
- Батарея, топливный элемент, электрод, выработка электроэнергии, топливный элемент
- ↑ http://www1.eere.energy.gov/hydrogenandfuelcells/glossary.html
Подсказка: e. любой анион
Навык:
Объяснять движение ионов в растворе электролитов.
Подсказка: да
Ионы двух типов движутся в противоположных направлениях.
Навык:
Объяснять движение ионов в растворе электролитов.
Подсказка: б. любая соль меди
любая соль меди
В качестве \ (\ ce {Zn} \) — электрода можно использовать любую соль. Но для электрода \ (\ ce {Cu} \) обычно используется \ (\ ce {CuSO4} \) или \ (\ ce {CuCl2} \).
Навык:
Применять химические знания при установке батарей.
Подсказка: б.\ (\ ce {NaCl} \) раствор
Обычно используется солевой раствор, но подойдут и растворы кислот и щелочей. \ (\ ce {NaCl} \) раствор экономичен и прост в обращении.
Подсказка: e.поваренная соль
Навык:
Различают сильные и слабые электролиты.
Подсказка: ок.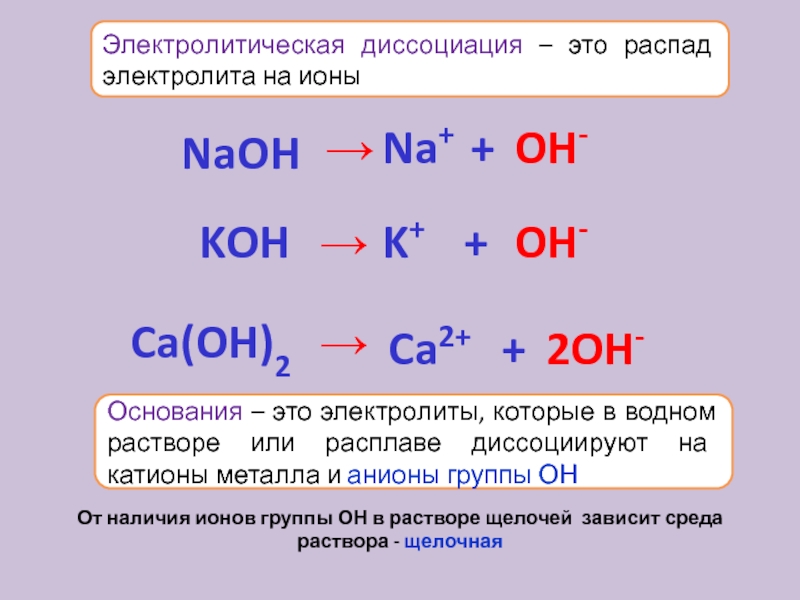 вода низкой температуры
вода низкой температуры
См. PH.
Навык:
Определение и оценка pH.
См. Редокс.
Навык:
Объяснять реакции метатезиса.
Растворы электролитов и неэлектролитов | Введение в химию
Цель обучения
Ключевые моменты
Условия
Растворы электролитов
Электролит — это любая соль или ионизируемая молекула, которая при растворении в растворе придает этому раствору способность проводить электричество. Это потому, что когда соль растворяется, ее диссоциированные ионы могут свободно перемещаться в растворе, позволяя заряду течь.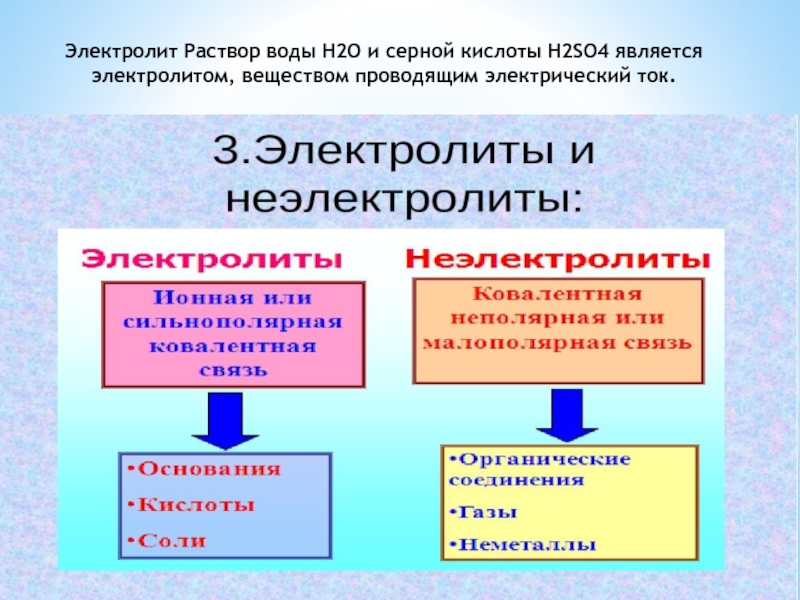
Растворы электролитов обычно образуются, когда соль помещается в растворитель, такой как вода.Например, когда поваренная соль NaCl помещается в воду, соль (твердое вещество) растворяется на составляющие ионы в соответствии с реакцией диссоциации:
NaCl ( с ) → Na + ( водн. ) + Cl — ( водн. )
Вещества также могут реагировать с водой с образованием ионов в растворе. Например, углекислый газ, CO2, растворяется в воде с образованием раствора, содержащего ионы водорода, карбонат и ионы гидрокарбоната:
2 CO 2 ( г ) + 2 H 2 O ( л ) → 3 H + ( водн. ) + CO 3 2- ( водн. ) + HCO 3 — ( водн. )
Полученный раствор будет проводить электричество, потому что он содержит ионы.Однако важно помнить, что CO 2 — это , а не электролит, потому что CO 2 сам по себе не диссоциирует на ионы. Только соединения, которые в растворе диссоциируют на составляющие ионы, считаются электролитами.
Только соединения, которые в растворе диссоциируют на составляющие ионы, считаются электролитами.
Сильные и слабые электролиты
Как упоминалось выше, когда ионизируемое растворенное вещество диссоциирует, полученный раствор может проводить электричество. Поэтому соединения, которые легко образуют ионы в растворе, известны как сильные электролиты .(По этой причине все сильные кислоты и сильные основания являются сильными электролитами.)
Напротив, если соединение диссоциирует в небольшой степени, раствор будет слабым проводником электричества; соединение, которое только слабо диссоциирует, поэтому известно как слабый электролит.
Сильный электролит полностью распадается на составляющие ионы в растворе; С другой стороны, слабый электролит останется в растворе в основном недиссоциированным. Примером слабого электролита является уксусная кислота, которая также является слабой кислотой.
Gatorade как раствор электролита Спортивный напиток Gatorade рекламирует, что он содержит электролиты, поскольку он содержит ионы натрия, калия, магния и других веществ.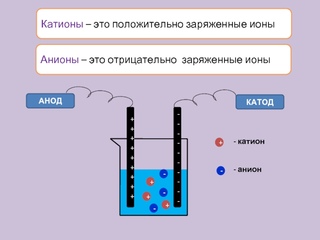 Когда люди потеют, мы теряем ионы, необходимые для жизненно важных функций организма; чтобы восполнить их, нам нужно потреблять больше ионов, часто в виде раствора электролита. В организме человека электролиты имеют множество применений, в том числе помогают нейронам проводить электрические импульсы.
Когда люди потеют, мы теряем ионы, необходимые для жизненно важных функций организма; чтобы восполнить их, нам нужно потреблять больше ионов, часто в виде раствора электролита. В организме человека электролиты имеют множество применений, в том числе помогают нейронам проводить электрические импульсы.
Растворы безэлектролитов
Неэлектролиты — это соединения, которые совсем не ионизируются в растворе.В результате растворы, содержащие неэлектролиты, не будут проводить электричество. Обычно неэлектролиты в основном удерживаются вместе ковалентными, а не ионными связями. Типичным примером неэлектролита является глюкоза, или C 6 H 12 O 6 . Глюкоза (сахар) легко растворяется в воде, но, поскольку она не диссоциирует на ионы в растворе, считается неэлектролитом; поэтому растворы, содержащие глюкозу, не проводят электричество.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.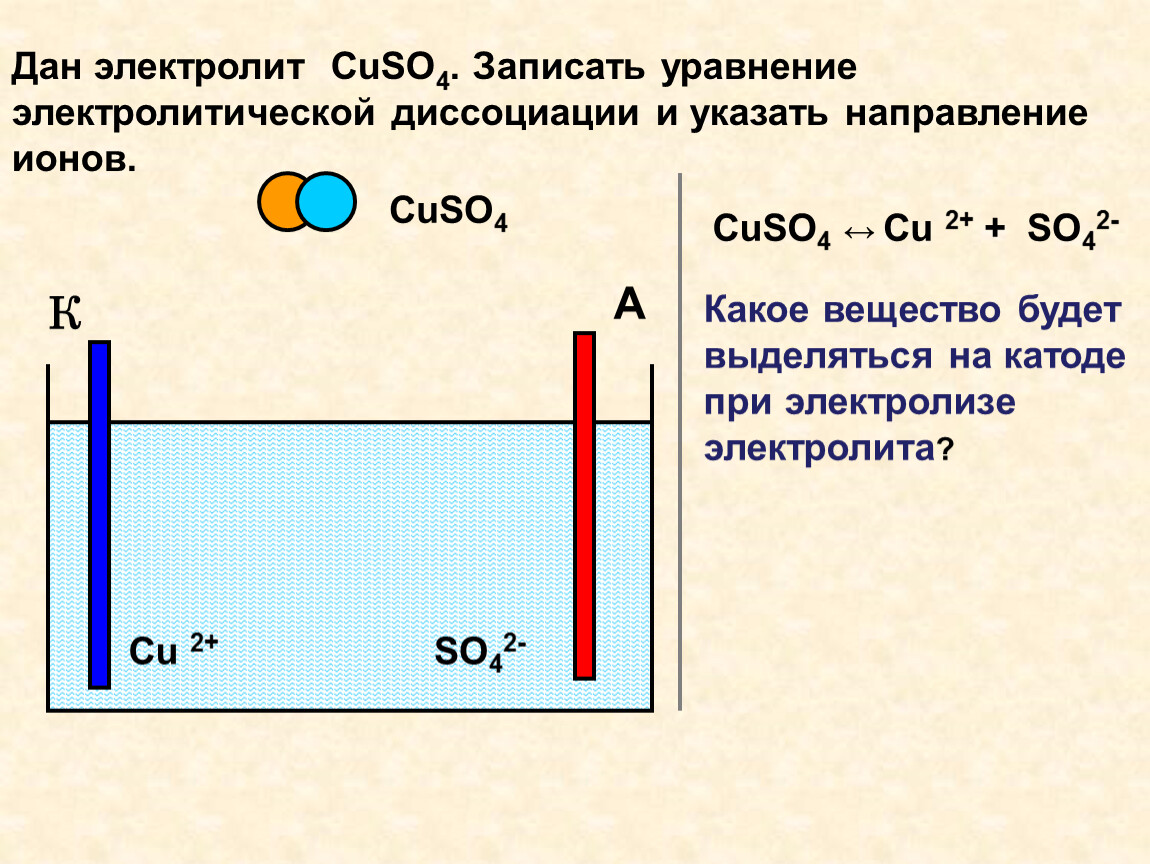 Этот конкретный ресурс использовал следующие источники:
Этот конкретный ресурс использовал следующие источники:
Электролиты и неэлектролиты | Химия для неосновных
Цели обучения
Почему бегуны беспокоятся о потере электролитов?
Миллионы людей в мире бегают трусцой для физических упражнений. По большей части бег трусцой может быть здоровым способом оставаться в форме.Однако проблемы могут возникнуть и у тех, кто бегает трусцой в жару. Чрезмерное потоотделение может привести к потере электролитов, что может быть опасным для жизни. Ранние симптомы дефицита электролитов могут включать тошноту, фатугу и головокружение. Если не лечить, люди могут испытывать мышечную слабость и учащенное сердцебиение (что может привести к сердечному приступу). Многие спортивные напитки можно употреблять для быстрого восстановления электролитов в организме.
Электролиты и неэлектролиты
Электролит — это соединение, которое проводит электрический ток, когда оно находится в водном растворе или расплавлено. Чтобы проводить ток, вещество должно содержать подвижные ионы, которые могут перемещаться от одного электрода к другому. Все ионные соединения являются электролитами. Когда ионные соединения растворяются, они распадаются на ионы, которые затем могут проводить ток (проводимость , проводимость ). Даже нерастворимые ионные соединения, такие как CaCO 3 , являются электролитами, поскольку они могут проводить ток в расплавленном (расплавленном) состоянии.
Чтобы проводить ток, вещество должно содержать подвижные ионы, которые могут перемещаться от одного электрода к другому. Все ионные соединения являются электролитами. Когда ионные соединения растворяются, они распадаются на ионы, которые затем могут проводить ток (проводимость , проводимость ). Даже нерастворимые ионные соединения, такие как CaCO 3 , являются электролитами, поскольку они могут проводить ток в расплавленном (расплавленном) состоянии.
Неэлектролит представляет собой соединение, которое не проводит электрический ток ни в водном растворе, ни в расплавленном состоянии.Многие молекулярные соединения, такие как сахар или этанол, не являются электролитами. Когда эти соединения растворяются в воде, они не производят ионы. Рисунок ниже иллюстрирует разницу между электролитом и неэлектролитом.
Рисунок 1. Прибор для измерения проводимости. От фонда CK-12 — Кристофер Ауён
Роль электролитов в организме
Некоторые электролиты играют важную роль в организме. Вот несколько важных электролитов:
Вот несколько важных электролитов:
Сводка
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
Обзор
Глоссарий
Выгодно или нет? — Основы здоровья от клиники Кливленда
В неоновом спорте и электролите недостатка нет.
напитки, утверждающие, что они улучшают физическую работоспособность и помогают восстановиться.Ли
вы пьете эти напитки, потому что у вас только что была интенсивная тренировка или вы
побороть грипп — действительно ли польза для здоровья окупается?
Клиника Кливленда — некоммерческий академический медицинский центр. Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic.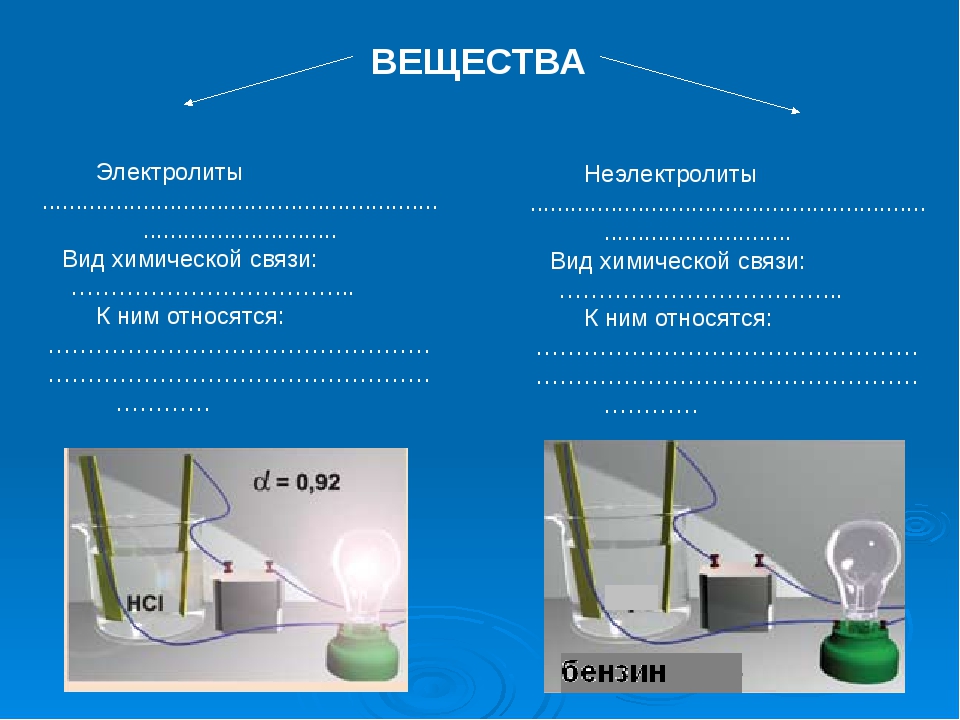 Политика
Политика
Согласно зарегистрированному диетологу Кейт Паттон, мед.
CCSD, LD, есть время и место для электролитных напитков.
Что такое электролиты и для чего они нужны?
Электролиты — это минералы, обнаруженные в вашей крови, которые помогают регулировать
и контролировать баланс жидкостей в организме. Эти минералы играют роль в
регулирование артериального давления, сокращение мышц и поддержание функционирования вашей системы
должным образом.
Три основных электролита:
Правильное количество электролитов в организме необходимо для оптимального здоровья и физической работоспособности.
Если вы потеряете значительное количество этих минералов (в результате интенсивных упражнений, потоотделения, рвоты или диареи), вы испытаете обезвоживание и почувствуете себя довольно паршиво.Вы также можете испытывать мышечные спазмы и спазмы.
Сигнал обезвоживания
Большинство из нас почувствовали последствия обезвоживания в один
точка или другое — сухость губ и языка, головная боль, слабость, головокружение, тошнота, судороги.
Главный признак обезвоживания? Жажда.
Количество электролитов, которые вы теряете во время тренировки, зависит от веса, уровня физической подготовки, интенсивности, продолжительности активности, влажности и количества пота.
Основным электролитом, который мы теряем с потом, является натрий.
«Натрий иногда получает плохую репутацию, но он помогает нам удерживать
жидкости », — объясняет Паттон. «Когда вы потеете от упражнений или потеете от
лихорадка, вы теряете жидкость, а со временем это вызовет обезвоживание ».
Напитки с электролитом: на что обращать внимание
Электролитные напитки бывают самых разных форм — от таблеток.
что вы бросаете в воду, в порошки, которые вы смешиваете, в жидкость, которая поступает в
обычная бутылка с водой.
Однако не все напитки с электролитом одинаковы, поэтому Паттон рекомендует сначала прочитать этикетку.Если вы тренируетесь в течение часа или меньше, подойдут обычные h30. Но если вы тренируетесь более 75 минут или больше (или если на улице очень жарко), то пить с электролитом — хорошая идея во время или после тренировки.
Но если вы тренируетесь более 75 минут или больше (или если на улице очень жарко), то пить с электролитом — хорошая идея во время или после тренировки.
Типичный напиток с электролитом на 8 унций содержит примерно 14 граммов сахара, 100 миллиграммов натрия и 30 миллиграммов калия. Существуют даже специальные электролитные напитки для выносливых и сверхвыносливых спортсменов с большим содержанием калия и натрия, а также с дополнительными минералами, такими как магний и кальций.
Если у вас от природы толстый свитер или вы хотите пополнить запасы
гидратация после того, как вы заболели, сосредоточьтесь на выборе нулевого или низкокалорийного
варианты, говорит Паттон.
Еще она рекомендует читать этикетки на иммунных и витаминных напитках. В некоторых из этих вариантов не обязательно должны быть электролиты, поэтому они мало что сделают для восполнения гидратации.
Можно ли использовать кокосовую воду в качестве спортивного напитка?
Хотя кокосовая вода по составу питательных веществ аналогична традиционным спортивным напиткам, она существенно отличается.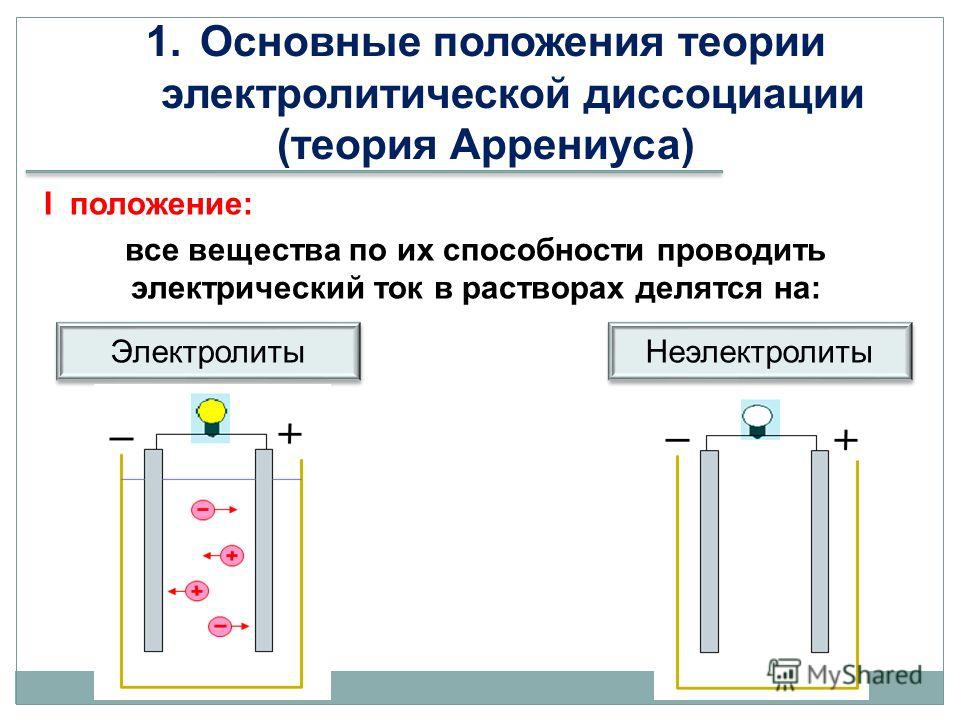 Несладкие или оригинальные вкусы содержат меньше углеводов и меньше натрия, которые являются ключевыми питательными веществами, необходимыми для длительных тренировок.
Несладкие или оригинальные вкусы содержат меньше углеводов и меньше натрия, которые являются ключевыми питательными веществами, необходимыми для длительных тренировок.
Если вы ищете полностью натуральную ароматную альтернативу традиционной воде, стоит попробовать кокосовую воду. Но имейте в виду, что кокосовая вода содержит больше калорий по сравнению с бескалорийной водопроводной водой, и по возможности выбирайте несладкую версию. Для спортсменов, которым требуется гидратация во время или после длительной тренировки, традиционный спортивный напиток — лучший выбор, чтобы обеспечить надлежащее увлажнение для максимальной производительности и восстановления.
«Кокосовая вода может быть хорошим вариантом, если вы ищете напиток с более натуральным электролитом», — говорит Паттон. «Просто помните о добавленном сахаре и сначала прочтите этикетку».
Определение: электролит | Информация об открытой энергии
Вещество, которое проводит заряженные ионы от одного электрода к другому в топливном элементе, батарее или электролизере.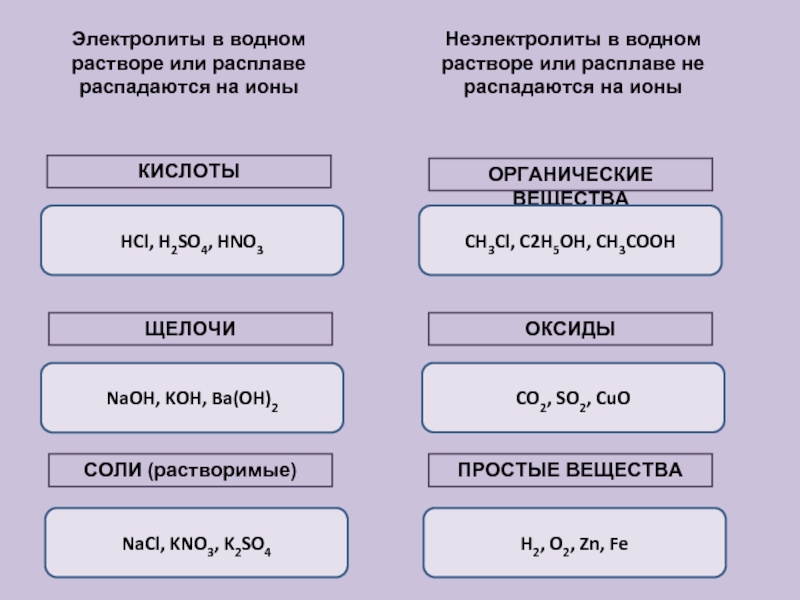 [1]
[1]
Определение Википедии
Reegle Определение
Список литературы
Концентрация электролита — обзор
2.3.4 Гидратация в концентрированных растворах
По мере увеличения концентрации электролита количество молекул воды во вторичной гидратной сфере уменьшается. Следовательно, происходит усиление связи между катионом металла и гидратными водами во внутренней сфере (Choppin, Jensen, 2006). Основываясь на исследованиях ЯМР трехвалентных актинидов и лантаноидов, Чоппин пришел к выводу, что комплексообразование внутренней сферы перхлорат-ионами не происходит ниже примерно 8–10 М (Choppin, Labonne-Wall, 1997).Множественные равновесия для системы уранилхлорида (UO 2 Cl 2 (H 2 O) 2 , UO 2 Cl 3 (H 2 O) — и UO 2 Cl 4 2– ) использовались для отделения урана от его дочерних продуктов или других металлов. Поскольку Th 4 + не образует анионных хлоридных комплексов, он удерживается на катионообменной смоле, в то время как анионные хлоридные комплексы UO 2 2 + проходят через колонку в элюате.Альтернативно такие анионные комплексы можно удерживать на анионообменной колонке.
Число гидратации Eu (III) остается относительно постоянным в соляной кислоте примерно до 6–8 M, выше которой концентрация уменьшается. То же самое верно и для числа гидратации Cm (III) в HCl, которое начинает снижаться примерно при 5 M HCl. Эта разница между (Eu 3 + и Cm 3 + ) отражает большее комплексообразование трехвалентного иона актинида с относительно мягким анионом Cl —.Разница в комплексообразовании хлоридов использовалась для обеспечения эффективного отделения трехвалентных актинидов от трехвалентных актинидов в концентрированных растворах HCl путем пропускания через колонки с катионообменной смолой с 1950-х годов (Diamond et al., 1954).
Нитратные комплексы для четырехвалентных актинидов, например Th 4 + и Pu 4 + , чрезвычайно важны в процессах разделения и очистки актинидов. Нитрат-ионы начинают образовывать комплексы внутренней сферы при более низких концентрациях, чем хлорид-анионы; это наблюдение подтверждается уменьшением числа гидратации катиона даже при относительно более низких концентрациях (Choppin, Jensen, 2006).Однако, поскольку атомы кислорода нитрата являются твердыми донорами, нет никаких доказательств какого-либо ковалентного усиления его связывания, как это видно с анионами хлорида для трехвалентных катионов актинидов по сравнению с катионами лантанидов (Choppin, Jensen, 2006). В процессах разделения и очистки чрезвычайно важны нитратные комплексы актинидов. Раствор нитрат-азотной кислоты является наиболее распространенной водной средой в процессах разделения ядер. В случае нейтральных экстрагентов, таких как трибутилфосфат (TBP), карбамоилметилфосфиноксид (CMPO) или дипиколинамиды (DPA), он обеспечивает нитратные единицы, необходимые для компенсации заряда катионов актинидов для обеспечения экстракции.Комплексообразование нитрата с шестивалентными ионами актинида происходит очень слабо, и определение констант образования для разновидностей водного раствора нитрата является чрезвычайно трудным. В водных условиях с высокими концентрациями азотной кислоты комплексы формы AnO 2 (NO 3 ) (H 2 O) x + , AnO 2 (NO 3 ) 2 (H 2 O) 2 и AnO 2 (NO 3 ) 3 — (An = U, Np, Pu), вероятно, будут присутствовать.Лимитирующим веществом в ряду нитратов является комплекс гексанитрато, An (NO 3 ) 6 2– (Matonic et al., 2002). Известно комплексообразование пятивалентных ионов Pa и Np нитратом; однако доступны ограниченные термодинамические и структурные данные. Предполагаемая стехиометрия для разновидностей Np (V) — NpO 2 (NO 3 ) (H 2 O) x . Для протактиния, который легко гидролизуется, были предложены смешанные гидроксо / нитрато- или оксо / нитрато-комплексы.
Фториды и хлориды являются наиболее изученными актино-галогенидными системами, и они очень важны для процессов пирообработки и электрорафинирования.
Карбоновые кислоты прочно связаны с ионами актинидов. Первичный способ связывания простых карбоновых кислот — бидентатный, тогда как в комплексах поликарбоновых кислот карбоксилаты имеют тенденцию к монодентатной координации с ионом металла. Сродство низковалентных актинидов к этим лигандам увеличивается с увеличением дентальности лиганда, например, этилендиаминтетраацетата (ЭДТА) >>> ацетата.


 Поступать наоборот — вливать воду в кислоту — недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны.
Поступать наоборот — вливать воду в кислоту — недопустимо. В этом случае в результате выделяемого при смешивании тепла образуются капельки кислоты, которые начинают брызгать в разные стороны.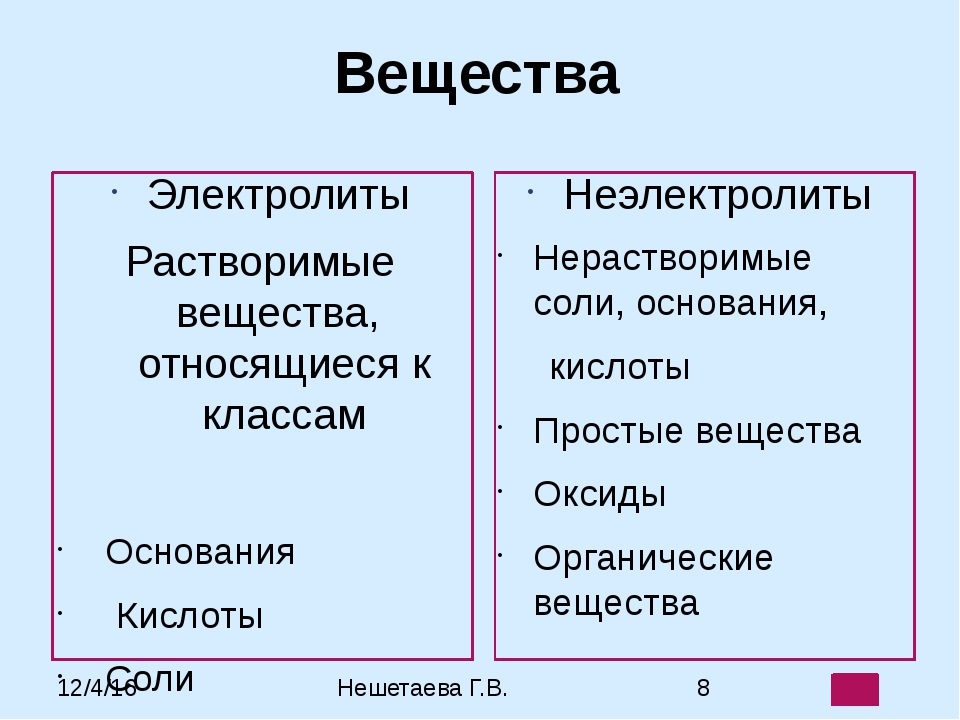



 Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов.
Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.Это то, чего жаждут растения. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки).
Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.Это то, чего жаждут растения. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такое решение нейтрально, но может включать продажу младенцев. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток.Это включает большинство растворимых солей, кислот и оснований. Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы.
Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такое решение нейтрально, но может включать продажу младенцев. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток.Это включает большинство растворимых солей, кислот и оснований. Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество.Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора будут притягиваться к электроду, который имеет большое количество электронов, в то время как анионы притягиваются к электроду, который имеет дефицит электронов.
Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество.Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов. В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора будут притягиваться к электроду, который имеет большое количество электронов, в то время как анионы притягиваются к электроду, который имеет дефицит электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки).
Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. == Этимология == پپپ Слово электролит происходит от древнегреческого ήλεκτρο- (ēlectro-), приставки, относящейся к электричеству, и λυτός (lytos), что означает «способный развязываться или ослаблять» بپپپپپپاپ.منم و م
Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор.Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал, катионы раствора притягиваются к электроду, который имеет большое количество электронов, а анионы притягиваются к электроду с дефицитом электронов. Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований.Некоторые газы, такие как хлористый водород (HCl), в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут быть результатом растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых «полиэлектролитами», которые содержат заряженные функциональные группы. Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций, магний и фосфат являются примерами электролитов.В медицине замена электролитов необходима при длительной рвоте или диарее, а также в ответ на тяжелую спортивную деятельность. Доступны коммерческие растворы электролитов, особенно для больных детей (например, раствор для пероральной регидратации, Suero Oral или Pedialyte) и спортсменов (спортивные напитки). Мониторинг электролитов важен при лечении анорексии и булимии. == Этимология == پپپ Слово электролит происходит от древнегреческого ήλεκτρο- (ēlectro-), приставки, относящейся к электричеству, и λυτός (lytos), что означает «способный развязываться или ослаблять» بپپپپپپاپ.منم و م