Какая температура кипения воды: При какой температуре кипит вода: все зависит от нескольких факторов
Содержание
При какой температуре кипит вода: все зависит от нескольких факторов
«При какой температуре закипает вода?» знает каждый – при достижении отметки в 100 градусов по шкале Цельсия. Эта информация отложилась в голове каждого человека. Например, из школьного курса физики. Ведь не могла же появится какая-то новая вода, что кипит по-другому?
Однако не все так просто – кипение при указанной температуре возможно лишь при так называемых идеальных условиях. То есть, если атмосферное давление достигает 760 миллиметров ртутного столба или колеблется около этой отметки, а в ней нет излишнего количества различных примесей, например, соли.
Кипение соленой воды
Для кипячения соленой воды ее необходимо нагревать до более высокой температуры, что обусловлено высоким содержанием солей Na+ и Cl-, заполняющих часть пространства между молекулами воды. Это приводит к нарушению связей между природными молекулами воды, что препятствует их нагреванию и приводит к более высокой температуре кипения.
То есть, чтобы накипятить соленую воду, понадобится несколько больше энергии – все зависит от общего объема содержания солей. Так, в один литр воды достаточно добавить примерно 60 грамм соли, чтобы температура кипения жидкости увеличилась на 10 градусов по шкале Цельсия.
Кстати, и парообразование соленой воды значительно ниже. Так, при нагревании молекулы начинают двигаться быстрее, но наличие соли приводит к тому, что они сталкиваются друг с другом намного реже, чем в пресной жидкости, а это, в свою очередь, снижает количество появляющегося пара.
А если в горах?
Теперь поговорим о том, при какой температуре кипит вода в горах. Там этот показатель также отличен от 100 градусов, поскольку, как говорилось в начале статьи, многое зависит от атмосферного давления. Как известно, в горах оно значительно ниже. А чем ниже давление, тем и ниже температура кипения воды.
Так, опытные альпинисты знают, что на разных высотах относительно уровня моря и температура кипения разная:
- при 500 метрах – 98,3 градусов;
- при 1000 метрах – 96,7 градусов;
- при 2000 метрах – 93,3 градусов;
- при 3000 метрах – 90 градусов;
- при 4000 метрах – 86,7 градусов;
- при 6000 метрах – 80 градусов.

Приведенные примерные расчеты могут несколько изменяться в зависимости от наличия в воде определенных примесей и добавок. Естественно, нелетучих, то есть тех, что не испаряются при нагревании воды.
Подводя итог
Теперь вы знаете температуру кипения воды при различных условиях. Надеемся, у вас вода только чистая, а потому на закипании не будут сказываться различные примеси. Если же вы берете ее из коммунального трубопровода или частной, непроверенной скважины, рекомендуем установить соответствующие очистительное оборудование.
Специалисты компании FILTER.UA помогут вам выбрать идеальный фильтр для очистки воды, гарантированно справляющийся с теми или иными примесями и загрязнителями, негативно отражающимися на вкусе воды и вашем здоровье!
ТЕМПЕРАТУРА КИПЕНИЯ | Энциклопедия Кругосвет
ТЕМПЕРАТУРА КИПЕНИЯ (точка кипения) – температура, при которой жидкость столь интенсивно превращается в пар (т.е. газ), что в ней образуются паровые пузырьки, которые поднимаются на поверхность и лопаются. Бурное образование пузырьков во всем объеме жидкости и называется кипением.
Бурное образование пузырьков во всем объеме жидкости и называется кипением.
В отличие от простого испарения при кипении жидкость переходит в пар не только со свободной поверхности, но и по всему объему – внутрь образующихся пузырьков. Температура кипения любой жидкости постоянна при заданном атмосферном или ином внешнем давлении, но повышается с повышением давления и понижается с его понижением. Например, при нормальном атмосферном давлении, равном 100 кПа (таково давление на уровне моря), температура кипения воды составляет 100° С.
На высоте же 4000 м над уровнем моря, где давление падает до 60 кПа, вода кипит примерно при 85° С, и для того, чтобы сварить пищу в горах, требуется больше времени. По той же причине пища готовится быстрей в кастрюле-«скороварке»: давление в ней повышается, а вслед за этим повышается и температура кипящей воды.
Температура кипения вещества зависит также от наличия примесей. Если в жидкости растворено летучее вещество, то температура кипения раствора понижается. И наоборот, если в растворе содержится вещество менее летучее, чем растворитель, то температура кипения раствора будет выше, чем у чистой жидкости.
Если в жидкости растворено летучее вещество, то температура кипения раствора понижается. И наоборот, если в растворе содержится вещество менее летучее, чем растворитель, то температура кипения раствора будет выше, чем у чистой жидкости.
ТЕМПЕРАТУРА КИПЕНИЯ НЕКОТОРЫХ ВЕЩЕСТВ (на уровне моря) | |
Вещество | Температура, °С |
| Вода | 100 |
| Золото | 2600 |
| Изопропиловый спирт | 82,3 |
| Метиловый спирт | 64,7 |
| Морская вода | 100,7 |
| Ртуть | 356,9 |
| Серебро | 1950 |
| Этиленгликоль | 197,2 |
| Этиловый спирт | 78,3 |
| Эфир | 34,6 |
См. также ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ; ТЕПЛОТА; ЖИДКОСТЕЙ ТЕОРИЯ.
также ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ; ТЕПЛОТА; ЖИДКОСТЕЙ ТЕОРИЯ.
Проверь себя!
Ответь на вопросы викторины «Физика»
Что такое изотоп, чему равно число Авогадро и что изучает наука реология?
Зависимость температуры кипения воды от высоты над уровнем моря
После создания пары калькуляторов на тему давления вообще (Конвертер единиц давления) и атмосферного давления в частности (Барометрическое нивелирование), захотелось узнать, как рассчитать температуру кипения воды в зависимости от высоты. Я откуда-то знал, что на высоте вода кипит при температуре ниже 100°С — а вот при какой точно температуре она кипит — вопрос.
Задача состоит из двух этапов — установить зависимость атмосферного давления от высоты и зависимость температуры кипения от давления. Начнем с последнего, как с более интересного.
Кипение представляет собой фазовый переход первого рода (вода сменяет агрегатное состояние из жидкого на газообразное).
Фазовый переход первого рода описывается уравнением Клапейрона:
,
где
— удельная теплота фазового перехода, которая численно равна количеству теплоты сообщаемой единице массы вещества для осуществления фазового перехода,
— температура фазового перехода,
— изменение удельного объема при переходе
Клаузиус упростил уравнение Клапейрона для случаев испарения и возгонки, предположив, что
- Пар подчиняется закону идеального газа
- Удельный объем жидкости много меньше удельного объема пара
Из пункта один следует, что состояние пара можно описать уравнением Менделеева-Клапейрона
,
а из пункта два — что удельным объемом жидкости можно пренебречь.
Таким образом, уравнение Клапейрона принимает вид
,
где удельный объем можно выразить через
,
и окончательно
разделяя переменные, получим
Проинтегрировав левую часть от до , а правую от до , т.е. от одной точки до другой точки , лежащей на линии равновесия жидкость-пар, получим уравнение
называемое уравнением Клаузиуса-Клапейрона.
Собственно, это и есть искомая зависимость температуры кипения от давления.
Проведем еще пару преобразований
,
здесь
— молярная масса воды, 18 г/моль
— универсальная газовая постоянная, 8.31 Дж/(моль × К)
— удельная теплота испарения воды 2.3 × 106 Дж/кг
Теперь осталось установить зависимость атмосферного давления от высоты. Здесь мы воспользуемся барометрической формулой (другой у нас все равно нет):
или
,
здесь
— молярная масса воздуха, 29 г/моль
— универсальная газовая постоянная, 8.31 Дж/(моль×К)
— ускорение силы тяжести, 9. 81 м/(с×с)
81 м/(с×с)
— температура воздуха
Значения, относящиеся к воздуху, пометим индексом v, к воде — h
Приравняв и избавившись от экспоненты, получим
Ну и итоговая формула
На самом деле реальное давление воздуха не следует барометрической формуле, так как при больших перепадах высот температуру воздуха нельзя считать постоянной. Кроме того, ускорение свободного падения зависит от географической широты, а атмосферное давление — еще и от концентрации паров воды. То есть значение по этой формуле мы получим приближенное. Поэтому ниже я включил еще один калькулятор, который использует использует формулу для расчет температуры кипения в зависимости от давления воздуха в миллиметрах ртутного столба.
Калькулятор зависимости температуры кипения от высоты:
Зависимость температуры кипения воды от высоты над уровнем моря
Высота (метры)
Температура воздуха (Цельсий)
Точность вычисления
Знаков после запятой: 1
Температура кипения
content_copy Ссылка save Сохранить extension Виджет
Калькулятор зависимости температуры кипения от давления:
Зависимость температуры кипения воды от давления
Точность вычисления
Знаков после запятой: 1
Температура кипения
content_copy Ссылка save Сохранить extension Виджет
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Физический справочник / / Тепловые величины: теплоемкость, теплопроводность, температуры кипения, плавления, пламени. Удельные теплоты сгорания и парообразования. Термические константы. Коэффициенты теплообмнена и расширения / / Температуры, кипения, плавления, прочие… Перевод единиц измерения температуры. Воспламеняемость. / / Температуры кипения = температуры конденсации / / Температура кипения воды в зависимости от высоты над уровнем моря. Таблица от -305 до 9144 м, в °C и °F Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
От чего зависит кипение воды
Чтобы приготовить различные вкусные блюда, часто необходима вода, и, если ее нагревать, то она рано или поздно закипит. Каждый образованный человек при этом знает, что вода начинает кипеть при температуре, равной ста градусам Цельсия, и при дальнейшем нагревании ее температура не меняется. Именно это свойство воды используется в кулинарии. Однако далеко не всем известно, что это бывает не всегда так. Вода может закипать при разной температуре в зависимости от условий, в которых она находится. Давайте попробуем разобраться, от чего зависит температура кипения воды, и как это нужно использовать.
При нагревании температура воды приближается к температуре кипения, и по всему объему образуются многочисленные пузырьки, внутри которых находится водяной пар. Плотность пара меньше, чем плотность воды, поэтому сила Архимеда, действующая на пузырьки, поднимает их на поверхность. При этом объем пузырьков то увеличивается, то уменьшается, поэтому закипающая вода издает характерные звуки. Достигая поверхности, пузырьки с водяным паром лопаются, по этой причине кипящая вода интенсивно булькает, выпуская водяной пар.
При этом объем пузырьков то увеличивается, то уменьшается, поэтому закипающая вода издает характерные звуки. Достигая поверхности, пузырьки с водяным паром лопаются, по этой причине кипящая вода интенсивно булькает, выпуская водяной пар.
Температура кипения в явном виде зависит от давления, оказываемого на поверхность воды, что объясняется зависимостью давления насыщенного пара, находящегося в пузырьках, от температуры. При этом количество пара внутри пузырьков, а вместе с этим и их объем, увеличиваются до тех пор, пока давление насыщенного пара не будет превосходить давление воды. Это давление складывается из гидростатического давления воды, обусловленного гравитационным притяжением к Земле, и внешнего атмосферного давления. Поэтому температура кипения воды увеличивается при возрастании атмосферного давления и уменьшается при его уменьшении. Только в случае нормального атмосферного давления 760 мм.рт.ст. (1 атм.) вода кипит при 1000С. График зависимости температуры кипения воды от атмосферного давления представлен ниже:
Из графика видно, что если увеличить атмосферное давление до 1,45 атм, то вода будет кипеть уже при 1100С.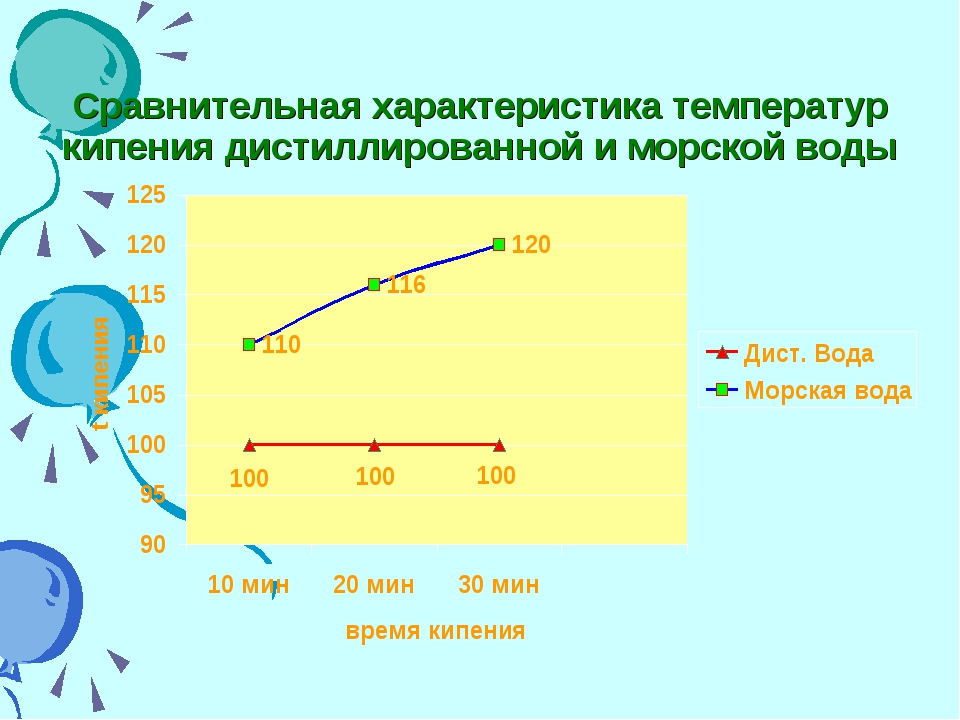 При давлении воздуха 2,0 атм. вода закипит при 1200С и так далее. Увеличение температуры кипения воды может быть использовано для ускорения и улучшения процесса приготовления горячих блюд. Для этого изобрели скороварки – кастрюли с особой герметично закрывающейся крышкой, снабженные специальными клапанами для регулирования температуры кипения. Из-за герметичности давление в них повышается до 2-3 атм., что обеспечивает температуру кипения воды 120-1300С. Однако при этом нужно помнить, что использование скороварок сопряжено с опасностью: пар, выходящий из них, имеет большое давление и высокую температуру. Поэтому нужно быть максимально осторожными, чтобы не получить ожог.
При давлении воздуха 2,0 атм. вода закипит при 1200С и так далее. Увеличение температуры кипения воды может быть использовано для ускорения и улучшения процесса приготовления горячих блюд. Для этого изобрели скороварки – кастрюли с особой герметично закрывающейся крышкой, снабженные специальными клапанами для регулирования температуры кипения. Из-за герметичности давление в них повышается до 2-3 атм., что обеспечивает температуру кипения воды 120-1300С. Однако при этом нужно помнить, что использование скороварок сопряжено с опасностью: пар, выходящий из них, имеет большое давление и высокую температуру. Поэтому нужно быть максимально осторожными, чтобы не получить ожог.
Обратный эффект наблюдается, если атмосферное давление понижается. В этом случае температура кипения тоже уменьшается, что и происходит при увеличении высоты над уровнем моря:
|
Высота над уровнем моря, м
|
0
|
300
|
1000
|
2000
|
3000
|
4000
|
6000
|
8000
|
|---|---|---|---|---|---|---|---|---|
|
Атмосферное давление, Па
|
101325,69
|
98066,50
|
88259,85
|
78453,20
|
68646,55
|
58839,90
|
49033,25
|
39226,60
|
|
Температура кипения воды
|
100,0
|
99,09
|
96,18
|
92,99
|
89,45
|
85,45
|
80,86
|
75,42
|
В среднем, при подъеме на 300 м температура кипения воды уменьшается на 10С и достаточно высоко в горах опускается до 800С, что может привести к некоторым трудностям в приготовлении еды.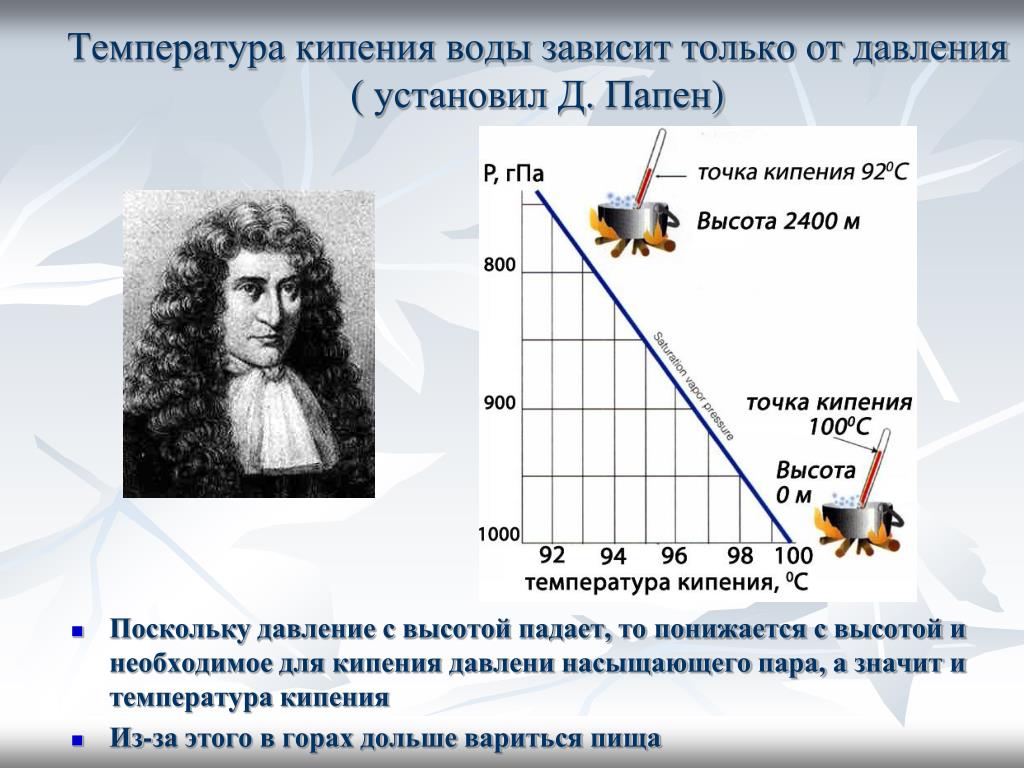
Если же дальше уменьшать давление, например, откачивая воздух из сосуда с водой, то при давлении воздуха 0,03 атм. вода будет кипеть уже при комнатной температуре, и это достаточно необычно, так как привычная температура кипения воды – 1000С.
Автор: Матвеев К.В., методист ГМЦ ДО г. Москвы
Как кипит вода в различных состояниях и условиях
Кипение — способ образования пара, происходящий при определенных значениях температуры и атмосферного давления. Изменение одного из этих условий ведет к коррекции другого. Известно, что обычно вода закипает при +100?С. При создании же вакуума, например, в специальных сушильных шкафах, этот показатель снижается и при 100 мбар составляет всего +46?С.
Как происходит кипение?
При нагреве на дне и стенках посуды с водой появляются пузырьки пара. Температура в них значительно выше, чем в остальной жидкости, а давление ниже. Когда оно становится одинаковым и внутри, и снаружи, вода начинает кипеть.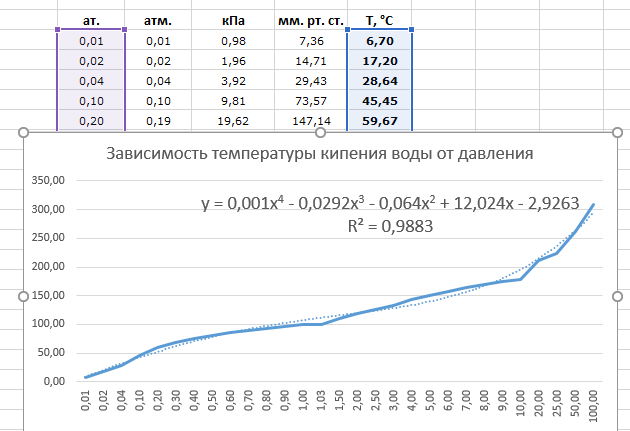 Во время этого процесса, несмотря на продолжающийся нагрев, температура жидкости мало изменяется. Кипение продолжается, пока вся она не обратится в пар.
Во время этого процесса, несмотря на продолжающийся нагрев, температура жидкости мало изменяется. Кипение продолжается, пока вся она не обратится в пар.
Что происходит с изменением давления?
При повышении этого показателя, соответственно, увеличивается и температура. Так, в герметично закрытой пароварке кипение происходит при +120?С.
Понижение атмосферного давления в естественных условиях можно наблюдать при восхождении в горы. На высоте 6000 метров температура кипения воды составляет +80?. Заварить чай там довольно сложно. Зато в подземной шахте кипяток будет более горячий, чем где-либо еще.
Вакуум
Дальнейшее снижение давления естественным путем невозможно, но оно достигается в лабораторных условиях. Такая разреженная среда называется вакуум. При давлении в нем 0,001 атмосфер вода закипит при температуре +6,7?. Эти свойства используются в работе вакуумных сушильных шкафов. В условиях герметизации и отсутствия воздуха удаление остатков влаги из продуктов происходит при более низкой температуре, что позволяет сохранить в них полезные вещества.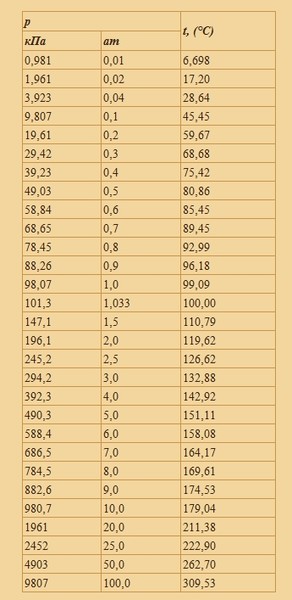
Космос
Здесь кипячение выглядит по-другому. При повышении температуры жидкость не поднимается к поверхности, а остается на дне и продолжает нагреваться дальше. Вода, более удаленная от источника тепла, изменяется мало. Формирующиеся пузырьки пара не поднимаются на поверхность, а объединяются в один большой, который колышется в жидкости.
Кипение воды | Вода для Вас
Вода используется не только для питья. С ее помощью можно приготовить множество вкусных блюд. При нагревании жидкость закипает и именно этот эффект используется для приготовления пищи. Если температура достигает 100°С, вода начинает кипеть и последующее ее кипячение не меняет температуру. Наша компания специализируется на такой услуге, как доставка воды в баллонах 19 литров и дополнительных товаров в виде кулеров и помп жителям Щелково, Мытищ, Пушкино, Балашихи, Королева и Ивантеевки.
Достигая температуры кипения, на водной поверхности появляются пузырьки с водяным паром внутри. Из-за меньшей плотности пара, под действием архимедовой силы, происходит выталкивание пузырьков наверх. Достигая поверхности, пузырьки лопаются издавая характерный звук в виде бульканья.
Достигая поверхности, пузырьки лопаются издавая характерный звук в виде бульканья.
Однако вода может закипать и при других температурах
На этот показатель влияют условия ее пребывания. Давление атмосферы на водную поверхность может изменять температуру кипения и при низком давлении пузырьки появляются до того как вода достигнет 100°С. Такой эффект усложняет приготовление пищи и, к примеру, картофель высоко в горах сварить невозможно, так как для горной местности характерно низкое давление, которое уменьшает температуру кипения воды. При увеличении атмосферного давления вода будет закипать при большей температуре.
Кипение является сложным процессом
Различают четыре стадии кипения. Если взять открытый стеклянный сосуд с водой и нагревать его, то через время:
- дно сосуда и его стенки покроются мелкими пузырьками воздуха, которые можно будет также наблюдать и на поверхности;
- пузырьки с насыщенным паром становятся больше и они начинают выходить на поверхность.
 Если сверху вода еще не прогрелась, то пузырьки будут опускаться вниз, а затем опять устремляться обратно к поверхности;
Если сверху вода еще не прогрелась, то пузырьки будут опускаться вниз, а затем опять устремляться обратно к поверхности; - водная поверхность покроется множеством пузырьков, из-за чего вода даже на короткое время чуть помутнеет, но затем снова будет прозрачной. Такой процесс назвали “кипение белым ключом”;
- начинается сильное бурление, что вызвано лопанием большого количества пузырьков и даже могут иметь место брызги. Последнее говорит о том, что жидкость перекипела.
В процессе кипения образуется большое количество пара из-за увеличения скорости выпаривания воды.
Если в воду добавить соль, то она закипит позже чем обычная пресная вода и температура кипения будет выше, а соответственно и энергии потребуется больше.
Человеку нужно ежедневно употреблять не менее 1,5 литров воды. Желательно, чтобы это была горная вода, насыщенная полезными элементами. Для этого можно воспользоваться услугой доставка воды.
12.09.2019
Меняется ли температура кипения воды с высотой? Американцы не уверены
СПОЙЛЕР ПРЕДУПРЕЖДЕНИЕ: Если вы еще этого не сделали, проверьте себя с помощью нашей новой викторины по научным знаниям. Обсудим один из ответов на вопросы ниже.
Обсудим один из ответов на вопросы ниже.
Это похоже на один из тех фундаментальных научных фактов: вода закипает при 212 градусах по Фаренгейту (100 градусам Цельсия), верно? Ну не всегда. Это зависит от того, где вы варите.
Фактически, вода в Денвере закипает при температуре около 202 градуса из-за более низкого давления воздуха на таких больших высотах.Согласно недавнему исследованию научных знаний исследовательского центра Pew Research Center, только 34% американцев знали, что вода кипит при более низкой температуре в Майл-Хай-Сити, чем в Лос-Анджелесе, который близок к уровню моря. На этот вопрос в нашей викторине правильно ответило меньшее количество людей: 26% сказали, что, по их мнению, вода в Денвере закипит при температуре выше , а 39% сказали, что она закипит при той же температуре в обоих местах.
Температура кипения воды или любой жидкости изменяется в зависимости от окружающего атмосферного давления.Жидкость закипает или начинает превращаться в пар, когда ее внутреннее давление пара сравняется с атмосферным давлением. Например, когда вы нагреваете чайник на плите, вы создаете больше водяного пара; когда давление водяного пара повышается достаточно, чтобы превысить давление окружающего воздуха, начинают образовываться пузырьки, и вода закипает.
Например, когда вы нагреваете чайник на плите, вы создаете больше водяного пара; когда давление водяного пара повышается достаточно, чтобы превысить давление окружающего воздуха, начинают образовываться пузырьки, и вода закипает.
Но давление падает по мере того, как вы набираете высоту — скажем, при поездке из Лос-Анджелеса в Денвер — потому что на вас давит меньше молекул воздуха. В Денвере атмосферное давление составляет всего около 12 фунтов на квадратный дюйм по сравнению с 14.7 фунтов на квадратный дюйм в Лос-Анджелесе. При гораздо меньшем давлении вам не нужно прикладывать столько тепла, чтобы давление пара превысило окружающее атмосферное давление — другими словами, вода закипает при более низкой температуре. Помещение жидкости в частичный вакуум также снизит ее температуру кипения. Причина та же: удаляя часть воздуха, окружающего жидкость, вы понижаете атмосферное давление в ней.
В Ла-Ринконада, шахтерском городке в перуанских Андах, который находится на высоте более 16 700 футов и является самым высоким постоянно заселенным городом в мире, вода кипит при температуре около 181 градуса.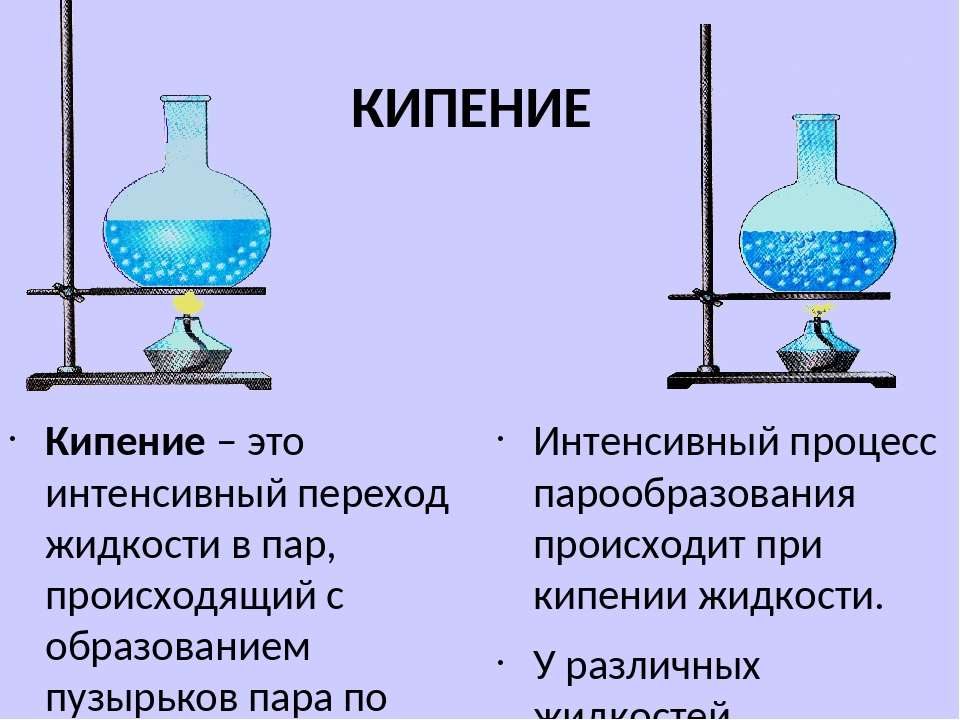 Если бы вы собирались заварить себе чашку хорошего чая на вершине Эвереста (29 029 футов), вам нужно было бы только довести воду до температуры около 162 градусов, чтобы она закипела. С другой стороны, в Долине Смерти, штат Калифорния, — самой низкой точке в США, на 282 футах ниже уровня моря — вода кипит при температуре чуть выше 212 градусов.
Если бы вы собирались заварить себе чашку хорошего чая на вершине Эвереста (29 029 футов), вам нужно было бы только довести воду до температуры около 162 градусов, чтобы она закипела. С другой стороны, в Долине Смерти, штат Калифорния, — самой низкой точке в США, на 282 футах ниже уровня моря — вода кипит при температуре чуть выше 212 градусов.
Низкое атмосферное давление на большой высоте также влияет на приготовление пищи и выпечку, поэтому многие рецепты и смеси имеют особые «высотные» направления.Приготовление пищи обычно занимает больше времени на высоте более 3000 футов или около того, и продукты, как правило, сохнут быстрее. Тесто поднимается быстрее (потому что газы расширяются больше), а жидкости в тесте испаряются быстрее.
Да, можно кипятить воду комнатной температуры. Вот как
По мере того, как вы повышаете температуру воды, появляется все больше и больше частиц воды, обладающих достаточной энергией, чтобы покинуть водную фазу и стать водяным паром.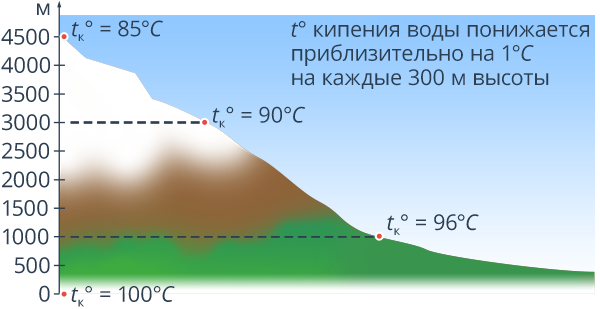 Таким образом, давление водяного пара будет увеличиваться с увеличением температуры воды (это важно).
Таким образом, давление водяного пара будет увеличиваться с увеличением температуры воды (это важно).
Кипяток
Теперь кипяток. Вот как выглядит вода, когда она нагревается до 100 ° C (в замедленном режиме). Да, я знаю, что вы видели это раньше. но все равно круто.
Посмотрите на пузыри и ответьте на следующий вопрос (это классический):
Из чего сделаны пузыри в кипящей воде?
Спросите у друзей. Спросите своих врагов. Спроси себя.
Пузырьки сделаны из воздуха? А как насчет водорода и кислорода? Нет.Пузырьки представляют собой водяной пар — это небольшие карманы воды в газовой фазе. Я имею в виду, они не могли быть воздухом. Откуда взялся этот воздух? Единственный вариант — пузырьки сделаны из водяного пара.
Итак, что происходит, чтобы сделать эти кипящие пузырьки водяного пара? Все дело в температуре и давлении пара. По мере увеличения температуры воды средняя скорость частиц воды также увеличивается. В какой-то момент у молекул воды будет достаточно энергии, чтобы оттолкнуть другие молекулы воды в жидкой фазе с образованием пузыря. Но вода должна быть достаточно горячей, чтобы частицы двигались достаточно быстро.
Но вода должна быть достаточно горячей, чтобы частицы двигались достаточно быстро.
Но подождите! Еще дело в давлении пара. Чтобы пузырек не схлопнулся, давление внутри пузыря должно быть равно давлению снаружи пузыря. Внутри пузыря — давление пара, а снаружи — давление воды. Это означает, что для закипания воды температура должна повышаться до тех пор, пока давление пара не станет равным внешнему давлению, и может образоваться пузырь.
А как насчет внешнего давления? Это зависит от двух вещей.Во-первых, сама вода. Чтобы вода не схлопывалась, более глубокая вода должна иметь более высокое давление. Итак, давление воды зависит от глубины, плотности воды и гравитационного поля (поскольку это связано с весом воды). Для обычного стакана с водой давление на 2 сантиметра ниже поверхности всего лишь на 0,2% выше атмосферного. И это второе, что способствует общему давлению — атмосфера. Атмосфера также давит на поверхность жидкости, увеличивая давление в жидкости.
Пониженное давление
А теперь самое интересное. Что, если я уменьшу атмосферное давление, добавив немного жидкой воды? Это также снизило бы давление в жидкости. Если я достаточно уменьшу это давление, я смогу снизить его до того же уровня, что и давление пара. Бум. Теперь у частиц воды достаточно энергии, чтобы образовать свои крошечные кипящие пузырьки — без необходимости повышения температуры.
Что, если я уменьшу атмосферное давление, добавив немного жидкой воды? Это также снизило бы давление в жидкости. Если я достаточно уменьшу это давление, я смогу снизить его до того же уровня, что и давление пара. Бум. Теперь у частиц воды достаточно энергии, чтобы образовать свои крошечные кипящие пузырьки — без необходимости повышения температуры.
При какой температуре закипает вода? Точка кипения и высота — сложный процент
Нажмите для увеличения
Вода всегда кипит при 100˚C, верно? Неправильный! Хотя это один из основных фактов, который вы, вероятно, усвоили довольно рано, еще на школьных уроках естествознания, ваша высота над уровнем моря может повлиять на температуру, при которой вода закипает, из-за разницы в давлении воздуха.Здесь мы рассмотрим точки кипения воды в различных местах, а также подробно рассмотрим причины различий.
Температура кипения воды от самой высокой точки над уровнем моря, горы Эверест, до самой низкой, Мертвого моря, может варьироваться от чуть ниже 70 ˚C до более 101 ˚C. Причина такой вариации сводится к разнице атмосферного давления на разных высотах.
Причина такой вариации сводится к разнице атмосферного давления на разных высотах.
Атмосферное давление — это давление, создаваемое массой атмосферы Земли, которое на уровне моря просто определяется как 1 атмосфера, или 101 325 паскалей.Даже на одном уровне есть естественные колебания давления воздуха; регионы высокого и низкого давления обычно показаны как части прогноза погоды, но эти отклонения незначительны по сравнению с изменениями, происходящими по мере того, как мы поднимаемся выше в атмосферу. По мере того, как ваша высота (высота над уровнем моря) увеличивается, вес атмосферы над вами уменьшается (так как вы теперь находитесь над некоторой ее частью), и поэтому давление также уменьшается.
Чтобы понять, как это влияет на температуру кипения воды, нам сначала нужно понять, что происходит, когда вода закипает.Для этого нам нужно поговорить о том, что называется «давлением пара». Это можно представить как тенденцию молекул жидкости уходить в газовую фазу над жидкостью. Давление пара увеличивается с повышением температуры, поскольку молекулы движутся быстрее, и у большего количества из них есть энергия, чтобы покинуть жидкость. Когда давление пара достигает значения, эквивалентного давлению окружающего воздуха, жидкость закипает.
Давление пара увеличивается с повышением температуры, поскольку молекулы движутся быстрее, и у большего количества из них есть энергия, чтобы покинуть жидкость. Когда давление пара достигает значения, эквивалентного давлению окружающего воздуха, жидкость закипает.
На уровне моря давление пара равно атмосферному давлению при 100 ˚C, следовательно, это температура, при которой вода закипает.По мере того, как мы поднимаемся выше в атмосферу и атмосферное давление падает, уменьшается и давление пара, необходимое для кипения жидкости. Из-за этого температура, необходимая для достижения необходимого пара, становится все ниже и ниже по мере того, как мы поднимаемся над уровнем моря, и поэтому жидкость будет кипеть при более низкой температуре.
Это, конечно, факт, справедливый для всех жидкостей, а не только для воды. И не только атмосферное давление может повлиять на температуру кипения воды.Большинство из нас, вероятно, знают, что добавление соли в воду во время приготовления пищи увеличивает температуру кипения воды, и это также связано с давлением пара.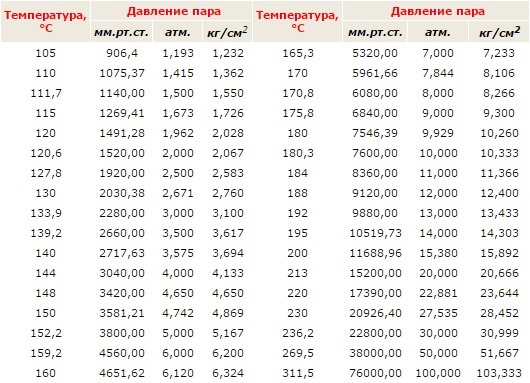 Фактически, добавление любого растворенного вещества к воде увеличивает температуру кипения, поскольку снижает давление пара, а это означает, что требуется немного более высокая температура, чтобы давление пара стало равным атмосферному давлению и вода закипела.
Фактически, добавление любого растворенного вещества к воде увеличивает температуру кипения, поскольку снижает давление пара, а это означает, что требуется немного более высокая температура, чтобы давление пара стало равным атмосферному давлению и вода закипела.
Еще одним фактором, который может повлиять на температуру кипения воды, является материал, из которого сделана емкость, в которой ее варят.Эксперименты показали, что вода при одном и том же давлении будет кипеть при разных температурах в металлических и стеклянных сосудах. Предполагается, что это происходит из-за того, что вода кипит при более высокой температуре в сосудах, к которым ее молекулы прилипают сильнее — здесь есть гораздо больше подробностей об этом явлении.
Итак, температура кипения воды не абсолютна, и на нее может влиять целый ряд факторов. Полезная информация, если вы когда-нибудь захотите заварить чашку чая на Эвересте — более низкая точка кипения будет означать, что чашка, которая у вас получится, будет довольно слабой и неприятной!
Понравились этот пост и рисунок? Подумайте о поддержке сложного процента на Patreon и получайте предварительные просмотры предстоящих публикаций и многое другое!
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4. 0 Международная лицензия. См. Рекомендации по использованию содержания сайта.
0 Международная лицензия. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
Кипение — Chemistry LibreTexts
Кипение — это процесс, при котором жидкость превращается в пар при нагревании до точки кипения. Переход из жидкой фазы в газообразную происходит, когда давление пара жидкости равно атмосферному давлению, действующему на жидкость. Кипение — это физическое изменение, и молекулы химически не изменяются во время процесса.
Как происходит кипение?
Когда атомы или молекулы жидкости способны разойтись достаточно, чтобы перейти из жидкой фазы в газообразную, образуются пузырьки и происходит кипение.
Рисунок 1: Образование пузырьков в кипящей воде.
Видео: Основы кипячения (https://www.youtube.com/embed/Py0GEByCke4).
Точка кипения — это температура, при которой происходит кипение определенной жидкости. Например, для воды температура кипения составляет 100ºC при давлении 1 атм. Температура кипения жидкости зависит от температуры, атмосферного давления и давления пара жидкости. Когда атмосферное давление сравняется с давлением пара жидкости, начнется кипение.
Температура кипения жидкости зависит от температуры, атмосферного давления и давления пара жидкости. Когда атмосферное давление сравняется с давлением пара жидкости, начнется кипение.
Жидкость закипит, если атмосферное давление = давление пара жидкости
Упражнение 1: Основы кипячения
Что находится внутри пузырьков при закипании жидкости?
Ответ
Пузырьки в кипящей жидкости состоят из молекул жидкости, которые набрали достаточно энергии, чтобы перейти в газовую фазу.
Упражнение 2
Опишите образование пузырьков в кипящей жидкости (ответ смотрите в видео).
Температура и кипение
Когда происходит кипение, более энергичные молекулы превращаются в газ, растекаются и образуют пузырьки. Они поднимаются на поверхность и попадают в атмосферу. Для перехода от жидкости к газу требуется энергия (см. Энтальпию испарения). Кроме того, молекулы газа, покидающие жидкость, отводят тепловую энергию от жидкости. Следовательно, температура жидкости во время кипения остается постоянной .Например, при кипении вода будет оставаться при температуре 100ºC (при давлении 1 атм или 101,3 кПа). График зависимости температуры от времени перехода воды из жидкости в газ, называемый кривой нагрева, показывает постоянную температуру, пока вода кипит.
Упражнение 3: Кривая нагрева воды
На основании кривой нагрева ниже, когда температура \ (H_2O \) превысит 100 ° C (в открытой системе)?
Ответ
Температура \ (H_2O \) превысит 100 ºC только после того, как он полностью перейдет в газовую фазу.Пока есть жидкость, температура остается постоянной.
Атмосферное давление и кипение
Давление газа над жидкостью влияет на температуру кипения. В открытой системе это называется атмосферным давлением. Чем выше давление, тем больше энергии требуется для кипения жидкости и тем выше температура кипения.
Более высокое атмосферное давление = больше энергии, необходимой для кипения = более высокая точка кипения
В открытой системе это можно представить как молекулы воздуха, сталкивающиеся с поверхностью жидкости и создающие давление.Это давление передается по всей жидкости и затрудняет образование пузырьков и кипение. Если давление понижается, жидкости требуется меньше энергии для перехода в газовую фазу, и кипение происходит при более низкой температуре.
Видео: Атмосферное давление и кипение (www.youtube.com/watch?v=aiwy…ature=youtu.be).
Упражнение 4
На основе атмосферного давления спрогнозируйте точку кипения воды в следующих местах.Помните, что на Земле вода закипает при температуре 100ºC на уровне моря. Предположим постоянную температуру.
- Земля на уровне моря: 101,3 кПа
- Вершина Эвереста: 33,7 кПа
- Mars (в среднем): 0,6 кПа
- Венера (поверхность): 9200 кПа
Ответ
Поскольку вода закипает при 100ºC, вода на Марсе быстро закипает (фактическое значение около 10ºC). Температура кипения на горе. Эверест будет ближе к воде (фактическое значение около 70ºC).На Венере вода кипит намного выше 100ºC.
Давление пара и кипение
Молекулы, покидающие жидкость в результате испарения, создают восходящее давление, поскольку они сталкиваются с молекулами воздуха. Этот толчок вверх называется давлением пара. У разных веществ разное давление пара и, следовательно, разные точки кипения. Это связано с разными межмолекулярными силами между молекулами.
Видео: Давление пара и биолинг (youtu.be/ffBusZO-TO0)
Давление пара жидкости снижает давление, оказываемое на жидкость атмосферой.В результате жидкости с высоким давлением пара имеют более низкие точки кипения. Давление пара можно увеличить, нагревая жидкость и заставляя больше молекул проникать в атмосферу. В точке, где давление паров равно атмосферному давлению , начнется кипение. Фактически, без какого-либо внешнего давления молекулы жидкости смогут распространяться и переходить из жидкой фазы в газообразную. Газ в виде пузырьков в жидкости поднимается на поверхность и выбрасывается в атмосферу.
Авторы и авторство
Уэйн Бреслин, NBCT, Ph.D. (Средняя школа Гейтерсбурга)
- Чедвик Уайлер
Точка плавления, точка замерзания, точка кипения
Точка плавления, точка замерзания,
Температура кипения
Температура плавления и замерзания
Путевая точка
Чистые кристаллические твердые вещества имеют характеристическую температуру плавления ,
температура, при которой твердое вещество плавится и превращается в жидкость.Переход между твердым телом
а жидкость настолько острая для небольших образцов чистого вещества, что точки плавления могут
быть измеренным до 0,1 o ° C. Температура плавления твердого кислорода, например, составляет
-218,4 o С.
Жидкости имеют характерную температуру, при которой они превращаются в твердые вещества, известную как
их точка замерзания . Теоретически температура плавления твердого тела должна быть
то же, что и точка замерзания жидкости. На практике небольшие различия между этими
количества можно наблюдать.
Трудно, если не невозможно, нагреть твердое тело выше его точки плавления, потому что
тепло, которое входит в твердое тело при его температуре плавления, используется для преобразования твердого вещества в
жидкость. Однако возможно охлаждение некоторых жидкостей до температур ниже их точки замерзания.
точки, не образуя твердого тела. Когда это сделано, жидкость называется переохлажденной .
Пример переохлажденной жидкости может быть получен путем нагревания твердого ацетата натрия.
тригидрат (NaCH 3 CO 2 3 H 2 O).Когда это твердое вещество тает,
ацетат натрия растворяется в воде, которая была захвачена кристаллом, с образованием раствора.
Когда раствор остынет до комнатной температуры, он должен затвердеть. Но часто этого не происходит. Если
в жидкость добавляется небольшой кристалл тригидрата ацетата натрия, однако содержимое
колбы затвердевают в течение нескольких секунд.
Жидкость может переохлаждаться, потому что частицы твердого тела упакованы в
регулярная структура, характерная для данного вещества.Что-нибудь из этого
твердые вещества образуются очень легко; другие нет. Некоторым нужна частица пыли или затравочный кристалл,
действовать как место, на котором кристалл может расти. Для образования кристаллов натрия
тригидрат ацетата, ионы Na + , ионы CH 3 CO 2 — ионы ,
и молекулы воды должны собраться вместе в правильной ориентации. Это сложно для
эти частицы организуются, но затравочный кристалл может обеспечить основу для
что правильное расположение ионов и молекул воды может расти.
Потому что трудно нагреть твердые тела до температур выше их точек плавления, и
поскольку чистые твердые вещества имеют тенденцию плавиться в очень небольшом диапазоне температур, точки плавления
часто используется для идентификации соединений. Мы можем различать три известных сахара
как глюкоза ( MP = 150 o C), фруктоза ( MP =
103-105 o C) и сахароза ( MP = 185-186 o C), для
Например, путем определения точки плавления небольшого образца.
Измерения температуры плавления твердого тела также могут предоставить информацию о
чистота вещества. Чистые кристаллические твердые вещества плавятся в очень узком диапазоне
температуры, тогда как смеси плавятся в широком диапазоне температур. Смеси также склонны к
плавятся при температурах ниже точек плавления чистых твердых веществ.
Точка кипения
Когда жидкость нагревается, она в конечном итоге достигает температуры, при которой пар
давление достаточно велико, чтобы внутри тела жидкости образовывались пузырьки.Эта температура
называется точкой кипения . Как только жидкость закипит,
температура остается постоянной до тех пор, пока вся жидкость не превратится в газ.
Нормальная температура кипения воды составляет 100 o C. Но если вы попытаетесь приготовить яйцо в
кипящей воды во время кемпинга в Скалистых горах на высоте 10 000 футов, вы
обнаружит, что яйцо готовится дольше, потому что вода кипит только при температуре 90 o ° C.
на этой высоте.
Теоретически нельзя нагревать жидкость до температуры выше нормальной.
точка кипения. Однако до того, как микроволновые печи стали популярными, использовались скороварки.
чтобы сократить время приготовления пищи. В обычной скороварке вода
может оставаться жидкостью при температурах до 120 o C, а пища готовится в
меньше одной трети обычного времени.
Чтобы объяснить, почему вода закипает при температуре 90 o C в горах и 120 o C в
скороварку, даже если нормальная температура кипения воды составляет 100 o C, мы
надо понимать, почему закипает жидкость.По определению жидкость закипает, когда пар
давление газа, выходящего из жидкости, равно давлению, оказываемому на
жидкость в окружающей среде, как показано на рисунке ниже.
| Жидкости кипят, когда давление их паров равно давлению, оказываемому на жидкость своим окружением. |
Нормальная температура кипения воды составляет 100 o C, потому что это температура
при котором давление пара воды составляет 760 мм рт. ст., или 1 атм.В нормальных условиях, когда
давление атмосферы примерно 760 мм рт. ст., вода закипает при температуре 100 o C.
На высоте 10 000 футов над уровнем моря атмосферное давление составляет всего 526 мм рт. На этих
над уровнем моря вода закипает, когда давление ее паров составляет 526 мм рт. ст., что происходит при температуре
из 90 o C.
Скороварки оснащены клапаном, который позволяет выходить газу при повышении давления.
внутри банка превышает некоторую фиксированную стоимость. Этот клапан часто устанавливается на 15 фунтов на квадратный дюйм, что означает
что водяной пар внутри горшка должен достичь давления 2 атм, прежде чем он сможет выйти.Поскольку вода не достигает давления пара 2 атм, пока температура не достигнет 120 o ° C,
он кипит в этом контейнере при 120 o C.
Жидкости часто кипят неравномерно, или поднимается вверх . Они имеют тенденцию натыкаться, когда есть
нет ли царапин на стенках емкости, где могут образоваться пузыри. Натыкаясь
легко предотвратить, добавив в жидкость несколько кипящих стружек, которые обеспечивают грубую
поверхность, на которой могут образовываться пузырьки. При варке чипсов практически все
на поверхности этих стружек образуются пузыри, которые поднимаются сквозь раствор.
Температура кипения воды на разных высотах
Одним из наиболее значительных изменений, которые происходят в высокогорных районах в отношении приготовления пищи, является температура кипения воды. По мере увеличения высоты атмосферное давление, оказывающее давление на воду, уменьшается, что позволяет воде закипать при более низких температурах.
Более низкая точка кипения означает, что пища готовится при более низкой температуре, несмотря на то, что вода кипит.Важно понимать, насколько снижается температура кипящей воды с увеличением высоты.
Поскольку почти треть семей в США проживает в высокогорных районах, эта простая наука может сильно повлиять на вашу готовку. Сравните свою высоту с этой таблицей, чтобы узнать, готовите ли вы при более низких температурах, чем ожидалось.
Иллюстрация: Эшли Делеон Николь. © Ель, 2019
Температура кипения воды на разной высоте
| Высота ft.(метры) | Точка кипения — | Температура кипения — Цельсия |
| 0 футов (0 м) | 212 ºF | 100 ºC |
| 500 футов (152 м) | 211 ºF | 99,5 ºC |
| 1000 футов (305 м) | 210 ºF | 99 ºC |
| 1500 футов (457 м) | 209 ºF | 98,5 ºC |
| 2000 футов (610 м) | 208 ºF | 98 ºC |
| 2500 футов.(762 м.) | 207 ºF | 97,5 ºC |
| 3000 футов (914 м) | 206 ºF | 97 ºC |
| 3500 футов (1067 м) | 205,5 ºF | 96 ºC |
| 4000 футов (1219 м) | 204 ºF | 95,5 ºC |
| 4500 футов (1372 м) | 203,5 ºF | 95 ºC |
| 5000 футов (1524 м) | 202 ºF | 94,5 ºC |
| 5500 футов.(1676 м.) | 201,5 ºF | 94 ºC |
| 6000 футов (1829 м) | 200,5 ºF | 93,5 ºC |
| 6500 футов (1981 м) | 199,5 ºF | 93 ºC |
| 7000 футов (2134 м) | 198,5 ºF | 92,5 ºC |
| 7500 футов (2286 м) | 198 ºF | 92 ºC |
| 8000 футов (2438 м) | 197 ºF | 91.5 ºC |
| 8500 футов (2591 м) | 196 ºF | 91 ºC |
| 9000 футов (2743 м) | 195 ºF | 90,5 ºC |
| 9500 футов (2895 м) | 194 ºF | 90 ºC |
| 10000 футов (3048 м) | 193 ºF | 89,5 ºC |
Температуры округлены до половины градуса.
Как найти свою высоту
Узнать свою высоту в Интернете или с помощью мобильного телефона стало проще, чем когда-либо.Вы можете просто спросить своего голосового помощника: «Какая у меня высота?» и получите быстрый ответ. Если вы используете настольный компьютер, вы можете выполнить поиск в Интернете по высоте над уровнем моря. Если у вас есть GPS, он также сообщит вам вашу высоту.
Советы по приготовлению на большой высоте
Если бы вам нужно было беспокоиться только о том, как кипящая вода зависит от высоты, приготовление пищи не было бы такой большой проблемой. Ваша кастрюля с водой закипит раньше, так как она закипит при более низкой температуре, чем на уровне моря.
Вы бы варили пищу дольше, потому что она кипит при более низкой температуре. Это означает, что макароны и рис готовятся дольше, и вам может потребоваться добавить больше воды в кастрюлю, поскольку она выкипит, прежде чем они приобретут нужную консистенцию.
Но кипячение — не единственное, на что нужно обращать внимание. Для каждого метода приготовления, типа ингредиентов и комбинации ингредиентов могут потребоваться разные настройки, чтобы компенсировать большую высоту. Как вы можете видеть на диаграмме, не существует единого решения для больших высот.Например, если вы используете хлебопечку, вам нужно будет настроить рецепты хлебопечки для большой высоты.
Кипящая вода становится все горячее?
Как только вода закипает, ее температура остается стабильной.
Вы знаете, что происходит с температурой кипения воды в кастрюле на сильном огне? Это общий научный вопрос, особенно для тестов, потому что знание ответа показывает, насколько хорошо вы понимаете процесс кипячения. Ответ заключается в том, что вода достигает температуры кипения и остается там.
Температура закипания воды не везде одинакова. Температура кипения зависит от давления. На уровне моря вода кипит при 100 ° C (212 ° F) и замерзает при 0 ° C (32 ° F). Если кипятить воду под более высоким давлением (например, ниже уровня моря), температура кипения будет выше 100 ° C. При более низком давлении (например, в горах) температура кипения ниже.
Но какой бы ни была точка кипения, когда вода достигает ее и претерпевает фазовый переход в водяной пар (пар), температура перестает расти.Вы можете увеличить огонь так сильно, как захотите. Вода может закипеть сильнее и быстрее превратиться в пар, но горячее не станет. Фактически, на микроскопическом уровне могут быть более прохладные участки кипящей воды. Когда пузырьки пара образуются возле источника тепла, например, на дне кастрюли, пузырьки газа изолируют воду от тепла. Это не имеет большого значения для домашней кухни, но имеет важное значение для промышленного применения.
Вода горячее точки кипения и холоднее точки замерзания
Жидкая вода может быть горячее 100 ° C (212 ° F) и холоднее 0 ° C (32 ° F).Нагревание воды выше точки кипения без кипения называется перегревом . Если вода перегрета, она может превысить точку кипения без кипения. Возможно, вы не понаслышке знакомы с этим явлением, поскольку оно довольно часто встречается при приготовлении воды в микроволновой печи. Очень чистая вода без пузырьков воздуха в гладкой посуде может перегреться, а затем резко вскипеть, если ее потревожить.
Замерзание воды ниже точки замерзания без образования льда называется переохлаждением .Чтобы испытать это, поместите емкость с бутилированной водой в миску со льдом. Бутилированная вода работает лучше, чем водопроводная вода, поскольку она обычно очищена (дистиллированная или обратный осмос) и содержит минимум твердых частиц и растворенного воздуха. Маленькие частицы действуют как центры зародышеобразования, способствуя замораживанию. Добавьте ко льду соль, чтобы снизить температуру. Температура бутылки с водой может упасть ниже точки замерзания, но вода не превратится в лед, пока вы не возьмете ее и не потревожите.
После того, как вода замерзнет и превратится в лед, лед можно полностью охладить до абсолютного нуля.Когда вода превращается в пар, пар может нагреваться до точки, при которой вода распадается на составляющие его атомы.


 Таблица от -305 до 9144 м, в °C и °F
Таблица от -305 до 9144 м, в °C и °F Таблица от -305 до 9144 м, в °C и °F
Таблица от -305 до 9144 м, в °C и °F 0
0 1
1 3
3 0
0 2
2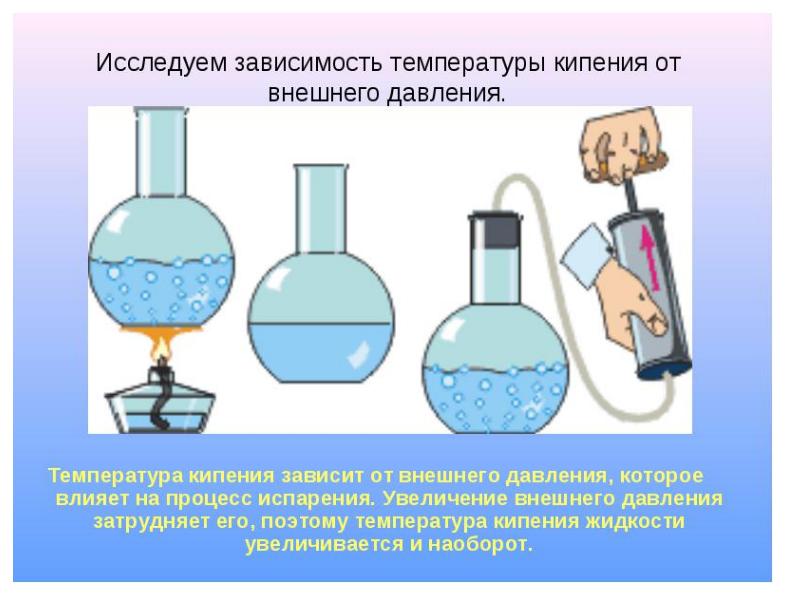 6
6 3
3 8
8 3
3 1
1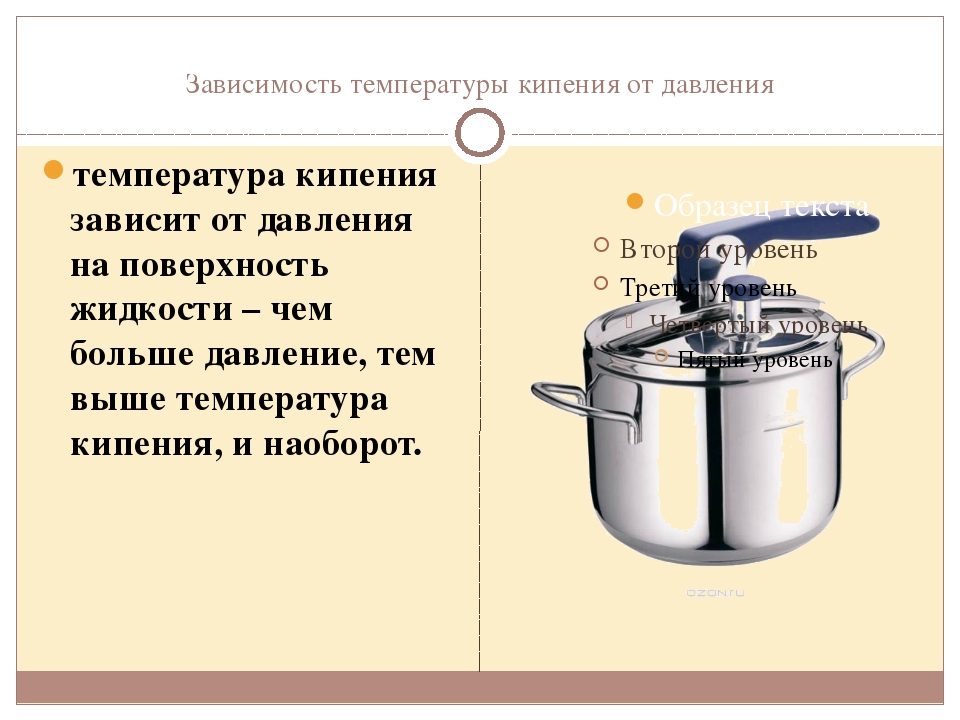 7
7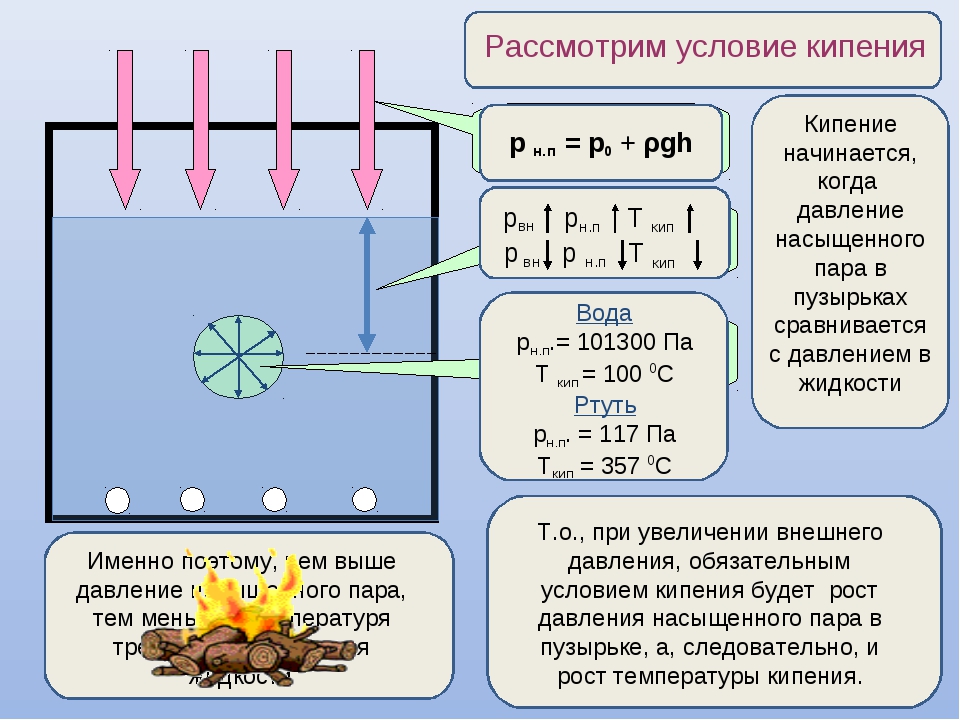 3
3 2
2 0
0 8
8 8
8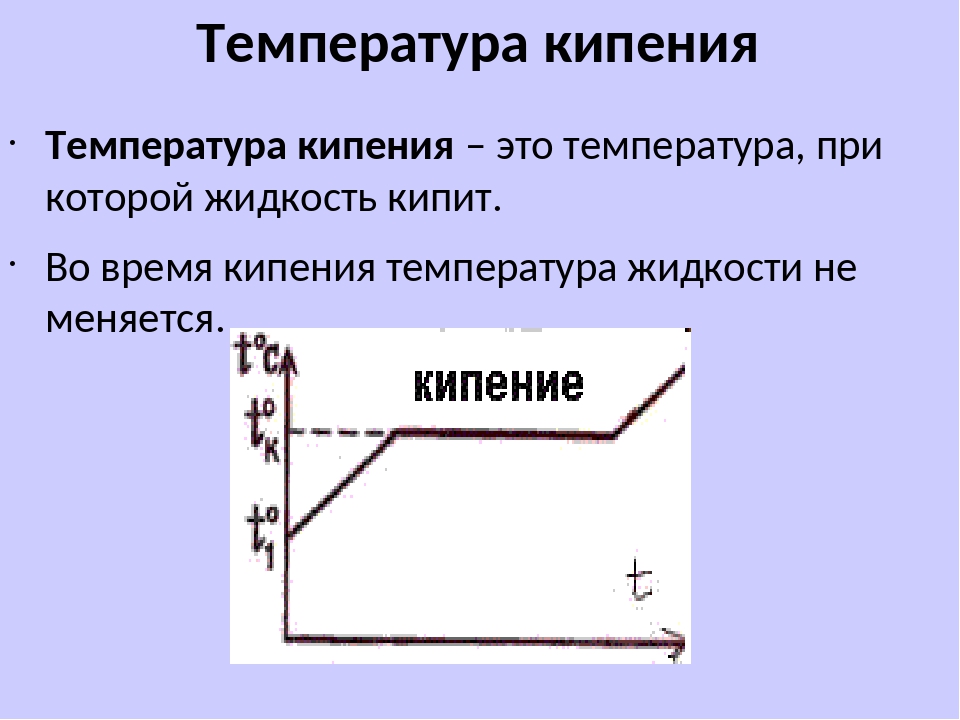 7
7 е. температура кипения примерно 72oC (161.5 oF)
е. температура кипения примерно 72oC (161.5 oF)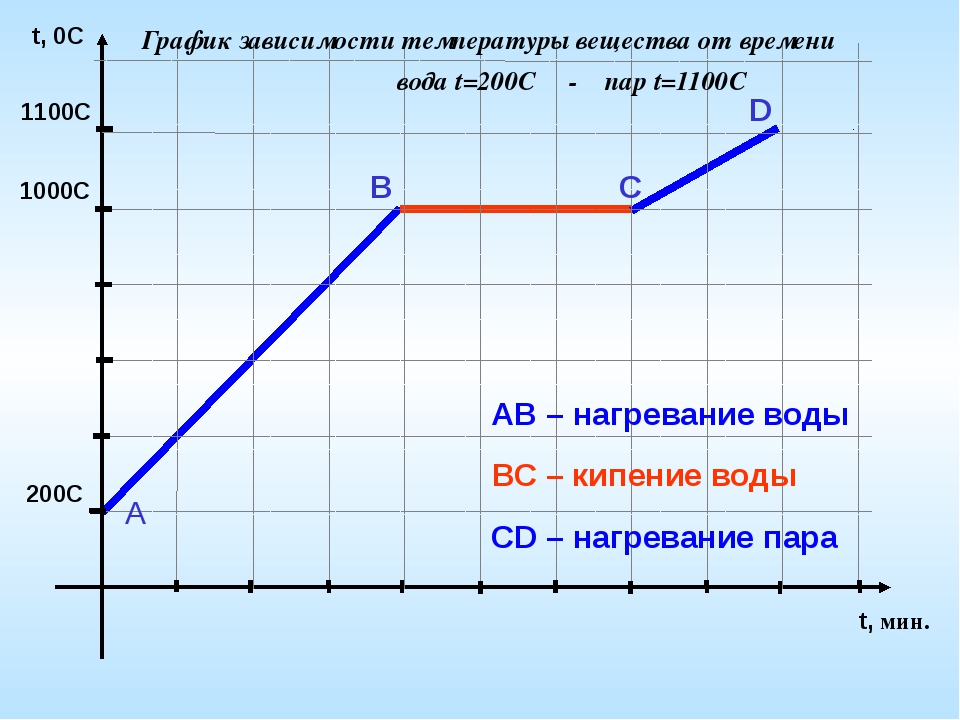 Если сверху вода еще не прогрелась, то пузырьки будут опускаться вниз, а затем опять устремляться обратно к поверхности;
Если сверху вода еще не прогрелась, то пузырьки будут опускаться вниз, а затем опять устремляться обратно к поверхности;